Intensyfikacja procesu AAV przy użyciu lizy o wysokiej zawartości soli i endonukleazy odpornej na sól
Na tej stronie opisano kluczowe kwestie dotyczące lizy komórek oraz sposób, w jaki połączenie wysokiego stężenia soli i endonukleazy tolerującej sól może być wykorzystane do zwiększenia miana wektora i jego zakaźności.

Czytaj więcej o
- Rozważania dotyczące lizy komórek
- Rozważania dotyczące trawienia DNA
- Rozwój odpornej na sól endonukleazy do produkcji wektorów AAV
- Wybór odpowiedniej benzonazy® do danego zastosowania
- Rozwiązywanie wyzwań związanych z wysoką zawartością soli
- Benzonase® FAQ
- Deviron® FAQ
- .Powiązane produkty
- Referencje
Produkcja wektorów adenowirusowych (AAV) obejmuje etap pośredni, który łączy lizę komórek i leczenie nukleazą. W tym przypadku detergenty są używane do rozbicia dwuwarstwy lipidowej komórek, uwalniając wektory, podczas gdy DNA komórek gospodarza i pozostałe plazmidy są trawione za pomocą endonukleazy w celu zapewnienia bezpieczeństwa pacjentów i poprawy wydajności procesu. Pozostałości DNA muszą zostać zredukowane do mniej niż 10 ng/dawkę, a rozmiar fragmentu musi być mniejszy niż około 200 par zasad, zgodnie z zaleceniami zawartymi w wytycznych FDA z 2020 r. dotyczących wniosków o zastosowanie nowych leków w terapiach genowych.
Uwagi dotyczące lizy komórek
Choć pozornie prosty, etap lizy komórek wiąże się z kilkoma wyzwaniami. Powszechnie stosowane detergenty do lizy komórek, takie jak TRITON™ X-100 (polietoksylan 4-tert-oktylofenolu), mogą być problematyczne. Od stycznia 2021 r. nieautoryzowane stosowanie TRITON™ X-100 zostało zakazane w Unii Europejskiej przez Komisję Europejską ze względu na umieszczenie go na liście REACH (Registration, Evaluation, Authorization and Restriction of Chemicals). Wykaz ten, wraz z surowymi wytycznymi dotyczącymi jego stosowania w UE, wynika z endokrynologicznego i mutagennego działania produktu degradacji TRITON™ X-100, który został uznany za niebezpieczny dla pacjentów i środowiska.
Dodatkowymi kwestiami przy wyborze detergentu do lizy komórek jest to, że nie powinien on uszkadzać wektorów wirusowych i infekcyjności cząstek wirusowych, a także nie powinien zakłócać dalszego procesu, co może wystąpić w przypadku stosowania polisorbatów. Wybrany detergent musi być również podatny na usuwanie i wykrywanie w kolejnych etapach przepływu pracy.
Wreszcie, ważne jest, aby zrozumieć wpływ stężenia soli na lizę komórek i wydajność wektorów. Historycznie, bufory lizujące stosowane do uwalniania kapsydów AAV zawierały fizjologiczne stężenie soli (150 mM NaCl). Ostatnie publikacje donoszą jednak, że zwiększenie stężenia soli do 500 mM zwiększa liczbę cząstek wektora i miana zakaźne oraz zmniejsza agregację AAV. Jak opisano poniżej, wysoka zawartość soli może jednak negatywnie wpływać na aktywność konwencjonalnych endonukleaz stosowanych w trawienia DNA w procesie produkcji wektorów AAV.
Wpływ wysokiego zasolenia podczas etapów pośrednich na wydajność AAV
Badanie przeprowadzono w celu określenia wpływu wyższego stężenia soli podczas lizy komórek. Wektory AAV5 produkowano w komórkach HEK293, które poddawano lizie z użyciem TRITON™ X-100, polisorbatu 20, Deviron® C16 lub Deviron® 13-S9. Podstawowa liczba kapsydów wytworzonych w procesie została określona przy użyciu 150 mM NaCl w buforze lizującym z polisorbatem 20. Zastosowanie 500 mM soli w buforze do lizy doprowadziło do wzrostu miana kapsydu AAV5 średnio o 29% (rysunek 1).

Rysunek 1.Wpływ lizy w wysokiej soli na produkcję miana AAV5.
Wpływ wysokiego stężenia soli podczas etapów środkowych na zakaźność AAV
Aby zmierzyć wpływ warunków 500mM NaCl na zakaźność AAV, przeprowadzono podobne badanie, w którym wektory AAV2 zostały wyprodukowane w komórkach HEK293. Podstawowe warunki buforu lizującego wynosiły 150 mM NaCl i polisorbat 20. Gdy stężenie soli zwiększono do 500 mM i zastosowano różne detergenty, zaobserwowano co najmniej 10-krotny wzrost zakaźności (rysunek 2). Jak wspomniano powyżej, dodatkową korzyścią ze stosowania wysokiego stężenia soli podczas lizy jest zmniejszenie agregacji AAV.
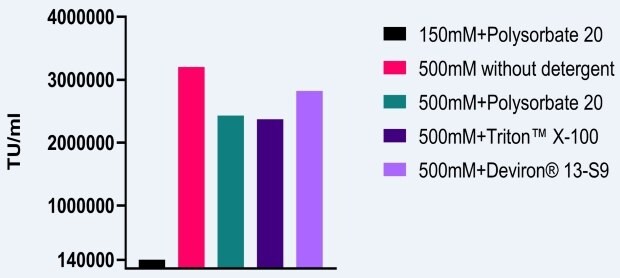
Rysunek 2.Wpływ lizy w wysokiej zawartości soli na infekcyjność AAV5.
Uwagi dotyczące trawienia DNA
Podobnie jak w przypadku etapu lizy komórek, trawienie DNA również wiąże się z kilkoma wyzwaniami. Jednym z najważniejszych jest konieczność pozyskiwania materiałów o odpowiedniej jakości, aby spełnić wymogi regulacyjne i zapewnić solidność łańcucha dostaw. Oprócz GMP, czystość, status glikozylacji i obciążenie biologiczne są jednymi z czynników, które należy wziąć pod uwagę. Tolerancja enzymu na wysokie zasolenie jest również krytycznym czynnikiem zapobiegającym stosowaniu wysokich stężeń soli podczas produkcji AAV.
Kluczowe kryteria wyboru enzymu do produkcji AAV
- IPEC PQG GMP lub równoważny dostępny, FDA DMF/BBMF
- >99% Czysty produkt<
- Bez modyfikacji potranslacyjnych
- Test na obecność mikoplazmy
- Test na obecność wirusów przygodnych
- Test na obecność endotoksyny
- Dostępność próbek Tailgate
- Silna logistyka & Solidność dostaw
- Wsparcie techniczne w przypadku pytań związanych z aplikacją
- Precyzyjna metoda wykrywania
Enzym stosowany do trawienia DNA musi być również skutecznie usuwany podczas dalszego przetwarzania i należy wziąć pod uwagę jego aktywność przy stężeniu soli stosowanym w procesie. Podczas gdy wyższe stężenie soli może poprawić wydajność wektora, interakcja między konwencjonalnymi enzymami endonukleazy a DNA nie zachodzi przy wysokiej sile jonowej, zapobiegając w ten sposób rozszczepieniu kwasu nukleinowego. Oznaczało to, że historycznie pożądana aktywność nukleazy i stężenie soli musiały być odpowiednio zrównoważone.

Rozwój endonukleazy tolerującej sól do produkcji wektorów AAV
Aby zaspokoić zapotrzebowanie na endonukleazę o skutecznej aktywności przy wysokich stężeniach soli preferowanych do lizy komórek, wykorzystaliśmy zaawansowane możliwości inżynierii białek do opracowania endonukleazy Benzonase® Salt Tolerant. Ta endonukleaza pochodzenia niezwierzęcego może trawić DNA i RNA w stężeniach soli do 1000 mM i jest uwalniana jako IPEC, PQG, GMP oraz jako produkt Emprove® Expert.
Do produkcji endonukleazy Benzonase® Salt Tolerant wykorzystywany jest bakteryjny system ekspresji, który zapewnia precyzyjnie określony rozmiar cząsteczki, brak modyfikacji potranslacyjnych i wysoką powtarzalność między partiami. Poniższe dane demonstrują aktywność i zalety endonukleazy Benzonase® Salt Tolerant.
Profil białkowy
Do produkcji endonukleazy Benzonase® Salt Tolerant wykorzystywany jest bakteryjny system ekspresji, który zapewnia precyzyjnie określony rozmiar cząsteczki, brak modyfikacji potranslacyjnych i wysoką powtarzalność między partiami. Jednorodny profil białka pozwala na dokładne wykrywanie za pomocą testów immunologicznych (takich jak ELISA), w przeciwieństwie do enzymów wyrażanych w drożdżach, które są silnie glikozylowane i mają wysoki profil zmienności po translacji między partiami.

Rysunek 3.Tożsamość i czystość endonukleazy Benzonase® Salt Tolerant Endonuclease i konkurenta A wykazana przez redukcję SDS-PAGE.

Rysunek 4.Tożsamość i czystość endonukleazy Benzonase® Salt Tolerant Endonuclease i konkurenta A wykazano za pomocą nieredukującego SDS-PAGE.
Produkcja w E.coli z endonukleazy Benzonase® Salt Tolerant Emprove® Expert wykazuje:
- Czyste i czyste białko
- Bez modyfikacji potranslacyjnych
- Wysoką powtarzalność między partiami
Wnioski przedstawione na rysunkach 3 i 4 pokazują, że endonukleaza Benzonase® Salt Tolerant Emprove® Expert ma precyzyjnie zdefiniowaną wielkość cząsteczkową. Wzorcowa endonukleaza (Comp A) aktywna przy wysokim zasoleniu nie.
Aktywność endonukleazy
Endonukleazy swoją aktywność zawdzięczają magnezowi. Rysunek 5 przedstawia porównanie aktywności endonukleazy Benzonase® Salt Tolerant i nukleaz nie tolerujących soli w różnych stężeniach magnezu. Aktywność endonukleazy Benzonase® Salt Tolerant była zwiększona przez wysokie stężenie soli, a aktywność była stabilna w zakresie 1-10mM Mg2+ i 500mM soli. Przy 150mM i 500mM soli, aktywność endonukleazy Benzonase® tolerującej sól była podobna do standardowej nukleazy z 10mM Mg2+ (Rysunek 6).
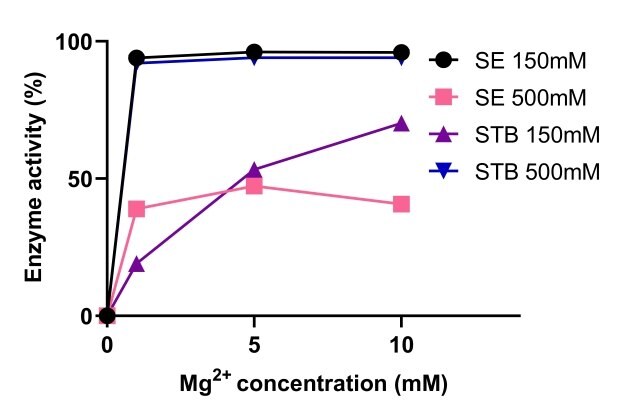
Rysunek 5.Porównanie aktywności endonukleazy Benzonase® tolerującej sól i endonukleazy nietolerującej soli.
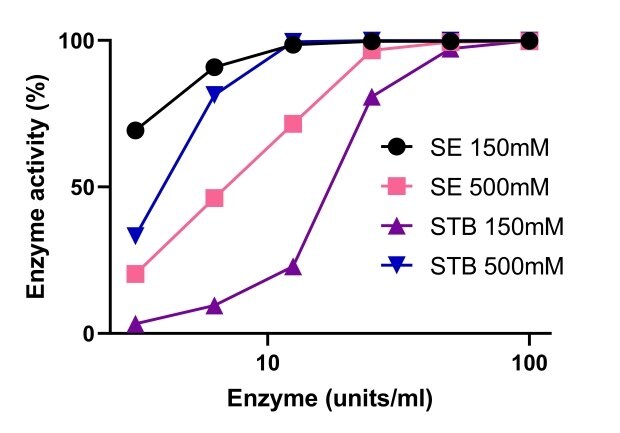
Rysunek 6.Porównanie aktywności endonukleazy Benzonase® tolerującej sól i endonukleazy nietolerującej soli.
Rysunek 7 przedstawia wyniki badania, w którym DNA było trawione przy użyciu endonukleazy Benzonase® Salt Tolerant i innych dostępnych na rynku endonukleaz aktywnych i nieaktywnych wobec soli, zarówno w 500 mM, jak i 1 M NaCl przez godzinę w temperaturze 37 °C. Endonukleaza Benzonase® Salt Tolerant całkowicie strawiła DNA w 500mM i 1M soli i wykazała podobną lub lepszą wydajność w porównaniu z innymi endonukleazami.

Rysunek 7.Porównanie trawienia DNA endonukleazą Benzonase® Salt Tolerant oraz dostępną w handlu endonukleazą aktywną i nieaktywną w temperaturze 37°C przez jedną godzinę.
Legenda
M - GeneRuler Ultra Low Range DNA Ladder Cat# SM1213
Comp A ** - Konkurent endonukleazy aktywnej solą
SE - Standardowa endonukleaza Cat# 103773
STB - Benzonase® Salt Tolerant Endonuclease Emprove® Expert
Rozmiar fragmentu kwasu nukleinowego
Benzonase® Salt Tolerant endonukleaza trawi DNA do niewykrywalnych poziomów poniżej wielkości 10 par zasad. Rysunek 8 przedstawia fragmenty DNA na 4% żelu agarozowym przy użyciu markera DNA o niskiej masie cząsteczkowej. Przy 150 mM soli DNA nie zostało całkowicie strawione; przy 500 mM soli po trawieniu nie pozostały żadne fragmenty DNA.

Rysunek 8.Fragment DNA o wielkości 25U/ml po trawieniu endonukleazą Benzonase® Salt Tolerant w temperaturze 37°C przez 30 minut.
Kompatybilność endonukleazy Benzonase® Salt Tolerant z detergentami w produkcji wektorów AAV
Oceniono aktywność endonukleazy Benzonase® Salt Tolerant w połączeniu z czterema różnymi detergentami stosowanymi do lizy komórek: TRITON™ X-100, polisorbatem 20 i dwoma alternatywnymi detergentami opracowanymi w odpowiedzi na zakaz stosowania TRITON™ X-100 - Deviron® C16 i 13-S9. Jak pokazano na rysunku 9, żaden z czterech detergentów nie miał wpływu na aktywność endonukleazy Benzonase® Salt Tolerant. DNA zostało całkowicie strawione w buforze lizującym 500 mM NaCl w obecności TRITON™ X-100, polisorbatu 20 i Deviron® 13-S9 (7B).
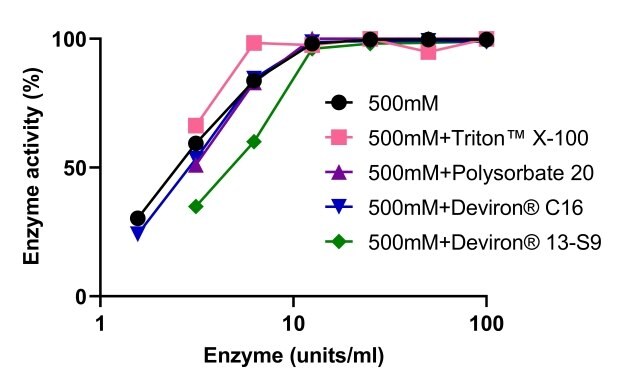
Rysunek 9.Benzonase® Aktywność endonukleazy odpornej na działanie soli w połączeniu z różnymi detergentami.

Rysunek 10.Benzonaza® Odporna na działanie soli trawi DNA w połączeniu z różnymi detergentami.
Wybór odpowiedniej endonukleazy Benzonase® do danego zastosowania
Endonukleaza Benzonase® Salt Tolerant powinna być używana do zastosowań, w których stężenie soli wynosi 200 mM lub więcej. Przy stężeniu soli 500mM, DNA zostanie całkowicie strawione, a jak pokazano powyżej, możliwe jest osiągnięcie 29% wzrostu miana AAV i blisko 2000% zakaźności. Bezpieczeństwo pacjentów wzrasta dzięki zastosowaniu wysokiej zawartości soli na tym etapie, ponieważ agregacja AAV jest utrudniona i zapewnione jest skuteczne usuwanie DNA z kapsydów wirusowych. Posttranslacyjny profil endonukleazy Benzonase® Salt Tolerant zapewnia również wykorzystanie nieglikozylowanego i łatwego do wykrycia białka w produkcji leków.
Do zastosowań, w których stężenie soli jest mniejsze niż 200mM, należy stosować standardową endonukleazę Benzonase® Safety Plus.
Tabela 3 podsumowuje specyfikacje naszych trzech referencyjnych endonukleaz GMP Benzonase®. Endonukleaza Benzonase® Salt Tolerant jest częścią programu Emprove®, który pomaga producentom zminimalizować zakłócenia i przeprowadzić dokładną ocenę ryzyka podczas przechodzenia od etapu rozwoju do produkcji. Program zapewnia surowce i materiały wyjściowe, które są rygorystycznie kwalifikowane zgodnie z wiodącymi w branży standardami. Materiały wchodzące w skład programu są wspierane przez kompleksowe pakiety dokumentacji, które spełniają potrzeby informacyjne producentów farmaceutycznych podczas kwalifikowania surowców, przeprowadzania oceny ryzyka i optymalizacji procesu produkcyjnego.
Solving the High Salt Challenge
Użycie wysokiego stężenia soli podczas etapu lizy komórek w produkcji AAV zapewnia wyższe miana i lepszą zakaźność. W przeszłości stosowanie tego podejścia było jednak niepraktyczne, ponieważ wysokie stężenie soli hamuje aktywność konwencjonalnych endonukleaz stosowanych do trawienia DNA.
Dostępność endonukleazy Benzonase® Salt Tolerant umożliwia włączenie stężeń soli rzędu 500mM podczas środkowego etapu lizy i trawienia DNA i jest kompatybilna ze wszystkimi testowanymi detergentami, w tym detergentami Deviron®, które mogą służyć jako alternatywa dla TRITON™ X-100.
Aby zamówić próbkę endonukleazy Benzonase® Salt Tolerant lub produktu z portfolio Deviron®, kliknij poniższy link i wypełnij nasz krótki formularz internetowy.
Benzonase® FAQ
Definicja
Czym jest endonukleaza Benzonase®?
Benzonase® endonuclease to nazwa handlowa należąca do Merck dla endonukleaz używanych w badaniach i zastosowaniach bioprocesowych.
Jakie enzymy można znaleźć pod tą nazwą handlową?
Rodzina endonukleaz Benzonase® obejmuje obecnie dwa różne enzymy.
- Starsza linia produktów endonukleazy Benzonase®, taka jak endonukleaza Benzonase® Safety Plus, wyizolowana z Serratia marcescens i rekombinowana w szczepie E. coli K12 W3110. Białko ma masę cząsteczkową 30 kDa i punkt izoelektryczny (PI) 6,85.
- Nowa endonukleaza Benzonase® Salt Tolerant (1.4445). Została zaprojektowana z wykorzystaniem najnowocześniejszych możliwości inżynierii białek, aby zapewnić najwyższą aktywność przy wysokich stężeniach soli.
Białko jest monomerem o masie cząsteczkowej około 27 kDa i pI przy pH 9,68. Specjalna sekcja tego FAQ dotyczy właśnie tego enzymu.
Sposób działania
Na jakiego rodzaju kwasy nukleinowe działa Benzonase® Nuclease? Czy mogę jej użyć do izolacji RNA?
Benzonase® Nuclease jest endonukleazą, która atakuje i degraduje wszystkie formy DNA i RNA (jednoniciowe, dwuniciowe, liniowe i koliste).
Jaki jest efekt końcowy całkowitej degradacji kwasu nukleinowego przez nukleazę Benzonase® nuclease?
Benzonase® nuclease całkowicie trawi kwasy nukleinowe do oligonukleotydów zakończonych 5'-monofosforanem o długości 2-5 zasad.
Inhibicja i usuwanie
Jak można inaktywować nukleazę Benzonase®?
Odwracalną inhibicję można osiągnąć stosując EDTA do chelatowania niezbędnych jonów metali. Nieodwracalną inaktywację można osiągnąć tylko w ekstremalnych warunkach (100 mM NaOH w 70 °C przez 30 minut). Benzonazę można oddzielić od produktu docelowego za pomocą chromatografii. Jednak ze względu na silną naturę tej endonukleazy, zalecamy, aby nie używać Benzonazy, jeśli wymagany jest produkt końcowy wolny od nukleazy.
Dlaczego endonukleaza Benzonase® nie działa? Co hamuje jej aktywność?
Endonukleaza Benzonase® jest aktywna w szerokim zakresie warunków pracy (patrz akapit Charakterystyka enzymu), jednak stężenie 1-2 mM Mg2+ jest niezbędne dla aktywności endonukleazy Benzonase®.
Mn2+ może zastąpić Mg2+; jednakże enzym osiągnie swoją optymalną aktywność tylko w obecności Mg2+. Jest hamowany (około 50% aktywności) przez stężenia kationów jednowartościowych > 300 mM, stężenia fosforanów > 100 mM i stężenia siarczanu amonu > 100 mM. Ponadto stężenia 1 mM EDTA również hamują aktywność endonukleazy Benzonase®.
Obserwuję utratę aktywności: dlaczego?
Endonukleaza Benzonase® jest zwykle bardzo stabilna, jednak w rzadkich przypadkach można zaobserwować utratę aktywności. Istnieje kilka możliwych przyczyn takiego stanu rzeczy: nieodwracalna inaktywacja może być spowodowana obecnością czynników denaturujących w próbce, np. proteaz; lub, alternatywnie, z powodu nieprawidłowego przechowywania. Odwracalna inaktywacja jest zwykle spowodowana obecnością środków chelatujących, takich jak EDTA, które usuwają niezbędne jony magnezu.
Jak usunąć endonukleazę Benzonase® w szablonie do bioprocesowania?
Usuwanie endonukleazy Benzonase® może być realizowane przez kilka jednostek operacyjnych, takich jak filtracja wgłębna do klarowania, filtracja z przepływem stycznym (TFF) do zatężania i diafiltracji oraz chromatografia (IEX, SEC, HIC). Więcej informacji można znaleźć w Dodatku, Rozdział 2 "Usuwanie endonukleazy Benzonase® " (strona 36).
STABILNOŚĆ I WARUNKI DZIAŁANIA
Moja endonukleaza Benzonase® została pozostawiona na stole. Czy nadal jest dobra?
Przeprowadziliśmy szeroko zakrojone testy stabilności endonukleazy Benzonase® i stwierdziliśmy, że jest ona wyjątkowo stabilna. Nawet przy przedłużonej inkubacji w temperaturze 37 °C, endonukleaza Benzonase® utrzymywała > 90% aktywności przez kilka miesięcy.
Chcę użyć innego buforu. Jakie warunki są absolutnie wymagane dla pełnej aktywności endonukleazy Benzonase® ? Co zmniejszy jej aktywność?
Endonukleaza Benzonase® wymaga 1-2 mM Mg2+ do aktywności. Benzonaza jest hamowana (około 50% aktywności) przez stężenia kationów jednowartościowych >50%, stężenia fosforanów >20 mM i stężenia siarczanu amonu >25 mM.
Ile więcej endonukleazy Benzonase® muszę dodać, jeśli pracuję w niskich temperaturach?
Endonukleaza Benzonase® wymaga 1-2 mM Mg2+ do aktywności. Benzonaza jest hamowana (około 50% aktywności) przez stężenia kationów jednowartościowych >50%, stężenia fosforanów >20 mM i stężenia siarczanu amonu >25 mM.
ZASTOSOWANIA DO EKSTRAKCJI BIAŁEK
Czy endnukleaza Benzonase® jest kompatybilna z koktajlami inhibitorów proteaz?
Tak. Należy jednak zachować ostrożność, ponieważ wiele koktajli inhibitorów proteaz zawiera EDTA. Stężenia większe niż 1 mM EDTA będą hamować aktywność endonukleazy Benzonase® .
Moje białko jest nierozpuszczalne i muszę przeprowadzić oczyszczanie w warunkach denaturujących. Czy endonukleaza Benzonase® będzie nadal działać w moczniku?
Aktywność endonukleazy Benzonase® faktycznie wzrasta w obecności mocznika w stężeniach do 6 M. Przy 6 M mocznika aktywność enzymu najpierw wzrasta, a następnie maleje w czasie. Przy 7 M mocznika endonukleaza Benzonase® denaturuje po 15 minutach, a aktywność jest tracona. Jednak przed inaktywacją następuje znaczna degradacja kwasów nukleinowych. Wyższe początkowe stężenia endonukleazy Benzonase® mogą częściowo zrekompensować wpływ 7 M mocznika.
Dlaczego istnieje tak wiele odmian endonukleazy Benzonase®? Co oznacza HC? Jaki wpływ ma czystość 90% w porównaniu do 99%?
Aby spełnić jak najszerszy zakres wymagań dotyczących przetwarzania i kosztów, endonukleaza Benzonase® jest dostępna w dwóch różnych klasach czystości: I stopień czystości (99% czystości) i II stopień czystości (90% czystości). Obie klasy są dostępne w stężeniu 25 U/μL lub w wysokim stężeniu (HC), które jest zdefiniowane jako 250 U/μL.
Aby zapoznać się z pełną listą produktów Benzonase® i różnicami między nimi, odwiedź naszą stronę endonukleazy tutaj.
Jaki jest efekt końcowy całkowitej degradacji kwasu nukleinowego przez endonukleazę Benzonase®?
Endonukleaza Benzonase® całkowicie trawi kwasy nukleinowe do oligonukleotydów zakończonych 5'-monofosforanem o długości 2-5 zasad.
ZASTOSOWANIA W BIOMANUFAKTURZE
Jaka jakość/ilość endonukleazy Benzonase® będzie odpowiednia dla danego zastosowania?
Istnieje kilka parametrów, które wpływają na aktywność endonukleazy Benzonase®. Dlatego optymalne warunki będą się różnić w zależności od procesu i należy je określić eksperymentalnie. Do zmniejszenia lepkości często wystarcza endonukleaza Benzonase® o stopniu czystości II (≥ 90%). W standardowych warunkach testu jedna jednostka endonukleazy Benzonase® odpowiada w przybliżeniu ilości enzymu wymaganej do całkowitego strawienia 37 µg DNA w ciągu 30 minut.
Na którym etapie muszę wprowadzić endonukleazę Benzonase® do mojego procesu?
Odpowiedź na to pytanie będzie się różnić w zależności od tego, dlaczego używasz endonukleazy Benzonase®. Mamy nadzieję, że podane przykładowe zastosowania pomogą odpowiedzieć na to pytanie. Jednakże, zgodnie z ogólną zasadą, endonukleaza Benzonase® jest zwykle najlepiej dodawana po hodowli i przed etapem wychwytywania.
Czy endonukleaza Benzonase® jest bezpieczna?
Tak, przeprowadzono badania toksykologiczne endonukleazy Benzonase® (dostępne raporty wewnętrzne). Toksyczność ogólnoustrojowa po pojedynczej aplikacji została zbadana na myszach i szczurach: nie zaobserwowano żadnych skutków toksycznych nawet przy bardzo wysokich dawkach. Ponadto nie zaobserwowano potencjału mutagennego u myszy leczonych dożylnie nawet bardzo wysoką dawką endonukleazy Benzonase®.
Dlaczego nie określono objętości zakresu napełniania 5-mililitrowych tubek?
Ponieważ aktywność (U/ml) endonukleazy Benzonase® może się różnić w zależności od partii produkcyjnej, zdecydowaliśmy się określić jednostki na probówkę, ale nie objętość. Objętość na probówkę można łatwo obliczyć na podstawie informacji o aktywności w certyfikacie analizy (CoA).
BENZONASE® SALT TOLERANT ENDONUCLEASE
Czy sekwencja jest podobna do starszych produktów Benzonase®, takich jak Benzonase® Safety Plus?
Endonukleaza Benzonase® Salt Tolerant Endonuclease to zupełnie nowy enzym zaprojektowany w oparciu o najnowocześniejszą inżynierię białek, aby zapewnić najwyższą aktywność przy wysokim stężeniu soli. Posiada inną sekwencję aminokwasów w porównaniu do innych starszych produktów Benzonase®.
Jakie są różnice w warunkach pracy w porównaniu do starszych produktów Benzonase®?
Jako endonukleaza, Benzonase® Salt Tolerant Endonuclease działa w takich samych warunkach jak starsze produkty Benzonase®. Wyjątkiem jest stężenie kationów jednowartościowych, gdzie zalecamy minimum 300 mM NaCl.
Jak zahamować działanie tego enzymu?
Enzym można zahamować przez dodanie EDTA lub wystawienie na działanie ciepła.
Jak usunąć ten enzym?
Odnieś się do "Jak usunąć endonukleazę Benzonase® w szablonie bioprocesowym?" powyżej.
Jak wykryć ślady tego enzymu?
Dla naszego starszego enzymu Benzonase®, dedykowany zestaw Elisa uzupełnia naszą ofertę, aby zapewnić niezawodne wykrywanie endonukleazy Benzonase® Salt Tolerant.
Dlaczego powinienem używać tego enzymu zamiast innych standardowych nukleaz?
Wszystkie standardowe nukleazy stosowane w bioprzetwarzaniu na rynku są oparte na bardzo podobnej sekwencji aminokwasów. Oznacza to, że ich zdolność do trawienia kwasów nukleinowych przy wysokim zasoleniu jest porównywalna i uważana za nieoptymalną.
Ich efektywne warunki pracy dla stężeń kationów jednowartościowych wahają się od 0 do 200 mM. Podobne do fizjologicznych stężeń soli występujących w procesach biologicznych.
Równolegle wykazano, że stosowanie wyższych stężeń soli, powyżej stężenia fizjologicznego podczas lizy komórek HEK, ma rzeczywisty wpływ na ogólną wydajność procesu. Przy stężeniu 500 mM NaCl infekcyjność i ogólny wskaźnik odzysku AAV są znacznie wyższe niż przy stężeniu soli 150 mM.
Użycie nukleazy odpornej na sól jest zatem konieczne do usunięcia kwasu nukleinowego w warunkach wysokiego stężenia soli.
Czy nadal mogę używać zwykłych nukleaz w stężeniach soli >200mM?
Aktywność zwykłych nukleaz w wyższych niż fizjologiczne stężeniach soli zostanie drastycznie zmniejszona, co doprowadzi do konieczności dodania większej ilości enzymów i skomplikowania procesu oczyszczania leku. Prowadzi to również do mało opłacalnego procesu z wyższymi kosztami posiadania. Z tego powodu zalecamy stosowanie nukleazy tolerującej sól.
Czy mogę używać zestawów do wykrywania innych dostawców do wykrywania endonukleazy tolerującej sól Benzonase®? Podobnie jak inne zestawy specjalizujące się w innych "aktywnych solowo" nukleazach?
Endonukleaza tolerująca sól Benzonase® jest zupełnie nowym enzymem, żaden zestaw do wykrywania nie może go wykryć na rynku poza naszymi własnymi zestawami do wykrywania.
Uwaga: Każdy produkt, który nie jest sprzedawany za pośrednictwem oficjalnego kanału Merck, w którym używana jest nazwa handlowa "Benzonase®", należy uznać za podrobiony produkt.
Dlaczego gospodarz ekspresji jest tak ważny dla produkcji enzymów?
Ekspresję białek można osiągnąć za pomocą wielu platform produkcyjnych. Najbardziej powszechne są ekspresje oparte na drożdżach i bakteriach. Mimo to, otrzymane produkty nie są podobne, a profile modyfikacji po translacji różnią się w zależności od zastosowanej platformy.
Białka ekspresji drożdży są silnie glikozylowane i modyfikowane, co może prowadzić do różnych problemów podczas użytkowania produktu, takich jak słaba dokładność wykrywania w testach przeciwciał.
Główna sól aktywna endonukleazy na rynku jest wyrażana w drożdżach.
Dlaczego posttranslacyjna modyfikacja nukleaz może wpływać na dokładność i skuteczność wykrywania?
Glikozylowane białka wykazują niejednorodny profil (jak widać na rysunku 2), nie powtarzalny z partii na partię. Ponieważ standardowe metody wykrywania wykorzystują testy immunologiczne, przeciwciała stworzone do wykrywania interesującego białka nie mogą pokryć pełnego spektrum modyfikacji obserwowanych podczas ekspresji drożdży. Prowadzi to do niskiej dokładności wykrywania metod opartych na przeciwciałach, takich jak zestawy Elisa.
Jaki jest profil toksykologiczny tego enzymu?
Endonukleaza Benzonase® Salt Tolerant ma taki sam profil toksykologiczny jak inne produkty z portfolio Benzonase®.
Czy możecie pomóc mi określić, która nukleaza będzie najbardziej opłacalna dla mojego procesu?
Posiadamy całe portfolio nukleaz spełniających wymagania regulacyjne i procesowe. Nie wahaj się poprosić o nasze wsparcie MSAT (Manufacturing Science And Technology) w zakresie rozwoju procesu. Nasi eksperci zajmują się wszystkimi szablonami produkcyjnymi, od etapu Upstream do Final Fill.
Deviron® FAQ
Czy mogę nadal używać TRITON™ X-100, jeśli nie znajduję się na terenie Unii Europejskiej?
Zakaz stosowania TRITON™ X-100 został wydany przez ECHA1 na mocy rozporządzenia REACH2. Głównym powodem była wysoka toksyczność produktu dla zdrowia ludzkiego i środowiska. Dlatego usunięcie tego produktu z bioprodukcji jest jednym z najgorętszych trendów w branży. Agencje regulacyjne spoza UE również ocenią wykorzystanie produktu, co doprowadzi do wprowadzenia innych zakazów.
Dlaczego nie mogę użyć detergentu klasy badawczej do biomanufaktury?
Detergenty są generalnie wytwarzane w ogromnych ilościach w reakcjach łańcuchowych chemii organicznej. Często jakość surowców jest niska, aby obniżyć koszty produkcji. Prowadzi to do bardzo niebezpiecznych zanieczyszczeń w produkcie końcowym, takich jak dioksyny lub nitrozoaminy. Te detergenty klasy badawczej są używane wyłącznie do czyszczenia i nie powinny znajdować się w pobliżu formulacji leków.
Jakie są kluczowe kroki, aby przejść na Deviron®?
Portfolio Deviron® obejmuje 3 dostępne partie produktu GMP EXCiPACT. Próbki tych partii można już zamówić w celu kwalifikacji. Dokumentacja Emprove® dostarczana z naszymi produktami zawiera wszystkie informacje potrzebne do złożenia wniosku do agencji regulacyjnych. Informacje toksykologiczne są również łatwo dostępne.
Chcę wypróbować Deviron®, ale nie mam specjalistycznej wiedzy, jak możecie mnie wesprzeć?
W zakresie wsparcia związanego z aplikacją możesz polegać na naszym zespole ekspertów ds. biomanufaktury, którzy przeprowadzą Cię przez tę zmianę.
Jaka jest różnica między MQ400/Emprove® Evolve i MQ500/Emprove® Expert (GMP)?
Aby pomóc w wypełnianiu wymogów prawnych, stworzyliśmy różne programy dokumentacji i jakości, aby pomóc Ci uzyskać odpowiedni produkt do właściwego zastosowania. Kliknij poniższe linki, aby dowiedzieć się więcej o Emprove® oraz programy M-Clarity®. Deviron® C16 Emprove® Evolve i Deviron® 13-S9 Emprove® Expert są częścią najwyższych poziomów jakości, które oferujemy.
Jakie są zalecane stężenia dla docelowych zastosowań?
W przypadku inaktywacji wirusów, norma ASTM3 E3042-16 stosowana dla TRITON™ X-100 jest nadal dokumentem wybieranym do produkcji przeciwciał monoklonalnych. Stężenia stosowane w przemyśle wahają się od 0,5 do 1% w zależności od zastosowania.
Do zastosowań związanych z lizą komórek stosuje się szeroki zakres stężeń, wszystkie specyficzne dla procesu. Zalecamy wypróbowanie kilku stężeń równolegle podczas opracowywania procesu. Nasze detergenty Deviron® są co najmniej tak samo skuteczne jak TRITON™ X-100 lub polisorbaty.
Czy możemy opracować metodę wykrywania GMP dla Deviron®?
Nasi eksperci ds. badań i rozwoju opracowali metody wykrywania dla naszego portfolio Deviron®, które mogą być przekazywane naszym klientom. Jednak w przypadku metod wykrywania GMP, nasze laboratorium Bioreliance® jest partnerem z wyboru. Skontaktuj się z nami w razie jakichkolwiek pytań.
Czy portfolio Deviron® jest kompatybilne z Benzonase® do zastosowań związanych z lizą komórek?
Benzonaza® jest złotym standardem trawienia DNA w procesach AAV4. Portfolio Deviron® zostało opracowane tak, aby było w pełni kompatybilne z Benzonase® Endonukleazami. Nie występuje utrata aktywności enzymatycznej ani właściwości detergentowych przy stosowaniu obu portfolio w połączeniu. Dane dotyczące zastosowań można znaleźć w broszurze portfolio Deviron®.
Jaka jest zdolność produkcyjna portfolio Deviron®?
Portfolio Deviron® jest wypuszczane z naszego zakładu w Darmstadt w Niemczech, możemy już zaoferować ponad 100 ton produktu rocznie. Zachęcamy do przedstawienia nam prognozy w celu omówienia konkretnych terminów realizacji.
1Europejska Agencja Chemikaliów
2Rejestracja, ocena, udzielanie zezwoleń i stosowane ograniczenia w zakresie chemikaliów*
Amerykańska Agencja ds.3American Standard for Test Method
4Adeno Associated Virus
TRITON jest znakiem towarowym The Dow Chemical Company ("Dow") lub spółki stowarzyszonej Dow, używanym na podstawie licencji.
W celu uzyskania bardziej szczegółowych informacji na temat intensyfikacji procesu AAV przy użyciu lizy o wysokiej zawartości soli i endonukleazy tolerującej sól:
- Przeczytaj kartę danych "Benzonase® Salt Tolerant endonuclease Emprove® Expert"
- Zobacz plakat techniczny "AV process intensification using high salt lysis & Benzonase® Salt Tolerant endonuclease"
- Zobacz ulotkę portfolio rodziny "Explore the Benzonase® endonuclease Portfolio"
- See the Deviron® broszurę portfolio detergentów "Odkryj bardziej ekologiczne alternatywy dla Triton™ X-100 w zastosowaniach biofarmaceutycznych"
Referencje
Udzielamy informacji i porad naszym klientom zgodnie z naszą najlepszą wiedzą i możliwościami, ale bez zobowiązań i odpowiedzialności. Obowiązujące przepisy prawa i regulacje muszą być przestrzegane przez naszych klientów we wszystkich przypadkach. Dotyczy to również wszelkich praw osób trzecich. Nasze informacje i porady nie zwalniają naszych klientów z ich własnej odpowiedzialności za sprawdzenie przydatności naszych produktów do zamierzonego celu.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?