Ciecze jonowe do zastosowań związanych z magazynowaniem energii
John D. Stenger-Smith1, Jennifer A. Irvin2
1Naval Air Warfare Center, Weapons Division, China Lake, CA 93555 , 2Texas State University, San Marcos, TX 78666
Material Matters 2009, 4.4, 103.
Wprowadzenie
Ciecze jonowe, zwane również cieczami jonowymi o temperaturze pokojowej, to sole organiczne, które są ciekłe w temperaturze pokojowej lub zbliżonej do niej. Sole te (Rysunek 1) są przedmiotem znacznego zainteresowania ze względu na ich bardzo niską lotność i zdolność do rozpuszczania szerokiej gamy związków; ta kombinacja właściwości sprawia, że ciecze jonowe są użyteczne jako "zielone" rozpuszczalniki do zastosowań energetycznych i procesów przemysłowych.

Rysunek 1.Typowe kationy i aniony występujące w cieczach jonowych
Kolejnym użytecznym aspektem niektórych cieczy jonowych jest ich szerokie okno stabilności elektrochemicznej, które może wynosić nawet 6,0 V.1 Okno to sprawia, że te ciecze jonowe są obiecującymi kandydatami do stosowania jako elektrolity w elektrochemii. Podczas gdy materiały o dużych oknach napięciowych są pożądane, mogą one również posiadać niedopuszczalnie wysoką lepkość i niewystarczającą przewodność do stosowania jako elektrolity. Wysoka lepkość często skutkuje wyższymi potencjałami utleniania (ze względu na zmniejszone szybkości transportu masy) i dłuższymi czasami reakcji.2 Zapoznanie się z niektórymi ciekłymi elektrolitami jonowymi (ILE) przedstawionymi w Tabeli 1 szybko ujawnia te kompromisy.
Dziedziną, która odnotowała znaczące korzyści z pojawienia się ILE, są polimery elektroaktywne. Elektroaktywne polimery (EAP) mogą być generalnie przełączane między dwoma lub więcej stabilnymi stanami utlenienia, powodując zmiany właściwości, w tym przewodnictwa, koloru i objętości. Zmiany koloru prowadzą do zastosowań elektrochromowych, takich jak wyświetlacze i automatycznie przyciemniane okna, podczas gdy zmiany objętości prowadzą do zastosowań siłowników elektromechanicznych, takich jak sztuczne mięśnie i urządzenia mikroelektromechaniczne (MEM). Urządzenia wykorzystujące EAP były przedmiotem skoncentrowanych badań przez ostatnie trzy dekady. Ponieważ polimery te mogą być przełączane między ich neutralną formą, utlenioną formą domieszkowaną typu p i zredukowaną formą domieszkowaną typu n, możliwe są różne konfiguracje elektrod. Przykładem tego jest zastosowanie elektroaktywnych polimerów w kondensatorach elektrochemicznych,3 akumulatorach wielokrotnego ładowania,4 i urządzeniach elektrochromowych.5 Rysunek 2 przedstawia typowe reakcje utleniania i redukcji zachodzące z udziałem EAP.
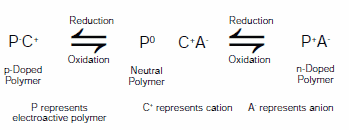
Rysunek 2.Uogólniony schemat reakcji elektroaktywnego polimeru (P) przełączającego się między stanami domieszkowanym n, neutralnym i domieszkowanym p w obecności elektrolitu (C+A-)
Jak pokazano na Rysunku 2, utlenianie, neutralizacja i redukcja EAP wymagają ruchu jonów w celu przestrzegania zasady zachowania ładunku. Wybór jonów może wpływać na morfologię, stabilność oraz potencjały utleniania i redukcji.6 Jony są wprowadzane za pomocą roztworów elektrolitów, takich jak sole tetraalkiloamoniowe rozpuszczone w wodzie, acetonitrylu lub węglanie propylenu (Prod. No. 310328). Ciecze jonowe przedstawione na rysunku 1 przyciągnęły znaczną uwagę jako alternatywne elektrolity dla systemów EAP. Mogą być stosowane w czystej postaci lub w połączeniu z innymi rozpuszczalnikami.7-9 Zalety ILE obejmują szerokie okno temperaturowe, niską lotność oraz dobrą stabilność elektrochemiczną i termiczną.10 W przypadku stosowania bez dodatkowych rozpuszczalników, ciekłe elektrolity jonowe znacznie poprawiają stabilność przełączania urządzeń opartych na EAP w stosunku do elektrolitów opartych na roztworach.11
Zastosowania cieczy jonowych w superkondensatorach i bateriach
Kondensatory elektrochemiczne (superkondensatory)
Kondensatory elektrochemiczne (EC), znane również jako superkondensatory, to urządzenia magazynujące energię elektryczną, w których utlenianie i redukcja elektroaktywnych polimerów, tlenków metali lub materiałów węglowych są wykorzystywane do przechowywania energii elektrycznej. W procesie ładowania elektrody EC są redukowane (katoda) i utleniane (anoda) w celu przechowywania energii elektrycznej, która jest następnie uwalniana podczas rozładowywania, gdy materiały elektrod powracają do swoich neutralnych stanów.Rysunek 3 ilustruje uogólnione działanie EC typu IV, które łączy w sobie zarówno polimery domieszkowane p (anoda), jak i n (katoda) w celu maksymalnego magazynowania energii.

Rysunek 3.Schemat kondensatora elektrochemicznego na bazie polimeru elektroaktywnego pokazujący przepływ elektronów i ruch jonów podczas ładowania (po lewej) i rozładowywania (po prawej). Podczas ładowania polimer na katodzie (domieszkowany n) staje się naładowany ujemnie, a kationy z elektrolitu przemieszczają się, aby skompensować ładunek. Jednocześnie polimer na anodzie (domieszkowany p) staje się naładowany dodatnio, a aniony z elektrolitu przemieszczają się, aby skompensować ładunek. Podczas rozładowania oba polimery powracają do stanu neutralnego, a jony wracają do roztworu.
Wśród najważniejszych zastosowań EC są systemy ochrony pamięci dla przenośnej elektroniki, poziomowanie obciążenia dla zakładów energetycznych i magazynowanie energii dla pojazdów elektrycznych. EC generalnie zapewniają większą moc na jednostkę masy niż baterie i przechowują więcej energii na jednostkę masy niż tradycyjne kondensatory. W związku z tym mogą być wykorzystywane do zasilania pojazdów elektrycznych. Wszystkie EC wymagają do działania elektrolitu; zastosowanie cieczy jonowych7,12 pozwala wyeliminować lotne i niebezpieczne konwencjonalne rozpuszczalniki i poprawia stabilność operacyjną tych urządzeń.
Baterie litowo-jonowe
Baterie litowo-jonowe są wszechobecne na rynku elektroniki użytkowej i mogą ostatecznie zdominować komercyjne magazynowanie energii na dużą skalę. Baterie litowe składają się z dwóch elektrod tlenkowo-węglowych z interkalacją litu, oddzielonych elektrolitem (Rysunek 4). Gdy bateria jest ładowana, jony litu przemieszczają się z elektrody tlenkowej do elektrody węglowej, magazynując energię. Gdy bateria jest rozładowywana, jony litu przemieszczają się z powrotem do tlenku, a energia jest uwalniana. Transport jonów litu jest ułatwiony przez elektrolit, który zazwyczaj zawiera lotny, łatwopalny rozpuszczalnik. Dlatego bezpieczeństwo jest głównym problemem w przypadku akumulatorów zawierających konwencjonalne elektrolity. Zwarcie lub lokalne przegrzanie w obecności łatwopalnych rozpuszczalników może spowodować niekontrolowany wzrost temperatury, pożar, a nawet wybuch. Ciecze jonowe mogą być szczególnie pomocne w bateriach litowo-jonowych, zastępując łatwopalne rozpuszczalniki i poprawiając bezpieczeństwo baterii.10

Rysunek 4.Bateria litowo-jonowa pokazująca przepływ elektronów i ruch jonów litu podczas rozładowywania (po lewej) i ładowania (po prawej).
Co więcej, w przeciwieństwie do elektrolitów kondensatorów elektrochemicznych, elektrolity baterii litowych muszą ułatwiać transport jonów litu, pozostawać stabilne przy bardzo ujemnych potencjałach i wspierać stabilną pracę baterii. Możliwe jest, aby ciecze jonowe spełniały te wymagania, a kilka grup badawczych pracuje w tym obszarze.10,13 Wśród testowanych cieczy jonowych są bis(trifluorometylosulfonyloimid) N-butylo-N-etylo-pirolidyniowy (nr prod. 38894); bis(trifluorometylosulfonyloimid) etylometyloimidazolowy (nr prod. 38894); bis(trifluorometylosulfonyloimid) etylometyloimidazolowy (nr prod. 38894); bis(trifluorometylosulfonyloimid) etylometyloimidazolowy (nr prod. 38894). No. 711691); N- metylo-N-propylo bis(trifluorometylosulfonyloimid) pirolidyniowy i N-metylo-N-propylo bis(trifluorometylosulfonyloimid) piperydyniowy. Każdy z nich może być użyty do przygotowania roztworów bis(trifluorometanosulfonyloimidku) litu (Prod. No. 544094), w których jon litu jest materiałem aktywnym.
Ciecze jonowe w ekstremalnych temperaturach
Wraz z rosnącym naciskiem na produkcję i magazynowanie energii, rośnie zapotrzebowanie na urządzenia do magazynowania ładunku, które działają w szerokim zakresie temperatur. W przemyśle motoryzacyjnym, urządzenia do magazynowania ładunku idealnie działałyby w temperaturach tak niskich jak -30 °C.14 Wymagania wojskowe dla urządzeń do magazynowania ładunku są jeszcze bardziej rygorystyczne, z temperaturami tak niskimi jak -60 °C dla niektórych zastosowań.15 Większość akumulatorów cierpi na poważne pogorszenie wydajności w niższych temperaturach, zwłaszcza do -60 °C.16 Oprócz spowolnienia kinetyki procesu ładowania/rozładowania, niższe temperatury zwiększają również lepkość elektrolitów, zmniejszając zdolność elektrolitu do transportu ładunku. Takie zmiany właściwości prowadzą do pogorszenia wydajności urządzenia lub jego awarii po dłuższym wystawieniu na działanie niskich temperatur. Jednym z najpoważniejszych skutków niskich temperatur dla elektrolitów na bazie roztworu jest zmniejszona rozpuszczalność materiału elektrolitu, co prowadzi do wytrącania się soli i zniszczenia kondensatora lub baterii elektrochemicznej. Jak wynika z Tabeli 1, wiele ciekłych elektrolitów jonowych działa w umiarkowanie niskich temperaturach wymaganych przez przemysł motoryzacyjny, ale bardzo niewiele z nich będzie działać w ekstremalnie niskich temperaturach wymaganych do zastosowań wojskowych.17 Dodatkowym wyzwaniem jest fakt, że elektrolity te powinny wspierać procesy elektrochemiczne (osadzanie, utlenianie, redukcję, działanie urządzenia,15 itp.) w różnych układach monomer/polimer w tym samym szerokim przedziale temperatur. Niestety, istnieje tylko kilka cieczy jonowych, które pozostają ciekłe w ekstremalnie niskich temperaturach, a ich lepkość może stać się zbyt wysoka dla większości zastosowań elektrochemicznych. Mieszaniny różnych cieczy jonowych lub zastosowanie dodatków zmniejszających lepkość mogłoby pomóc złagodzić ten problem. Wydajność urządzeń elektrochemicznych w podwyższonych temperaturach do 60 °C jest również przedmiotem zainteresowania w branży magazynowania energii.14 Niestety, większość elektrolitów na bazie rozpuszczalników cierpi z powodu wysokiej lotności rozpuszczalników w podwyższonych temperaturach. Odparowanie rozpuszczalnika może doprowadzić do pożaru i eksplozji w szczelnie zamkniętych systemach; podczas gdy w systemach otwartych może to spowodować wytrącenie elektrolitu, zniszczenie materiałów magazynujących ładunek i utratę zdolności magazynowania ładunku. Tak więc niezwykle niska lotność cieczy jonowych sprawia, że są one doskonałymi elektrolitami do stosowania w podwyższonych temperaturach.
Inne zastosowania
Istnieje wiele innych zastosowań, w których ciecze jonowe wykazują potencjał. Szerokie okna elektrochemiczne i niskie prężności par sprawiają, że są one korzystne dla galwanizacji metali i półprzewodników.18 Ciecze jonowe są również obiecującą technologią wspomagającą dla wysokotemperaturowych ogniw paliwowych.19 W temperaturach przekraczających 100 °C, gdy woda jako rozpuszczalnik nie jest opcją, ciecze jonowe stanowią doskonałą alternatywę dla konwencjonalnych wodnych systemów transferu protonów. Siłowniki elektromechaniczne wykorzystujące polimery elektroaktywne lub jonowymienne wymagają elektrolitu, aby ułatwić uruchamianie; wykazano, że ciecze jonowe zwiększają długoterminową stabilność tych urządzeń.20 Być może najbardziej widoczną ilustracją poprawy stabilności przy użyciu cieczy jonowych są urządzenia elektrochromowe, w których nie zaobserwowano znaczącej utraty elektroaktywności po 1 000 000 cykli, gdy tetrafluoroboran 1-butylo-3-metyloimidazoliowy (Prod. No. 711748) został użyty jako elektrolit w wyświetlaczu elektrochromowym na bazie polianiliny.10
Wymagania dotyczące czystości
Czystość elektrolitów używanych w zastosowaniach związanych z magazynowaniem energii ma kluczowe znaczenie dla stabilności i wydajności urządzeń elektrochemicznych. Ciecze jonowe nie są tu wyjątkiem. W zależności od metod syntezy stosowanych do przygotowania cieczy jonowych, zanieczyszczenia w tych materiałach mogą obejmować wodę, zbędne kationy lub aniony lub inne rozpuszczalniki. Nawet śladowe ilości zanieczyszczeń mogą powodować niepożądane reakcje uboczne i utrudniać działanie urządzeń opartych na EAP. W ten sposób wykazano, że zanieczyszczenia chlorkowe i wodne wpływają na lepkość cieczy jonowych.21, 22 Niewielkie ilości (kilka ppm) sorbentów, takich jak tlenek glinu i krzemionka, mogą również powodować ich zmniejszoną wydajność elektrochemiczną.23 Metody oczyszczania, które wytwarzają ciecze jonowe odpowiednie do stosowania w elektrochemii, często obejmują chromatografię kolumnową lub destylację próżniową (w celu usunięcia lotnych zanieczyszczeń; same ciecze jonowe nie destylują). Zostały one opublikowane dla wielu popularnych materiałów i powinny być pilnie przestrzegane.21-23
Podsumowanie i wnioski
Bardzo niska lotność i dobra stabilność elektrochemiczna wielu cieczy jonowych sprawiają, że są one doskonałym wyborem do stosowania jako elektrolity w urządzeniach magazynujących energię. W przypadku zastosowań elektrochemicznych zalecane jest rygorystyczne oczyszczanie. W urządzeniach wykorzystujących ciekłe elektrolity jonowe obserwuje się doskonałą stabilność elektrochemiczną. Zdolność do pracy w ekstremalnych temperaturach jest unikalną cechą ciekłych elektrolitów jonowych, co czyni je obiecującymi kandydatami do wykorzystania w pojazdach elektrycznych i wielu innych zastosowaniach.
Podziękowania
J. Stenger-Smith dziękuje Office of Naval Research (w szczególności dr M. Andersonowi, P. Armisteadowi i R. Carlinowi) oraz biuru Power Sources Strategic Technology Initiative za wsparcie. J. Irvin dziękuje Office of Naval Research, ACS Petroleum Research Fund i Welch Foundation za wsparcie. Autorzy dziękują panu Andrew P. Chafinowi, dr Davidowi J. Irvinowi, dr Andrew Guenthnerowi i dr Mariem Rosario-Canales za pomocne dyskusje.
Przedstawione poglądy są poglądami autorów i niekoniecznie reprezentują poglądy DoD lub jego komponentów.
Przedstawione poglądy są poglądami autorów i niekoniecznie reprezentują poglądy DoD lub jego komponentów.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?