Ligand PYBOX - duże miejsce wiązania i sztywne rusztowanie
William Sommer, Daniel Weibel
Chemfiles Volume 8 Article 2
Ligand PYBOX,1 składający się z pierścienia pirydynowego otoczonego dwiema grupami oksazolinowymi, został wprowadzony w 1989 roku przez Nishiyamę.2 PYBOX wyewoluował bezpośrednio z ligandów BOX. Porównując je, należy wspomnieć o dwóch kwestiach: (1) miejsce wiązania PYBOX jest wystarczająco duże, aby kompleksować nawet kationy lantanowców i (2) sztywność trójzębnego rusztowania PYBOX jest zwiększona.
W swoim pierwszym zastosowaniu Nishiyama wykazał, że katalizator izopropylo-PYBOX 407151 rod(III) skutecznie promuje asymetryczną hydrosililację ketonów dając niezwykle wysoką enancjoselektywność (Schemat 1).3
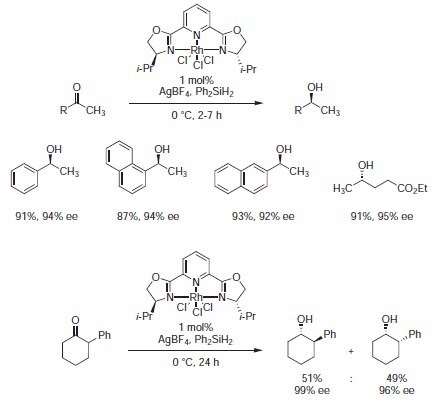
Schemat 1.Katalizator skutecznie promuje asymetryczną hydrosililację ketonów, zapewniając niezwykle wysoką enancjoselektywność.
Li i Wei opisali w 2002 roku enancjoselektywną bezpośrednią addycję terminalnych alkinów do imin katalizowaną miedzią(I). Najbardziej udanym testowanym ligandem był PYBOX 496073 zawierający grupy fenylowe (Schemat 2).4
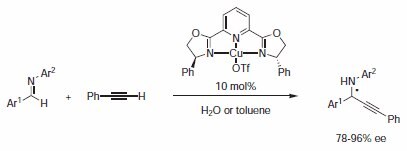
Schemat 2.Katalizowana enancjoselektywna bezpośrednia addycja terminalnych alkinów do imin
Ostatnio, grupa Shibasaki doniosła o bezpośrednich asymetrycznych reakcjach typu Mannicha katalizowanych tlenkiem arylowym lantanu/PYBOX z użyciem ketonu trichlorometylowego jako równoważnika donora propionianu.5 Układ La(OAr)3-i-Pr-PYBOX 407151 + LiOAr dawał produkty z wydajnością od 72 do 99%, 8:1 do >30:1 i 92-98% ee (Tabela 1).
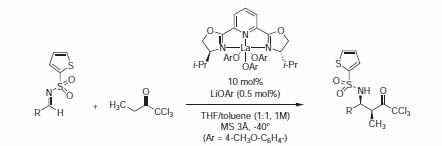
Rysunek 1.Równoważny dawca propionianu
Chiralny kompleks ind(III)-PYBOX przygotowany z triflatu indu i C2-symetrycznego chiralnego PYBOX 673986 został uznany za skuteczny chiralny ligand w enancjoselektywnej reakcji allilowania aldehydów z allilotributylostannanem, dając wysoką enancjoselektywność.6 Stosując tę metodologię, chiralny aldehyd steroidowy mógł być allilowany z doskonałą enancjoselektywnością ((22S):(22R)= >99:1) i z dobrą wydajnością (78%). Co więcej, reakcja była wysoce chemoselektywna, reagując tylko z funkcjonalnością aldehydową. Nie zaobserwowano reakcji z funkcjonalnością enonu w pierścieniu A (Schemat 3).
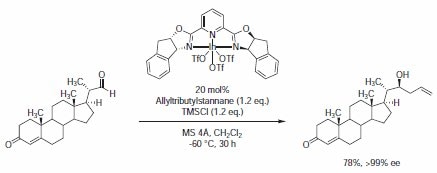
Schemat 3.Chiralny ind(III)-PYBOX
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?