BINOL i pochodne
William Sommer, Daniel Weibel
BINOL i jego pochodne są jedną z najczęściej stosowanych klas ligandów w syntezie asymetrycznej; są wykorzystywane w szerokim zakresie reakcji, w tym: Dielsa-Aldera, addycji i redukcji karbonylu, addycji Michaela, a także wielu innych. Podczas gdy platforma BINOL odniosła ogromny sukces, inne C2-symetryczne ligandy diolowe przyciągnęły znaczną uwagę. Wśród nich są sklepione ligandy biarylowe opracowane przez Wulffa i współpracowników. Zarówno sklepiony 3,3'-bifenantrol (VAPOL), jak i sklepiony 2,2'-binaftol (VANOL) okazały się doskonałymi ligandami w katalitycznych asymetrycznych reakcjach Dielsa-Aldera, aldolu iminy i azyrydynacji (Rysunek 1)1.Ostatnio wykazano, że pochodna kwasu fosforowego VAPOL jest skuteczna jako chiralny katalizator kwasu Brønsteda. W wielu przykładach zilustrowanych w niniejszym dokumencie, sklepione biaryle dają zarówno wyższe wydajności, jak i wyższe indukcje niż te same reakcje z użyciem ligandu BINOL.
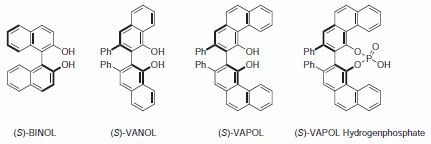
Rysunek 1.
Asymetryczna reakcja Dielsa-Aldera
Bardzo wcześnie wykazano, że katalizator wytworzony z Et2AlCl i VAPOL jest skutecznym katalizatorem asymetrycznej reakcji Dielsa-Aldera2.Jak pokazano w Schemacie 1, cykloaddycja akroleiny z cyklopentadienem w obecności katalizatora pochodzącego z VAPOL dała wysokie konwersje i doskonałą stereoselektywność dla izomeru egzo w bardzo wysokiej czystości optycznej. Analogiczne reakcje z katalizatorem BINOL dostarczyły cykloadduktu z wysoką wydajnością, ale w bardzo niskim nadmiarze enancjomerycznym (13-41%).
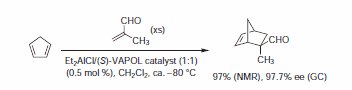
Schemat 1.
Reakcja asymetrycznego azyrydynowania
Azyrydyny są ważnymi blokami budulcowymi w syntezie organicznej, ponieważ pozwalają na wygodny dostęp do amin, aminoalkoholi, diamin i innych użytecznych cząsteczek zawierających azot. Większość współczesnych metod otrzymywania chiralnych azyrydyn opiera się na puli chiralnej. Niedawno grupa Wulffa opracowała solidną katalityczną reakcję asymetrycznego azyrydynowania zapewniającą optycznie czynne azyrydyny z wysoką wydajnością i selektywnością. Reakcja opiera się na addycji komercyjnie dostępnego diazooctanu etylu (EDA) do imin benzhydrylowych w obecności katalizatorów aryloboranowych przygotowanych ze sklepionych ligandów arylowych i B(OPh)3.3 Reakcja azyrydynacji wykazuje doskonałą selektywność dla izomeru cis i uzyskuje się wysokie nadmiary enancjomeryczne. Powstałe azirydyny zabezpieczone benzyhydrylem poddawane są różnym reakcjom, w tym: deprotekcji, redukcyjnemu otwarciu pierścienia lub reakcjom alkilowania (Schemat 2, Tabela 1). W asymetrycznej syntezie antagonisty leukointegryny LFA-1 BIRT-377 wykorzystano metodologię azyrydynacji/alkilacji w celu uzyskania docelowej hydantoiny z doskonałą ogólną wydajnością.
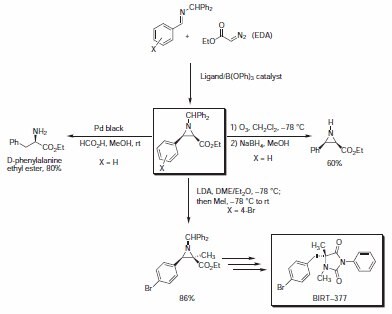
Schemat 2.
Bardzo szybka synteza środka przeciwbakteryjnego (-)-chloramfenikolu wykorzystała asymetryczną reakcję azyrydyniowania, po której nastąpiło nukleofilowe otwarcie pierścienia azyrydyny kwasem dichlorooctowym z następującą po nim migracją grupy acylowej (Schemat 3, Tabela 2). Zarówno VANOL jak i VAPOL dawały wyższe wydajności i stereoselektywności niż katalizator pochodzący z BINOLu.
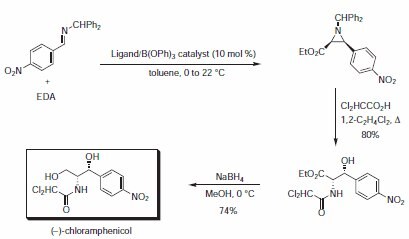
Schemat 3.
Asymetryczna reakcja aldolowa
Asymetryczne reakcje aldolowe imin są również katalizowane przez sklepione katalizatory pochodzenia biarylowego./h2>
Asymetryczne reakcje aldolowe imin są również katalizowane przez sklepione katalizatory pochodzenia biarylowego, zapewniając ważną metodę syntezy chiralnych estrów β-aminowych. Addycja acetali sililoketenowych do imin arylowych w obecności katalizatorów Zr-VANOL lub Zr-VAPOL przebiega z wysoką indukcją asymetryczną i z doskonałą wydajnością (Schemat 4, Tabela 3). Co istotne, oba katalizatory wykazują znacznie wyższe poziomy indukcji niż analogiczny katalizator BINOL4.

Schemat 4.
Chiralny kwas Brønsteda
Antilla i współpracownicy wykazali, że wodorofosforan VAPOL jest użytecznym chiralnym katalizatorem kwasu Brønsteda w addycji sulfonamidów do arylowych imin aktywowanych Boc (Schemat 5)5.Otrzymane produkty N,N-aminowe zostały przygotowane z wysokimi wydajnościami z imponującą enancjopurystycznością. Identyczna reakcja z katalizatorem kwasu Brønsteda pochodzącym z BINOL dała doskonałą wydajność (95%), ale uzyskano ponury poziom indukcji asymetrycznej (<5% ee). Różnorodne sulfonamidy i iminy arylowe są aktywne w reakcji amidowania imin, a powstałe chronione aminy są związkami trwałymi.
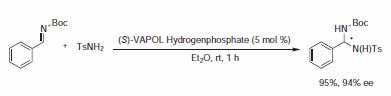
Schemat 5.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?