Protokoły ładowania żywicy peptydowej
Przegląd sekcji
- Żywice Merrifielda (Metoda 1)
- Żywice funkcjonalizowane hydroksymetylem (metody 2-3)
- Loading Amino-Functionalized Resins (Method 4)
- Żywice na bazie trytylu (metody 5-6)
- ŻywiceDBZ (Metoda 7)
- Żywice sulfamylowe (Metoda 8)
- Żywice DHP (Metoda 9)
- Żywice aldehydów peptydowych (Metoda 10)
- Test obciążenia Fmoc (Metoda 11)
- Referencje

Metoda 1: Przyłączanie Boc-aminokwasów do żywic Merrifield
- Rozpuścić Boc-aminokwas w EtOH (2 mL/mmol) i dodać wodę (0,5 mL/mmol). Dostosować pH do 7 za pomocą 2 M aq. Cs2CO3. Odparować roztwór do sucha. Dodać dioksan i odparować do sucha. Powtórzyć odparowanie z dioksanem.
- Pre-swell Merrifield resin in DCM for 1 h and then wash with DMF. Dodać sól Cs (1,2 eq.) w DMF do żywicy i ogrzewać w temperaturze 50 °C. Reakcja może być katalizowana przez dodanie KI (0,1 eq.). Pod koniec tego czasu przemyć żywicę 3X DMF, 3X DMF/wodą (1:1), 3X DMF, 3X DCM, 3x MeOH. Wysuszyć w próżni nad KOH.
Hydroksymetylo-funkcjonalizowane żywice
.Jedną z najprostszych metod estryfikacji do hydroksymetylowo funkcjonalizowanych łączników (żywice Wang, HMPA i HMBA) jest użycie symetrycznego bezwodnika chronionego aminokwasu w obecności katalitycznej ilości p-dimetyloaminopirydyny (DMAP) (Metoda 2).2 Jednakże, ze względu na zasadowy charakter tego materiału, można spodziewać się enancjomeryzacji i tworzenia dipeptydów; ilość zależy od ilości użytego DMAP, długości reakcji i charakteru aminokwasu.

Metoda MSNT3,4 (Metoda 3) jest metodą z wyboru w trudnych okolicznościach, takich jak ładowanie żywic HMBA lub podczas przyłączania pochodnych aminokwasów podatnych na enancjomeryzację.5,6
Cysteina i histydyna są szczególnie podatne na enancjomeryzację i nie powinny być ładowane tą metodą. W przypadku tych reszt zaleca się stosowanie żywicy 2-ClTrt; estryfikacja reszty C-końcowej jest wolna od enancjomeryzacji i tworzenia dipeptydów7 ponieważ przyłączenie nie obejmuje aktywacji przychodzącego chronionego aminokwasu (Metoda 5). Gdy pożądane są kwasy peptydowe zawierające Pro jako resztę C-końcową, zaleca się stosowanie żywic na bazie tritylu.
Po załadowaniu żywicy podstawienie żywicy można łatwo określić za pomocą Metody 11.
Metoda 2: Przyłączanie do żywic hydroksymetylowych za pomocą bezwodnika symetrycznego
- Umieść żywicę (1 g) w czystej, suchej kolbie i dodaj wystarczającą ilość DMF, aby tylko przykryć i pozostawić do spęcznienia na 30 min. W razie potrzeby dodać więcej DMF, aby przykryć żywicę.
- Rozpuścić aminokwas Fmoc (10 eq. w stosunku do obciążenia żywicy) w suchym DCM. Jedna lub dwie krople DMF mogą być potrzebne do całkowitego rozpuszczenia.
- Dodaj roztwór diizopropylokarbodiimidu (5 eq. w stosunku do obciążenia żywicą) w suchym DCM do roztworu aminokwasu.
- Mieszaj mieszaninę przez 20 minut w temperaturze 0°C, utrzymując mieszaninę reakcyjną wolną od wilgoci za pomocą rurki suszącej z chlorkiem wapnia.
- Usuń DCM przez odparowanie pod zmniejszonym ciśnieniem za pomocą wyparki obrotowej.
- Rozpuść pozostałość w minimalnej ilości DMF i dodaj roztwór do żywicy przygotowanej w kroku 1.
- Rozpuść DMAP (0,1 eq. w stosunku do obciążenia żywicy) w DMF i dodaj ten roztwór do mieszaniny żywicy i aminokwasów. Zamknąć kolbę i pozostawić mieszaninę w temperaturze rt przez 1 godzinę, od czasu do czasu mieszając.
- Wyjmij małą próbkę żywicy (20 mg) i przemyj, wysusz i oszacuj poziom przyłączenia pierwszej pozostałości, stosując procedurę opisaną w Metodzie 11. Jeśli uzyskana wartość jest mniejsza niż 70%, należy powtórzyć procedurę przyłączania pierwszej pozostałości.
Uwaga: Ta metoda nie jest odpowiednia dla His lub Cys.
Metoda 3: Przyłączanie do żywic hydroksymetylowych przy użyciu MSNT/MeIm
- Umieść żywicę w suchym naczyniu reakcyjnym. Spęcznić i przemyć DCM, dodać DCM w ilości wystarczającej do pokrycia żywicy i przepłukać naczynie azotem.
- Odważyć odpowiedni aminokwas Fmoc (5 eq.) do suchej kolby okrągłodennej. Dodaj suchy DCM w celu rozpuszczenia pochodnej aminokwasu (około 3 mL/mmol); można dodać jedną lub dwie krople THF w celu ułatwienia rozpuszczania.
- Dodaj MeIm (3,75 eq.), a następnie MSNT (5eq.). Przepłukać kolbę azotem i uszczelnić. Mieszać mieszaninę aż do rozpuszczenia MSNT.
- Używając strzykawki, przenieść roztwór aminokwasu do naczynia zawierającego żywicę.
- Pozwolić mieszaninie stać w temperaturze rt przez 1 godzinę, delikatnie mieszając.
- Przemyć DCM (5 razy) i DMF (5 razy).
- Wyjmij małą próbkę żywicy (20 mg) i przemyj, wysusz i oszacuj poziom pierwszego przyłączenia pozostałości, stosując procedurę opisaną w Metodzie 11. Jeśli uzyskana wartość jest mniejsza niż 70%, należy powtórzyć procedurę przyłączania pierwszej pozostałości.
Wczytywanie żywic funkcjonalizowanych aminami
.Przyłączanie pochodnych aminokwasów i innych kwasów karboksylowych do łączników zawierających pierwszorzędowe grupy aminowe można zwykle przeprowadzić przy użyciu standardowych metod tworzenia wiązań amidowych (patrz Metoda 4). Hydroksyloamina, amid Weinreba i żywice funkcjonalizowane aminami drugorzędowymi są znacznie trudniejsze do załadowania; w ich przypadku wymagane jest użycie aktywacji HOAt/DIPCDI lub HATU/DIPEA.
Metoda 4: Przyłączanie kwasów karboksylowych do żywic aminowych
- Wstępnie zalać żywicę DCM (żywice na bazie polistyrenu) lub DMF (żywice PEG-PS lub PEGA) na 1 h. Dokładnie przemyć żywicę DMF.
- Jeśli żywica jest zabezpieczona Fmoc, traktować 20% piperydyną w DMF przez 20 min, a następnie dokładnie przemyć żywicę DMF.
a) Rink Amide, Sieber Amide, MBHA
- Rozpuścić pochodną aminokwasu lub kwas karboksylowy (5 eq.) i HOBt w DMF. Dodać DIPCDI (5 eq.) i odstawić na 10 min. Dodać mieszaninę do żywicy. Pozostawić na 1-6 h.
b) Żywice N-alkiloaminowe
- Rozpuścić pochodną aminokwasu lub kwasu karboksylowego (5 eq.) i HATU w DMF. Dodać DIPEA (10 eq.) i natychmiast dodać do żywicy. Pozostawić na 6 h.
Usunąć niewielką ilość żywicy i zbadać ją na obecność nieprzereagowanych amin za pomocą testu TNBS (pierwszorzędowe żywice aminowe) lub testu chloranilowego (drugorzędowe żywice aminowe). Jeśli wynik jest pozytywny, przemyć żywicę DMF i powtórzyć sprzęganie. Kontynuować tę procedurę aż do uzyskania wyniku negatywnego.
Żywice na bazie tritylu
W przeciwieństwie do nośników na bazie alkoholu benzylowego, przyłączenie Fmoc-aminokwasów do żywic na bazie tritylu, takich jak 2-chlorotrytyl lub NovaSyn® żywice TGT, są wolne od enancjomeryzacji,7 co czyni je idealnymi do immobilizacji wrażliwych reszt, takich jak Cys i His (Metoda 5). Żywica chroni również Cys przed enancjomeryzacją podczas wydłużania łańcucha. Są one szczególnie przydatne w syntezie C-końcowych peptydów prolylowych, ponieważ większość łącznika tritylowego pomaga zapobiegać tworzeniu się diketopiperazyny8-10. Podczas ładowania żywicy chlorku 2-chlorotrytylu, ważne jest, aby upewnić się, że wszystkie pochodne aminokwasów, szkło i rozpuszczalnik są dokładnie wysuszone przed użyciem.
Żywice alkoholowe NovaSyn® TGT muszą zostać przekształcone w formę chlorkową przed przyłączeniem aminokwasu (Metoda 6).

Metoda 5: Ładowanie żywic tritylowych
UWAGA: ważne jest, aby wysuszyć wszystkie rozpuszczalniki i szkło przed użyciem.
Przyłączanie kwasów karboksylowych
- Rozpuścić kwas karboksylowy (0,6-1,2 eq. w stosunku do żywicy dla żywicy 2-chlorotritylowej i 2 eq. dla żywicy chlorkowej NovaSyn® TGT) i DIPEA (4 eq. w stosunku do kwasu karboksylowego) w suchym DCM (ok. 10 ml na gram żywicy) zawierającym, jeśli to konieczne, niewielką ilość suchego DMF (wystarczającą do ułatwienia rozpuszczenia kwasu). Dla dipeptydów pseudoprolinowych dodać 3 ml NMP/gram żywicy.
- Dodać do żywicy i mieszać przez 30-120 min. W przypadku dipeptydów pseudoprolinowych pozostawić do przereagowania. Pod koniec tego czasu przemyć żywicę 3X DCM/MeOH/DIPEA (17:2:1), 3X DCM; 2X DMF, 2X DCM. Wysuszyć w próżni nad KOH. Fmoc-aminokwasy najlepiej wysuszyć przed użyciem przez wielokrotne odparowanie z dioksanu; określić obciążenie stosując Metodę 11.
Metoda 6: Chlorowanie żywicy alkoholowej NovaSyn® TGT
UWAGA: ważne jest, aby wysuszyć wszystkie rozpuszczalniki i szklane naczynia przed użyciem.
- Umieść żywicę alkoholową NovaSyn® TGT w lejku ze szkła spiekanego i przemyj żywicę kolejno DMF (2X), suchym DCM (3X) i suchym toluenem (3X).
- Odsączyć nadmiar toluenu z żywicy i przenieść wilgotny materiał do kolby okrągłodennej wyposażonej w chłodnicę zwrotną.
- Dodać toluenu w ilości wystarczającej do pokrycia żywicy, a następnie dodać świeżo destylowany AcCl (1 ml/g żywicy). Ogrzewać w temperaturze 60-70°C przez 3 h.
- Przenieść mieszaninę do lejka ze szkła spiekanego. Przemyć żywicę suchym toluenem (3X) i suchym DCM (3x).
- Odsączyć nadmiar rozpuszczalnika z żywicy i użyć natychmiast.
Żywice Dbz
Sukces w stosowaniu strategii Dbz11 zależy od regioselektywnej acylacji tylko jednej z dwóch amin łącznikowych z C końcową resztą aminokwasową i uniknięcia acylacji niezabezpieczonej aminy podczas wydłużania łańcucha. Niekompletna acylacja prowadzi do powstawania peptydów skróconych do C końca, ponieważ nowe łańcuchy są propagowane przez acylację nieprzereagowanych amin podczas kolejnych cykli sprzęgania. Natomiast nadmierna acylacja prowadzi do powstawania rozgałęzionych peptydów z łańcuchami wyrastającymi z obu amin łączących. Dlatego wybór metody acylacji przyłączenia reszty C końcowej i kolejnych sprzężeń jest krytyczny dla uzyskania dobrych wyników (Metoda 7).
Metoda 7: Ładowanie żywic Dbz
- Pre-swell the resin (0.1 mmol) in DCM for 60 min and wash with DMF. Usunąć grupę Fmoc za pomocą 20% piperydyny w DMF i przemyć DMF.
- Ile, Val, Thr, Pro, Arg: Dodać Fmoc-Aaa-OH (0,6 mmol), HATU (0,6 mmol) i DIPEA (0,9 mmol). Delikatnie mieszać przez 1 h. Przemyć żywicę DMF i powtórzyć sprzęganie.
- Gly: Dodać Fmoc-Gly-OPfp (0,6 mmol) i HOBt (0,6 mmol). Delikatnie mieszać przez 1 h
- Inne aminokwasy: Dodać Fmoc-Aaa-OH (0,6 mmol), HCTU (0,6 mmol) i DIPEA (0,9 mmol). Delikatnie mieszać przez 1 godzinę. - Sprawdzić obciążenie stosując Metodę 11. Alternatywnie, przemyć próbkę żywicy DCM i traktować 95% TFA aq. przez 30 min. Analiza rozszczepionego produktu metodą HPLC.
Szczególnie problematyczne jest sprzęganie reszt glicyny, zwłaszcza jeśli występują one blisko końca C peptydu. Ten reaktywny i nieskrępowany aminokwas może łączyć się z wolną grupą Dbz-aminową, jeśli stosowana jest aktywacja uronowa lub fosfonowa. W naszych rękach najlepsze wyniki uzyskuje się, gdy reszty glicyny są wprowadzane przy użyciu Fmoc-Gly-OPfp/HOBt. Ten środek ostrożności może być niepotrzebny, gdy peptyd zostanie wydłużony powyżej 10 reszt, ponieważ przeszkoda powinna zmniejszyć reaktywność niezabezpieczonej aminy Dbz. Ponadto należy unikać stosowania silnych aktywatorów, takich jak HATU lub HCTU, ponieważ ich użycie może prowadzić do rozgałęzienia. W naszych rękach HBTU/HOBt wydaje się działać dobrze do łączenia wszystkich reszt z wyjątkiem Gly, gdzie użycie wstępnie uformowanego OPfp w połączeniu z HOBt daje minimalne rozgałęzienia.
Użycie ochrony Alloc do blokowania drugiej grupy aminowej zostało zalecane w celu uniknięcia wszelkich problemów z rozgałęzianiem i obcinaniem12. Dostarczane żywice Dbz zawierają głównie 3-Fmoc-Dbz, z niewielkimi ilościami 4-Fmoc-Dbz i bis-Fmoc-Dbz. Przykrycie żywicy Alloc-Cl przed usunięciem grupy Fmoc zmniejszy zatem maksymalny potencjał rozgałęzienia lub obcięcia do 6%. W przypadku utrudnionych aminokwasów stwierdzono, że konieczne jest załadowanie żywicy przed zamknięciem za pomocą Alloc. Grupa Alloc musi zostać odcięta za pomocą Pd(0) przed konwersją do formy Nbz (Rysunek 1).
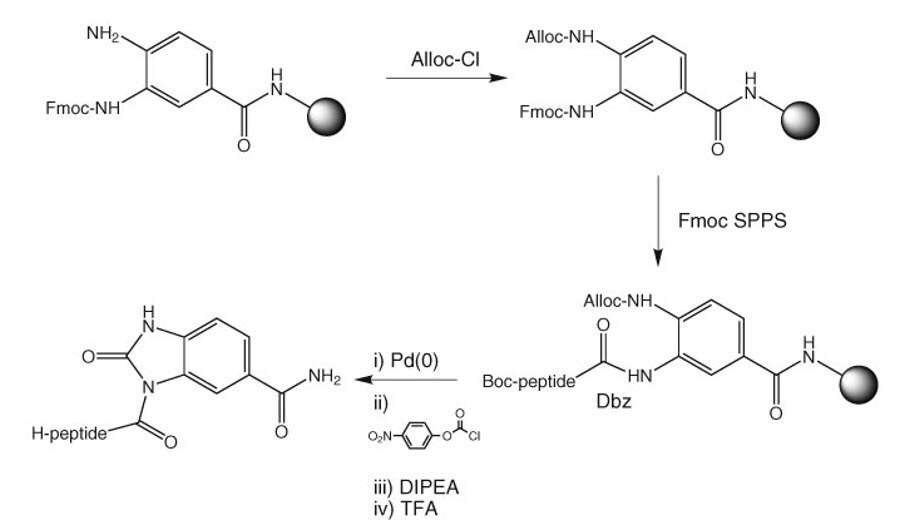
Rysunek 1: Ochrona przydziału w celu uniknięcia rozgałęzień w żywicy Dbz
Żywice sulfamylowe
Ładowanie żywic na bazie sulfamylu najlepiej osiągnąć za pomocą kwasów karboksylowych aktywowanych za pomocą PyBOP® i DIPEA w CHCl3 w temperaturze -20 °C13 lub za pomocą DIPCDI/N- metyloimidazolu (metoda 8). W przypadku aktywacji PyBOP® wydajność ładowania waha się od 95% dla Cys, Met i His do 44% dla Pro, najgorszy przypadek. Zakres racemizacji dla ładowania Fmoc-Phe i Fmoc-Leu tymi metodami wynosi odpowiednio 0,5% i 0,3%. Jednak w praktyce obciążenie uzyskane tymi metodami może być bardzo zmienne i mogą wystąpić problemy z nadmierną acylacją łącznika. Co więcej, podstawienie nośnika musi być określone przed rozpoczęciem syntezy peptydu.

Metoda 8: Ładowanie żywic sulfamylowych
Metoda DIPCDI
- Pre-swell żywicy (1 mmol) w DCM przez 1 h przed użyciem.
- Rozpuścić pochodną aminokwasu lub kwas karboksylowy (4 mmol) i 1-MeIm (4 mmol) w DCM/DMF (4:1). Dodać DIPCDI (4 mmol), wymieszać i dodać do żywicy. Pozostawić do odstania z delikatnym mieszaniem przez 18 h. Przemyć żywicę DMF, DCM, MeOH i wysuszyć.
PyBOP® metoda
- Pre-swell żywicy (1 mmol) w CHCl3 przez 1 h przed użyciem.
- Rozpuścić pochodną aminokwasu lub kwas karboksylowy (4 mmol) i DIPEA (8 mmol) w CHCl3. Dodać do żywicy.
- Ochłodzić mieszaninę do -20 °C. Dodać PyBOP® (4 mmol) i pozostawić na 8 godzin w temperaturze -20°C. Przemyć żywicę DCM, DMF, DCM, MeOH i wysuszyć.
Żywice DHP
Żywica DHP HM składa się z 3,4-dihydro-2H-pirano-2-ylo-metanolu14 przyłączonego do 100-200 mesh chlorometylopolistyrenu i jest użytecznym narzędziem do syntezy alkoholi peptydowych.
W przeciwieństwie do nośników opartych na tritylu, gdzie często wymagane jest stosowanie wydłużonych czasów reakcji i podwyższonych temperatur w celu osiągnięcia zadowalających ładunków, derywatyzacja żywicy DHP HM jest stosunkowo prosta, a nawet alkohole drugorzędowe są ładowane bez trudności. Zazwyczaj proces ten obejmuje obróbkę żywicy w DCE z nadmiarem alkoholu w obecności pirydinium p-toluenosulfonianu (PPTS); pełne szczegóły eksperymentalne podano w Metodzie 9.
Metoda 9: Ładowanie żywicy DHP HM
- Pre-swell DHP HM resin in dry DCE for 1 h.
- Rozpuścić alkohol Fmoc-amino (3 eq.) w suchym DCE zawierającym PPTS (1,5 eq) i dodać ten roztwór do żywicy.
- Pozostawić do przereagowania w temperaturze 80 °C z delikatnym mieszaniem pod azotem.
- Zgasić reakcję dodając pirydynę (~ 5 ml/g). Wyizolować żywicę przez filtrację i przemyć DMF, DCM i heksanem. Wysuszyć żywicę w próżni.
Przygotowanie aldehydów peptydowych przy użyciu żywicy H-Thr-Gly-NovaSyn® TG
.Jedna z najprostszych i najbardziej efektywnych metod otrzymywania aldehydów peptydowych, polegająca na immobilizacji aldehydu aminowego w fazie stałej poprzez utworzenie oksazolidyny pomiędzy wstępnie uformowanym aldehydem Fmoc-aminowym a żywicą H-Thr-Gly-NovaSyn® TG15.

Po załadowaniu żywicy, azot oksazolidyny powinien być zablokowany przez traktowanie bezwodnikiem Boc. Powstała acyloksyazolidyna jest stabilna w stosunku do zasady i jest kompatybilna z protokołami Fmoc.
Dla peptydów zawierających resztę aspartalową, argininową, leucynową, fenyloalaninową lub walinową, dostępne są wstępnie załadowane żywice.
Metoda 10: Ładowanie żywicy H-Thr-Gly-NovaSyn® TG
- Zawiesić żywicę H-Thr-Gly-NovaSyn® TG w 1% AcOH w MeOH/DCM (1:1) zawierającej aldehyd Fmoc-aminowy (5 eq. w stosunku do podstawienia żywicy) w DCM.
- Delikatnie mieszać mieszaninę w temperaturze rt przez 4 h i monitorować testem TNBS.
- Usuń żywicę przez filtrację, przemyj DCM, DMF i THF.
- Poddać żywicę działaniu Boc2O (5 eq.) i NMM (5eq.) w THF w 50°C przez 3 h w celu przyłączenia azotu oksazolidynowego.
- Usuń żywicę przez filtrację i przemyj THF, DCM i DMF
Test obciążenia fmoc
.W celu oszacowania obciążenia żywic derywatyzowanych aminokwasami Fmoc, najprostsze podejście obejmuje rozszczepienie grupy Fmoc za pomocą DBU i pomiar stężenia uwolnionego dibenzofluwenu w roztworze za pomocą spektroskopii U. V.V.16
Metoda 11: Oszacowanie poziomu przyłączenia pierwszej pozostałości
- Pobierz 3 x 10 mm dopasowane krzemionkowe kuwety UV.
- Odważyć suchą żywicę aminokwasową Fmoc (ok. 5 µmol w odniesieniu do Fmoc) do kolby miarowej o pojemności 10 ml.
- Dodać 2 ml 2% DBU w DMF. Delikatnie mieszać przez 30 min. Rozcieńczyć roztwór do 10 ml za pomocą MeCN. Pobrać 2 ml tego roztworu i rozcieńczyć do 25 ml w kolbie miarowej
- Przygotować roztwór referencyjny jak w kroku 2, ale bez dodawania żywicy.
- Napełnić dwie kuwety 3 ml roztworu testowego i jedną kuwetę 3 ml roztworu referencyjnego. UWAGA: Nie zanieczyszczać krzyżowo roztworów. Pozwól żywicy osiąść na dnie kuwet.
- Umieść kuwety w spektrofotometrze i zapisz gęstość optyczną przy 304 nm.
- Oszacuj przyłączenie pierwszej pozostałości z poniższego równania Obciążenie Fmoc: mmol/g =(Abspróbka-Absref) X 16,4/mg żywicy).
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?