Rozwiązanie problemu tworzenia aspartymidu w Fmoc SPPS za pomocą Fmoc-Asp(OBno)-OH
Tworzenie aspartymidów1,2 jest spowodowane powtarzającą się ekspozycją sekwencji zawierających kwas asparaginowy na zasady takie jak piperydyna i może ostatecznie skutkować wytworzeniem 9 różnych produktów ubocznych (Rysunek 1)3-8. Podczas gdy w wielu przypadkach aspartymidy oraz α- i β-piperydyny powstałe w wyniku tej reakcji ubocznej można łatwo oddzielić od peptydu docelowego za pomocą HPLC, peptydy β-asparaginowe i epimeryzowany peptyd α-asparaginowy są prawie niemożliwe do usunięcia, ponieważ często mają one ten sam czas retencji co peptyd docelowy. Ponadto, ponieważ mają one taką samą masę jak cel, obecność tych produktów ubocznych jest trudna do wykrycia. Tworzenie się aspartymidów jest zatem szczególnie poważnym zagadnieniem w produkcji API opartych na peptydach.
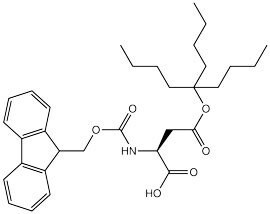
Fmoc-Asp(OBno)-OH 1 to unikalny blok budulcowy opracowany przez naukowców Novabiochem® który zapewnia proste i uniwersalne rozwiązanie zapobiegające tworzeniu się aspartymidów9,10 w standardowym Fmoc SPPS.
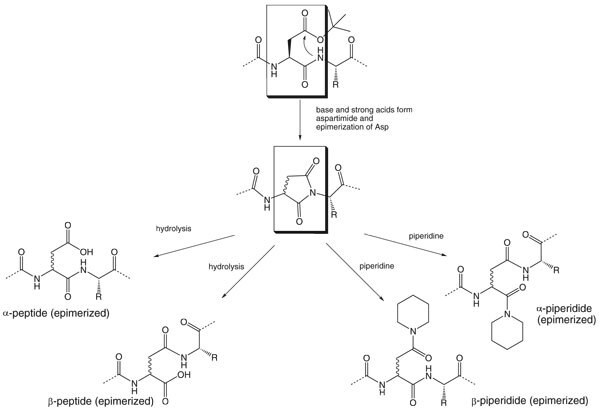
Rysunek 1. Tworzenie aspartymidu, pokazujące potencjalne produkty uboczne.
Niemal brak tworzenia się aspartymidów, nawet w przypadku sekwencji zawierających Asp-Gly
W testach porównawczych z Fmoc-Asp(OtBu)-OH i Fmoc-Asp(OMpe)-OH, przy użyciu klasycznego peptydu toksyny skorpiona II (VKDXYI, gdzie X=G, N lub R)11 gdzie peptydy związane z żywicą są traktowane 20% piperydyną w DMF przez 200 min w celu symulacji 100 x 2 min cykli deprotekcji, Fmoc-Asp(OBno)-OH dał zdecydowanie najlepsze wyniki. W przypadku X=N i R, zmniejszyło to tworzenie aspartymidu do prawie niewykrywalnych ilości (Rysunek 2, 3, Tabela 1). W przypadku X=G, najtrudniejszej sytuacji, tworzenie aspartymidu zostało zredukowane do zaledwie 0,1%/cykl, co jest nieistotne, jeśli weźmie się pod uwagę, że mieści się to w granicach czystości dostępnych na rynku aminokwasów N-α-Fmoc (Rysunek 4, Tabela 1).
Zwiększona stabilność chiralna
Aspartymidy są chiralnie labilne7, co znajduje odzwierciedlenie w wysokich wartościach D-asparaginianu obserwowanych dla peptydów toksyny skorpiona II przygotowanych z Asp(OtBu) i Asp(OMpe) (Tabela 1). Peptydy D-asparaginowe są często ukrytymi zanieczyszczeniami oczyszczonych peptydów ze względu na ich identyczną masę cząsteczkową i prawie identyczne właściwości fizykochemiczne. Niskie wartości D-Asp uzyskane za pomocą Fmoc-Asp(OBno)-OH zdecydowanie sugerują jego zastosowanie w procesach wytwarzania peptydów.
Łatwe sprzęganie i brak produktów alkilacji
Standardowy Fmoc SPPS (Gly²)-GLP-2, 33-mer, przy użyciu Fmoc-Asp(OBno)-OH dostarczył surowca, który zawierał znikome zanieczyszczenia związane z aspartymidem, zwiększając zawartość docelowego peptydu o 25% w porównaniu do standardowej pochodnej Fmoc-Asp(OtBu)-OH (Rysunek 5). Zastosowano pojedyncze jednogodzinne sprzężenia dla dwóch Fmoc-Asp(Bno)-OH. Wysoka czystość produktu wskazywała na łatwość sprzęgania Fmoc-Asp(OBno)-OH, a jego użycie nie prowadziło do tworzenia żadnych produktów ubocznych alkilacji związanych z Bno podczas rozszczepiania za pośrednictwem TFA.
Tabela 1. Skład surowych produktów otrzymanych z żywic peptydylowych VKDXYI po traktowaniu 20% piperydyną w DMF w temperaturze pokojowej. a Obliczenie rozpadu na cykl k: rozpad pierwszego rzędu: N = N0 - e-kt → k = -ln(N)/t ; N0 = 1; t = liczba cykli (100); N = powierzchnia % docelowego peptydu.
| Asp(OR)-(X) R = X = | Warunki | D-Asp | Aspartimide Per Cykl 10 min [%]a |
|---|---|---|---|
| tBu Arg | Piperydyna w RT | 25 | 1.24 |
| Mpe Arg | Piperidine at RT | 11 | 0.4 |
| Bno Arg | Piperidine at RT | 1.1 | 0.06 |
| tBu Asn | Piperydyna w RT | 9,1 | 1.65 |
| Mpe Asn | Piperydyna w RT | 4.2 | 0.49 |
| Bno Asn | Piperidine at RT | 0.9 | 0.04 |
| tBu Gly | Piperidine at RT | 18 | 0.49 |
| Mpe Gly | Piperidine at RT | 6 | 0.19 |
| Bno Gly | Piperidine at RT | 1.4 | 0.14 |
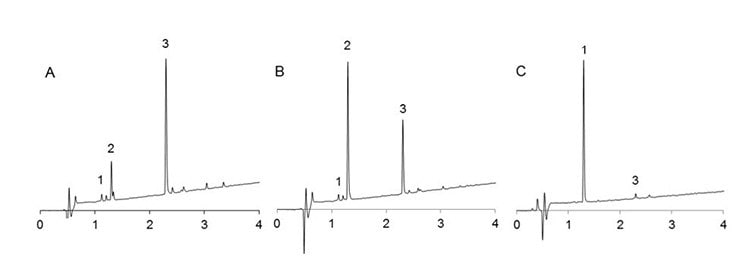
Rysunek 2. Profile UPLC surowych rozszczepionych peptydów VKDNYI po traktowaniu 20% piperydyną w DMF przez 18 h. 1: produkt; 2: D/L aspartymidy; 3: D/L piperydydy. A: wykonane z Fmoc-Asp(OtBu)-OH; B: wykonane z Fmoc-Asp(OMpe)-OH; C: wykonane z Fmoc-Asp(OBno)-OH.
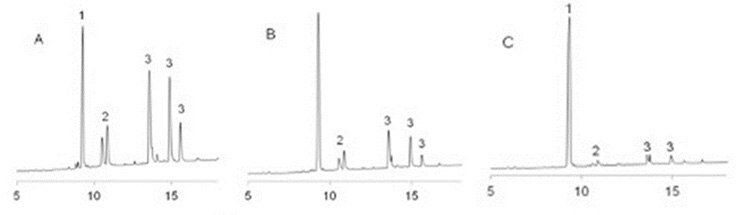
Rysunek 3. Profile UPLC surowych rozszczepionych peptydów VKDRYI po traktowaniu 20% piperydyną w DMF przez 18 h. 1: produkt; 2: D/L aspartymidy; 3: D/L piperydydy. A: wykonane z Fmoc-Asp(OtBu)-OH; B: wykonane z Fmoc-Asp(OMpe)-OH; C: wykonane z Fmoc-Asp(OBno)-OH.
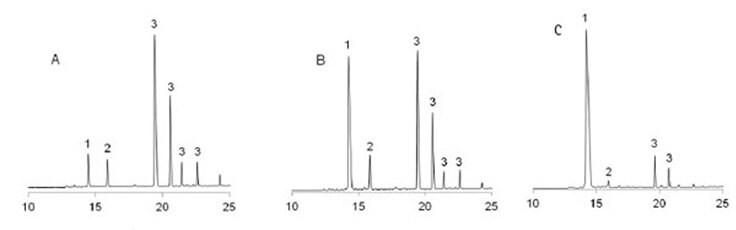
Rysunek 4. Profile UPLC surowych rozszczepionych peptydów VKDGYI po traktowaniu 20% piperydyną w DMF przez 18 h. 1: produkt; 2: D/L aspartymidy; 3: D/L piperydydy. A: wykonane z Fmoc-Asp(OtBu)-OH; B: wykonane z Fmoc-Asp(OMpe)-OH; C: wykonane z Fmoc-Asp(OBno)-OH.
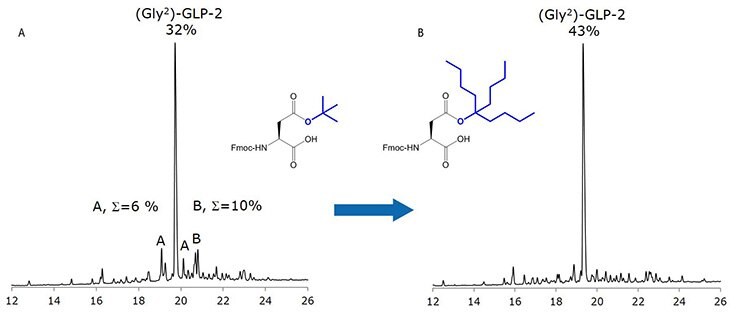
Rysunek 5. Profile UPLC surowego rozszczepionego Gly-GLP-2 wykonane z A, Fmoc-Asp(OtBu)-OH i B, Fmoc-Asp(OBno)-OH. A: D/L aspartimidy; B: D/L-α/β-piperydydy.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?