Wybieranie ortogonalnych bloków konstrukcyjnych
Gama produktów Novabiochem® zawiera jeden z największych zbiorów ortogonalnie i quasi-ortogonalnie chronionych trójfunkcyjnych aminokwasów. Pochodne te są użytecznymi narzędziami do syntezy cyklicznych i rozgałęzionych peptydów oraz peptydów zawierających modyfikacje łańcucha bocznego. Właściwości selektywnie chronionych aminokwasów Novabiochem® podano w Tabeli 1.
| Structure | Removed by | Method | Stable to | |
|---|---|---|---|---|
| O-All/Alloc |  | 3 eq. Pd(Ph3P)4 w CHCl3/AcOH/NMM (37:2:1) | Metoda 4 | TFA, piperydyna, hydrazyna |
| Azido | 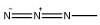 | 3 eq. Me3P w dioksanie/wodzie | Metoda 5 | TFA, piperydyna <./td> |
| STmp |  | β-Mercaptoethanol, 0.1 NMM w DMF | Metoda 7 | TFA (częściowy), piperydyna
|
| N-xDde |  | 2% hydrazyna w DMF lub 20% hydroksyloamina/ 15% imidazol w NMP/DCM (5:1) | Metoda 1 | TFA, piperydyna, Pd(0), DBU |
| O-Dmab |  | 2% hydrazyna w DMF | Metoda 1 | TFA, piperydyna, Pd(0), DBU |
| S-Mmt |  | 2% TFA w DCM zawierający 1-5% TIS | Metoda 6 | Pd(0), hydrazyna, piperydyna |
| N-Mtt |  | 1% TFA w DCM zawierającym 1-5% MeOH | Metoda 2 | Pd(0), hydrazyna, piperydyna |
| N-Mmt |  | 0.6 M HOBt w DCM/TFA (1:1) | Metoda 3 | Pd(0), hydrazyna, piperydyna |
| O-2-(PhiPr) | 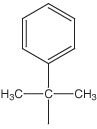 | 2% TFA w DCM zawierający 1-5% TIS | Metoda 6 | Pd(0), piperydyna |
| O-Trt |  | 1% TFA w DCM zawierający 1-5% TIS | Metoda 6 | Pd(0), hydrazyna, piperydyna |
| O-2-ClTrt |  | 1% TFA w DCM zawierający 1-5% TIS | Metoda 6 | Pd(0), hydrazyna, piperydyna |
Kwas diaminopropionowy/butanowy, pochodne ornityny i lizyny
Fmoc-Dpr(ivDde)-OH, Fmoc-Dab(ivDde)-OH, Fmoc-Orn(ivDde)-OH, Fmoc-Lys(ivDde)-OH, ivDde-Lys(Fmoc)-OH

Fmoc-Dpr(Mtt)-OH, Fmoc-Dab(Mtt)-OH, Fmoc-Orn(Mtt)-OH, Fmoc-Lys(Mtt)-OH

Fmoc-Lys(Mmt)-OH
Dde/ivDde
Od czasu wprowadzenia grup Dde1 i ivDde2 odpowiednio w 1993 i 1998 roku, strategia Fmoc/xDde stała się standardowym podejściem do syntezy rozgałęzionych, cyklicznych i modyfikowanych łańcuchami bocznymi peptydów metodą Fmoc SPPS, z ponad 200 publikacjami cytującymi użycie tych grup ochronnych3.
Użyteczność tej strategii wynika z faktu, że aminy pierwszorzędowe chronione Dde i ivDde są stabilne wobec 20% piperydyny i TFA, ale są rozszczepiane 2% hydrazyną w DMF. W ten sposób grupy aminowe chronione przez te grupy mogą być selektywnie demaskowane na fazie stałej bez wpływu na grupy chroniące łańcuchy boczne innych reszt, ułatwiając późniejszą modyfikację specyficzną dla miejsca. Co więcej, reakcję można monitorować za pomocą spektrofotometrii, ponieważ produkt rozszczepienia indazolu silnie absorbuje przy 290 nm (Rysunek 1).

Rysunek 1. Usuwanie ivDde
Przykłady zastosowania strategii Fmoc/Dde obejmują: rozgałęzione1 i di-epitopowe peptydy4, cykliczne peptydy5,6, cząsteczki TASP7, peptydy znakowane fluorescencyjnie8, sondy wielofunkcyjne9 i ubikwitynowane peptydy10.
Wybór pomiędzy Dde i ivDde zależy od zastosowania. Dde jest łatwiejszy do usunięcia niż ivDde, ale jest znacznie mniej wytrzymały. Zaobserwowano, że Dde ulega migracji podczas deprotekcji N-ε-Fmoc-Lys i N-końcowych reszt Dpr za pośrednictwem piperydyny, co prowadzi do zakodowania jego pozycji w łańcuchu peptydowym; a częściową utratę odnotowano podczas syntezy długich sekwencji11. Z drugiej strony, bardziej utrudniona grupa ivDde nie ulega wymywaniu ani migracji łańcucha bocznego w żadnym znaczącym stopniu, z wyjątkiem szczególnego przypadku Dpr12, ale czasami może okazać się niezwykle trudna do usunięcia, szczególnie jeśli znajduje się na C-końcu peptydu lub w zagregowanym regionie sekwencji.
Dostępne są pochodne fmoc lizyny, w których grupy α- i ε-aminowe są chronione za pomocą Dde i ivDde: Fmoc-Lys(Dde)-OH, Dde-Lys(Fmoc)-OH, Fmoc-Lys(ivDde)-OH; oraz ivDde-Lys(Fmoc)-OH. W przypadku Dpr i Dab dostępne są tylko pochodne zabezpieczone łańcuchem bocznym ivDde: Fmoc-Dpr(ivDde)-OH i Fmoc-Dab(ivDde)-OH.
Ponieważ hydrazyna może również usuwać grupy Fmoc, a także grupy Dde i ivDde, podczas przygotowywania cyklicznych lub bocznych peptydów modyfikowanych strategią Fmoc/Dde montaż szkieletu peptydu jest zwykle zakończony przed deprotekcją grup Dde/ivDde. N-koniec peptydu powinien być zabezpieczony Boc, co można osiągnąć przez bezpośrednie przyłączenie N-końca peptydu.N-końcowej reszty jako aminokwasu chronionego Boc lub acylowanie wolnej N-końcowej grupy aminowej za pomocą Boc2O.
Usuwanie Dde lub ivDde jest zwykle osiągane przez traktowanie żywicy 2% hydrazyną w DMF, chociaż w przypadkach, w których usuwanie ivDde okazało się trudne, zastosowano roztwory nawet 10% hydrazyny. Proces ten można śledzić spektrofotometrycznie przy tej samej długości fali, która jest używana do monitorowania usuwania Fmoc, ponieważ produktem reakcji grupy Dde lub ivDde z hydrazyną jest chromoforowa pochodna indazolu (Rysunek 1). Dde i ivDde są również stabilne wobec zwykłych odczynników stosowanych do rozszczepiania Boc (TFA lub 50% TFA w DCM) oraz wobec DBU w normalnych stężeniach (ok. 2%) stosowanych do usuwania Fmoc.
Jeśli grupa ivDde znajduje się blisko C-końca peptydu lub peptyd uległ agregacji, usuwanie ivDde może być bardzo powolne i często niekompletne. Problemu tego można uniknąć w przypadku peptydów zawierających zmodyfikowaną lizynę w łańcuchu bocznym poprzez zastosowanie ivDde-Lys(Fmoc)-OH zamiast Fmoc-Lys(ivDde)-OH do przyłączenia tych reszt. Zastosowanie tego pierwszego pozwala na modyfikację łańcucha bocznego lizyny podczas przedłużania łańcucha. Po włączeniu ivDde-Lys(Fmoc)-OH do łańcucha peptydowego, grupa Fmoc łańcucha bocznego może zostać usunięta za pomocą piperydyny, grupa aminowa łańcucha bocznego poddana reakcji z pożądaną cząsteczką funkcjonalizowaną kwasem karboksylowym, przed usunięciem ivDde za pomocą hydrazyny i przedłużeniem łańcucha w zwykły sposób.
Kompletną ortogonalność Dde z Fmoc wykazano, jeśli chlorowodorek hydroksyloaminy/imidazol (1.3:1) w NMP zamiast hydrazyny w DMF do usuwania Dde13.
Metoda 1: Selektywne usuwanie Dde/ivDde za pomocą 2% hydrazyny w DMF
Batch
- Umieścić żywicę peptydylową w kolbie i poddać działaniu 2% monohydratu hydrazyny w DMF (25 mL/g). Zamknąć kolbę i pozostawić w temperaturze rt na 3 minuty.
- Przefiltrować żywicę i powtórzyć traktowanie hydrazyną jeszcze dwa razy. Przemyć częściowo zabezpieczoną żywicę DMF.
Przepływ ciągły
- Przepływ 2% monohydratu hydrazyny w DMF z szybkością 3 ml/min przez żywicę peptydylową upakowaną w kolumnie reakcyjnej o średnicy 1 cm.Deprotekcję można śledzić monitorując spektrofotometrycznie przy 290 nm absorbancję eluentu kolumny przy użyciu kuwety o długości ścieżki 0.Gdy reakcja jest zakończona, na co wskazuje powrót absorbancji do pierwotnej wartości, kolumnę należy przepłukać DMF.
Mtt
Grupę Mtt można usunąć z łańcucha bocznego lizyny lub ornityny za pomocą 1% TFA w DCM14 lub za pomocą DCM/HFIP/TFE/TES (6.5:2:1:0,5) (Metoda 2), umożliwiając selektywne usuwanie w obecności innych grup zabezpieczających łańcuchy boczne, które wymagają do 95% TFA do usunięcia. W przypadku stosowania TFA zaleca się dodanie 1-5% TIS lub MeOH w celu wygaszenia uwolnionych kationów tritylowych. Wstępne wyniki wskazują, że zmiatanie MeOH zapobiega utracie grup t-butylowych i przedwczesnemu rozszczepieniu żywic Rink Amide15 (Metoda 2b).
Metoda 2: Usuwanie Mtt z Lys na fazie stałej
a) DCM/HFIP/TFE/TES
- Add DCM/HFIP/TFE/TES (6.5:2:1:0.5) (20 ml/g żywicy) do żywicy peptydylowej.
- Pozostawić mieszaninę do odstania z delikatnym mieszaniem przez 1 godzinę.
- Wyjmij małą próbkę żywicy i przemyj DCM. Dodaj 1% TFA w DCM do próbki żywicy. Jeśli natychmiast utworzy się pomarańczowy kolor, pozostaw reakcję na kolejną godzinę.
- Gdy test trytylowy jest negatywny, przemyj żywicę DMF, 10% DIPEA w DMF, DMF i użyj w następnym etapie syntezy.
b) TFA/DCM/MeOH
- Dodaj TFA/DCM/MeOH (1:98:1) (15 mg/ml) do żywicy peptydylowej. Odsączyć po 1 min.
- Dodaj świeży TFA/DCM/MeOH (1:98:1) (15 mg/ml) do żywicy peptydylowej i pozostaw na 16 h.
- Umyć żywicę DMF, 10% DIPEA w DMF, DMF i użyć w następnym etapie syntezy.
Mmt
Grupa Mmt jest znacznie łatwiejsza do usunięcia niż Mtt. Jest ona szybko odszczepiana od łańcucha bocznego lizyny przy użyciu tych samych metod, które opisano dla Mtt, ale może być nawet usunięta przy użyciu AcOH/TFE/DCM (1:2:7)16 lub HOBt w DCM/TFE (Metoda 3). Zastosowanie Fmoc-Lys(Mmt)-OH jest idealne w przypadkach, w których usunięcie Mtt jest problematyczne. Ze względu na ekstremalną wrażliwość grupy Mmt na kwasy, sprzęganie Fmoc-Lys(Mmt)-OH najlepiej przeprowadzać przy użyciu PyBOP®/DIPEA lub innych metod sprzęgania z udziałem zasad.
Metoda 3: Usuwanie grupy Mmt
- Dodaj 0.6 M HOBt w DCM/TFE (1:1) do żywicy spęcznionej w DCM.
- Delikatnie mieszać przez 1h; roztwór staje się ciemnoczerwony.
- Rozpuszczalnik jest usuwany przez filtrację, a kroki 1 i 2 są powtarzane.
- Żywicę usuwa się przez filtrację, przemywa DMF i natychmiast wykorzystuje w syntezie lub przemywa dalej DCM, a następnie MeOH, suszy i przechowuje do późniejszego wykorzystania
Alloc
Grupa Alloc jest stabilna w traktowaniu piperydyną i TFA, ale może być łatwo usunięta w łagodnych warunkach przez katalizowany Pd(0) allilotransfer17. Na tym etapie zastosowano wiele metod, ale być może najbardziej użyteczna jest metoda Katesa, et al. wykorzystująca Pd(Ph3P)4/CHCl3/HOAc/NMM18 (metoda 4). Grupa Alloc nie jest kompatybilna z warunkami stosowanymi do usuwania ivDde19. Uważa się, że obecność niewielkiej ilości diazyny w hydrazynie powoduje redukcję podwójnego wiązania w grupie allilowej. Na szczęście ta reakcja uboczna może być łatwo przezwyciężona przez dodanie alkoholu allilowego do odczynnika hydrazynowego.
Metoda 4: Usuwanie grup zabezpieczających alok/allil
Ta reakcja jest wrażliwa na powietrze i wszystkie manipulacje powinny być przeprowadzane w atmosferze Ar.
- Odważyć żywicę peptydylową do probówki i wysuszyć w temperaturze 40°C pod wysoką próżnią. Zamknąć probówkę gumową przegrodą. Przepłukać naczynie strumieniem Ar dostarczanym przez igłę wprowadzoną przez przegrodę.
- Odważyć Pd(PPh3)4 (3 eq.) do suchej probówki, dodać CHCl3-AcOH-N-metylomorfolinę (37:2:1) (15 ml/g żywicy), rozpuścić katalizator przepuszczając strumień Ar przez roztwór i zamknąć probówkę gumową przegrodą.
- Przenieść tę mieszaninę za pomocą gazoszczelnej strzykawki przepłukiwanej Ar do probówki zawierającej żywicę. Pozostawić na 2 godziny, od czasu do czasu delikatnie mieszając.
- Przenieść żywicę do lejka ze szkła spiekanego i przemyć kolejno 0,5% DIPEA w DMF i dietyloditiokarbaminianem sodu (0,5% w/w) w DMF w celu usunięcia katalizatora.
Powyższą procedurę można również przeprowadzić na dowolnym zautomatyzowanym syntezatorze peptydów, który wykorzystuje N2 mieszanie do rozpuszczania i przenoszenia odczynników. Katalizator Pd(PPh3)4 należy odważyć do kasety z aminokwasami i rozpuścić w CHCl3-AcOH-N-metylomorfolinie (37:2:1) mieszając w Ar. Kasetę należy szczelnie zamknąć i umieścić w automatycznym podajniku w normalny sposób. Następnie urządzenie powinno zostać zaprogramowane do przeniesienia zawartości fiolki do naczynia reakcyjnego lub kolumny bez dodawania kolejnych odczynników. Jeśli aparat posiada zapasowe zbiorniki rozpuszczalnika, można je napełnić 0,5% DIPEA w DMF i dietyloditiokarbaminianem sodu (0,5% w/w) w DMF, aby umożliwić automatyczne płukanie żywicy po deprotekcji allilu.
Uwaga: Jeśli N-końcowa grupa Fmoc jest usuwana po odcięciu estru allilowego lub jeśli karbodiimid ma być użyty do przeprowadzenia cyklizacji, żywica powinna być również przemyta HOBt/DMF.
Azydy
Azydy mogą być redukowane w łagodnych warunkach za pomocą tioli lub fosfin do odpowiednich amin. W związku z tym, aminokwasy chronione Fmoc posiadające boczne łańcuchy funkcyjne azydowe są użytecznymi narzędziami do przygotowania rozgałęzionych i modyfikowanych peptydów. Grupa azydowa jest stabilna w warunkach sprzęgania i traktowania piperydyną. Jest również stabilna w warunkach rozszczepiania TFA, pod warunkiem, że tiole są pominięte w koktajlu20. Redukcja azydku w fazie stałej selektywnie usuwa grupę aminową łańcucha bocznego bez wpływu na inne reszty aminokwasowe21, 22.
Metoda 5: Redukcja grupy azydkowej na fazie stałej
- Umyć żywicę trzykrotnie dioksanem i dioksanem/wodą (4:1).
- Odcedzić żywicę i dodać 1 M Me3P w toluenie (6 eq.) w dioksanie/wodzie (4:1). Delikatnie mieszać przez 30 minut.
- Usuń małą próbkę żywicy i przemyj dioksanem, a następnie DCM. Dodać 95% TFA i pozostawić do rozszczepienia na 1,5 h. Analizować za pomocą HPLC w celu sprawdzenia kompletności redukcji grupy azydkowej.
Pochodne Hse, Ser, Thr, Tyr i Cys

Fmoc-Cys(Mmt)-OH
Fmoc-Hse(Trt)-OH

Fmoc-Ser(Trt)-OH

Fmoc-Thr(Trt)-OH

Fmoc-Tyr(2-ClTrt)-OH
2-ClTrt/Trt/Mmt
Grupy 2-ClTrt, Trt i Mmt można usunąć z łańcuchów bocznych Tyr, Hse/Ser/Thr23 i Cys24 przy użyciu tylko 1% TFA w DCM, pozostawiając wszystkie inne grupy ochronne nienaruszone (Metoda 6). Pozwala to na selektywną deprotekcję pojedynczej reszty w celu późniejszej modyfikacji łańcucha bocznego. W produktach z wieloma resztami Ser, Thr lub Tyr, selektywność jest możliwa poprzez włączenie wszystkich innych takich reszt, z wyjątkiem reszty, która ma być zmodyfikowana, jako eteru butylowego. Usuwanie grupy tritylowej jest procesem równowagowym, więc musi być przeprowadzane przy użyciu silanów do zmiatania kationów tritylowych lub w trybie ciągłego przepływu w celu utrzymania równowagi. W przypadku Ser(Trt), Coba, et al. 25 opisali użycie 20% kwasu dichlorooctowego w DCM przez 10 minut w celu usunięcia Trt.Procedura ta może mieć również szersze zastosowanie do deprotekcji innych aminokwasów chronionych tritylem.
Najczęstszym zastosowaniem pochodnych Ser/Thr/Tyr jest przygotowanie fosfopeptydów metodą postsyntetyczną przy użyciu odczynnika fosforoamidytowego.
W badaniu porównawczym uzyskano czystsze produkty przy użyciu aminokwasów chronionych tritylem w łańcuchu bocznym niż w przypadku aminokwasów chronionych butylem26.
Metoda 6: Usuwanie grup tritylowych z fazy stałej
Metoda wsadowa
- Suchą żywicę (1 g) zalać DCM w lejku ze szkła spiekanego (typu z kranikiem i korkiem). Usunąć nadmiar DCM.
- Dodać 94:1:5 DCM/TFA/TIS (10 ml), zamknąć lejek i wstrząsać przez 2 minuty. Usunąć rozpuszczalnik stosując ciśnienie N2.
- Powtórzyć krok 2 trzy razy.
- Umyć żywicę DCM i wysuszyć pod próżnią.
Metoda przepływowa
- Zalać żywicę (1 g) DCM i umieścić w kolumnie reakcyjnej.
- Przepompować 1% TFA w DCM (2 ml/min) przez żywicę. Reakcję można śledzić mierząc absorbancję eluentu kolumny przy użyciu celi przepływowej 0,1 mm przy długości fali 460 nma.
- Po zakończeniu reakcji, na co wskazuje powrót absorbancji do wartości wyjściowej, przepłucz kolumnę DCM.
aJeśli peptyd zawiera inne grupy zabezpieczające oparte na tritylu, poziom nie powróci do wartości wyjściowej ze względu na powolne wymywanie grup Trt].
tButhio/STmp
Insercja reszt Cys(tButhio)27 lub Cys(STmp)28 do sekwencji umożliwiają selektywną deprotekcję grupy tiolowej na fazie stałej, umożliwiając modyfikację reszt Cys lub tworzenie mostków disiarczkowych na żywicy.
Grupa t-butylotio jest stabilna wobec TFA, pod warunkiem, że tiole nie są używane jako zmiatacze w reakcji rozszczepiania. Jest ona usuwana przez redukcję tiolami lub trialkilofosfinami29, 30. Ostatnio Góngora-Benítez i in.31 wykazali skuteczność 20% β-merkaptoetanolu, 0.1 M NMM w DMF do usuwania tbutylotio na fazie stałej, gdzie sam β-merkaptoetanol lub fosfiny okazały się nieskuteczne.
Jednak w praktyce usunięcie grupy tButhio na podłożu stałym często okazuje się niezwykle trudne. Z tego powodu Albericio wprowadził niedawno grupę STmp28. Grupa STmp wydaje się być niezwykle łatwa do usunięcia za pomocą łagodnej tiolizy, ponieważ Albericio zgłosił usunięcie czterech grup STmp z fazy stałej za pomocą zaledwie trzech 5-minutowych zabiegów 0,1 M N-metylomorfoliny (NMM) w DMF zawierającym 5% merkaptoetanolu (metoda 7).
Metoda 7: Usuwanie STmp z żywicy za pomocą tioli
- Poddać żywicę peptydylową działaniu 5% β-merkaptoetanolu, 0.1 NMM w DMF przez 5 minut w temperaturze rt.
- Przemyć żywicę DMF i powtórzyć obróbkę tiolami jeszcze dwa razy.
Pochodne Asp i Glu
Ortogonalnie i quasi-ortogonalnie chronione pochodne Asp i Glu mają liczne zastosowania w syntezie peptydów i chemii kombinatorycznej. α-estry są szczególnie przydatne do otrzymywania cyklicznych peptydów head-to-tail poprzez cyklizację na żywicy, podczas gdy selektywnie chronione β- i γ- Asp i Glu mogą być wykorzystane w syntezie glikopeptydów i peptydów z mostkami laktamowymi typu łańcuch boczny-łańcuch boczny lub łańcuch głowa-łańcuch boczny18, 31-36
Allyl

Fmoc-Asp/Glu-OAll/Fmoc-Asp/Glu(OAll)-OH
Estry allilowe są stabilne w traktowaniu piperydyną i TFA, ale można je łatwo usunąć w łagodnych warunkach za pomocą katalizowanego przez Pd(0) przeniesienia allilu18, jak opisano wcześniej dla grupy Alloc (metoda 4).
Grupa allilowa nie jest kompatybilna z warunkami stosowanymi do usuwania ivDde19. Uważa się, że obecność niewielkiej ilości diazyny w hydrazynie powoduje redukcję podwójnego wiązania w grupie allilowej. Na szczęście ta reakcja uboczna może być łatwo przezwyciężona przez dodanie alkoholu allilowego do odczynnika hydrazynowego.
Dmab

Fmoc-Asp-ODmab, Fmoc-Glu-ODmab

Fmoc-Asp(ODmab)-OH, Fmoc-Glu(ODmab)-OH
Estry Dmab zostały opracowane we współpracy między prof. B.W. Bycroftem i dr W. Chanem z Uniwersytetu w Nottingham oraz Novabiochem®, aby zapewnić uzupełnienie ochrony aminowej Dde. Projekt grupy blokującej Dmab opiera się na zasadzie bezpieczeństwa i znanej skłonności estrów p-aminobenzylowych do ulegania 1,6-eliminacji37,38. Zabezpieczenie zapewnia grupa ivDde, która chroni funkcję aminową niestabilnego p- estru aminobenzylowego podczas syntezy.
Ochrona
Ochrona Dmab jest quasi-ortogonalna do strategii Fmoc/tBu, ponieważ estry Dmab są stabilne wobec 20% piperydyny w DMF i TFA, ale są ilościowo rozszczepiane 2% hydrazyną w DMF w ciągu kilku minut.Usuwanie Dmab obejmuje dwuetapowy proces: traktowanie hydrazyną początkowo usuwa grupę N-ivDde; następnie następuje rozpad powstałego estru benzylowego, z jednoczesnym uwolnieniem kwasu karboksylowego (Rysunek 2).
Reakcja deprotekcji może być prowadzona w sposób wsadowy lub ciągły.W tym drugim przypadku reakcja może być monitorowana spektrofotometrycznie przy 290 nm poprzez śledzenie uwalniania produktu ubocznego indazolu. Sporadycznie obserwowano powolne rozszczepianie ugrupowania aminobenzylowego39-42, które wydaje się być bardzo zależne od sekwencji. W takich przypadkach skuteczne okazało się przemywanie nośnika 20% DIPEA w DMF/wodzie (90:10)39 lub 5 mM wodorotlenkiem sodu w metanolu42 42 . Ponieważ hydrazyna usunie Fmoc, montaż szkieletu peptydowego musi zostać zakończony przed deprotekcją łańcucha bocznego Dmab. N-koniec peptydu powinien być chroniony Boc. Można to osiągnąć albo przez bezpośrednie włączenie N-końcowej reszty jako aminokwasu chronionego Boc lub acylowanie wolnej N-końcowej grupy aminowej za pomocą Boc2O.
Fmoc-Asp-ODmab został wykorzystany do przygotowania cyklicznego analogu pirokorycyny43, 29-merowego cyklicznego peptydu typu head-to-tail44 oraz peptydu chlorofusyny45.

Rysunek 2. Usunięcie Dmab
2-PhiPr

Fmoc-Glu(O-2-PhiPr)-OH

Fmoc-Asp(O-2-PhiPr)-OH
Grupę 2-fenyloizopropylową (2-PhiPr)46 można usunąć z łańcucha bocznego Asp i Glu przy użyciu 1% TFA, jak w protokole podanym w Metodzie 6. Zastosowanie tej grupy ochronnej w połączeniu z Mtt na Lys lub Orn zapewnia doskonałą strategię syntezy peptydów laktamowych z łańcuchem bocznym do łańcucha bocznego. W przeciwieństwie do Dmab i All, grupa 2-PhiPr zapewnia znaczną ochronę przed tworzeniem aspartymidu, co czyni Fmoc-Asp(O-2-PhiPr) pochodną z wyboru do syntezy cyklicznych peptydów, które są podatne na tę reakcję uboczną.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?