Ficoll® 400 do wirowania gradientowego
Nr produktu. F4375
CAS #: 26873-85-8
Ficoll® 400 jest wysoce rozgałęzionym polimerem powstałym w wyniku kopolimeryzacji sacharozy i epichlorohydryny. Ficoll® 400 jest całkowicie niejonowy. Ze względu na dużą ilość grup hydroksylowych, Ficoll® 400 jest bardzo hydrofilowy i wyjątkowo rozpuszczalny w wodzie. Najczęstszym zastosowaniem Ficoll® 400 jest pożywka o gradiencie gęstości do separacji i izolacji komórek eukariotycznych, organelli i komórek bakteryjnych. Można uzyskać zakres gęstości do 1,2 g/ml.
Właściwości fizyczne
Wygląd: Biały do białego ze słabym żółtym proszkiem
Straty podczas suszenia: Nie więcej niż 5%1
Ciężar cząsteczkowy: 400 000 +/- 100 000, jak określono na podstawie lepkości wewnętrznej1
Specyficzna rotacja: +56.5° at 20 °C (C=1% in water)1
Lepkość wewnętrzna: ok. 0.17 dl/g1
Dializowalny materiał, w tym NaCl: mniej niż 1%1
Promień Stokesa: około 10 nm1
W przeciwieństwie do sacharozy, roztwory Ficollu mają stosunkowo niską osmolalność. Mimo to gęstość Ficoll w roztworach wodnych jest porównywalna z gęstością sacharozy.
Z powodu wysokiej masy cząsteczkowej i niskiej zawartości materiału dializowalnego, Ficoll ma znacznie niższą przepuszczalność w stosunku do błon komórkowych niż sacharoza. Dlatego można oczekiwać, że komórki będą gromadzić się w gradientach Ficoll z mniejszą gęstością niż w gradientach sacharozy. Ze względu na niską przepuszczalność błon i niskie ciśnienie osmotyczne, separacja w Ficoll zwykle skutkuje lepszym zachowaniem funkcji i morfologii komórek.
Przechowywanie/Stabilność
Przechowywany prawidłowo jako proszek w temperaturze pokojowej Ficoll 400 może mieć okres trwałości 5 lat.
Rozpuszczalność/stabilność roztworu
Stężenia 50% (w/v) można osiągnąć w wodzie. Ficoll powinien być dodawany powoli przy ciągłym mieszaniu.
Testujemy rozpuszczalność Ficoll 400 przy 1 g w 10 ml wody dejonizowanej, uzyskując klarowny do lekko mętnego, bezbarwny do słabo żółtego roztwór.
Ficoll jest stabilny w roztworach alkalicznych i obojętnych. Przy wartościach pH poniżej 3 ulega szybkiej hydrolizie, szczególnie w podwyższonych temperaturach.
Ficoll można sterylizować w autoklawie przy neutralnym pH, w temperaturze 110 °C przez 30 minut.
Należy unikać silnych środków utleniających i redukujących.
Procedura
Wirowanie
Ficoll® 400 może być stosowany do wirowania gradientowego we wszystkich typach rotorów wirówek i do separacji przy jednostkowej grawitacji. W przypadku wirowania możliwe są zarówno gradienty nieciągłe, jak i ciągłe. Gradienty nieciągłe mają dwie główne zalety: Po pierwsze, nagłe zmiany gęstości Ficoll 400 oznaczają, że wyizolowane komórki znajdują się w ostrych pasmach na styku warstw o różnej gęstości. Pozwala to na łatwe usunięcie próbki za pomocą pipety. Po drugie, komórki o dużych różnicach gęstości można łatwo wyizolować za pomocą zaledwie dwóch warstw gęstości. Osiąga się to poprzez wybór gęstości, które zapobiegną przedostawaniu się jednego lub więcej typów komórek do niższej fazy, pasmując te typy komórek na granicy faz.
Aby oszacować gęstości wymagane dla konkretnego zastosowania, zapoznaj się z poniższą tabelą:
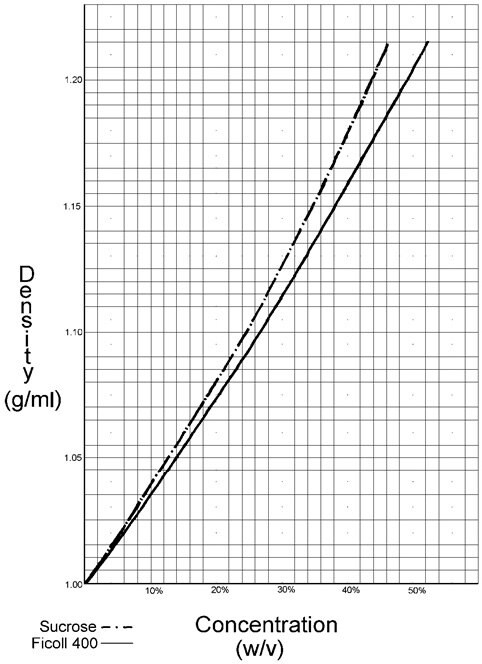
Rysunek 1.Poniżej przedstawiono wykres gęstości Ficoll w funkcji stężenia.
Przygotowanie nieciągłego gradientu:
- Przygotuj Ficoll 400 w buforze lub izotonicznym roztworze sacharozy (0,25M) w stężeniach, które powinny oddzielić interesujący materiał. Większość komórek i organelli ma gęstość wyporu między 1,0 a 1,2 g/ml w Ficoll 400. Często wystarczający jest gradient dwuwarstwowy. Roztwory wykonane na tym etapie mogą być przechowywane w lodówce, ale powinny być używane w temperaturze pokojowej.
- W standardowych probówkach wirówkowych utwórz warstwy (o głębokości około 1 cm) z najgęstszą warstwą na dnie.
- Uważając, aby nie mieszać warstw gradientu, ostrożnie ułóż próbkę na wierzchu. Delikatnie wymieszaj próbkę i najwyższą warstwę Ficoll 400 za pomocą szklanego pręcika, aby wyeliminować interfejs przed wirowaniem.
Podczas wirowania różne cząstki będą gromadzić się w warstwach Ficoll lub między nimi, w zależności od ich gęstości. Po zakończeniu wirowania należy odessać pipetą różne fazy i usunąć Ficoll z interesujących nas frakcji. Ficoll może być usunięty z wyizolowanych komórek i organelli poprzez powtarzane cykle rozcieńczania buforem, a następnie wirowanie. Resztkowe ilości Ficoll 400 w próbce można oszacować za pomocą reakcji antronowej.2
W niektórych przypadkach może być pożądany ciągły lub liniowy gradient gęstości. Można go łatwo przygotować przy użyciu mieszalnika gradientowego. Do prostych separacji można użyć homologicznego roztworu Ficoll 400 bez gradientu. Frakcjonowanie odbywa się poprzez stopniowe zwiększanie prędkości wirowania. Ficoll był również stosowany w badaniach wirowania strefowego.3
Sedymentacja grawitacyjna przez gradient gęstości jest szeroko stosowana do oddzielania komórek wrażliwych na wirowanie. Komórki o podobnej gęstości, ale różnej wielkości mogą być również skutecznie oddzielane przy jednostkowej grawitacji.4,5,6
Podłoża gęstości Ficoll-Hypaque (Histopaque)
W zastosowaniach wymagających Ficoll-Hypaque stosuje się mieszaninę Ficoll i diatrizoatu sodu. Oferujemy wstępnie uformowane mieszaniny o trzech różnych gęstościach pod nazwami produktów Histopaque-1077. 1083, oraz 1119.
Hybrydyzacja kwasów nukleinowych
Ficoll 400 jest składnikiem roztworu Denhardta stosowanego w analizie Northern i Southern blot. Ficoll zmniejsza niespecyficzne wiązanie materiału z membranami nitrocelulozowymi podczas hybrydyzacji kwasów nukleinowych.7
Oferujemy roztwór Denhardta (numer produktu D2532), koncentrat 50X, przetestowany do stosowania w hybrydyzacji kwasów nukleinowych. Typowe roztwory do hybrydyzacji wymagają 5-krotnego stężenia roztworu Denhardta.
Zastosowania immunologiczne
Ficoll 400 został zastosowany jako nośnik haptenów i został sprzężony z dinitrofenolem, trinitrofenolem i fluoresceinizotiocyjanianem w celu wzmocnienia pierwotnej odpowiedzi immunologicznej u myszy. Koniugaty o różnych poziomach podstawienia i minimalnej toksyczności są łatwe do przygotowania.8,9
Chemicznie zdefiniowane pożywki do hodowli komórkowych
Ficoll jest stosowany z i bez czynników wzrostu pochodzących z surowicy w celu wspierania wzrostu zarówno pierwotnych kultur, jak i ustalonych linii komórkowych.10,11
Dializa koncentracyjna
Ficoll 400 jest przydatny do zatężania roztworów za pomocą dializy, ponieważ jego wysoka masa cząsteczkowa uniemożliwia mu przejście przez błonę dializacyjną. Ciśnienie osmotyczne wciąga wodę przez membranę do roztworu Ficoll 400, skutecznie zagęszczając wrażliwe materiały.1
Elektroforeza
Elektroforeza w przepływie ciągłym zwykle wymaga stabilizatora w elektrolicie. Ficoll 400 jest często używany do tego zastosowania.12,13
Podział fazowy
Podział fazowy oddziela komórki na podstawie właściwości powierzchni. Ficoll 400 jest łączony z glikolem polietylenowym w układach dwufazowych oraz z dekstranem i glikolem polietylenowym w układach trójfazowych.14,15
Fizjologiczne roztwory do perfuzji i stabilizacji komórek
Ficoll został dodany do perfuzatu soli fizjologicznej podczas monitorowania wydalania białka w naczyniach. Witryfikowane zarodki myszy rozcieńczono roztworami zawierającymi 30% Ficoll plus 0,5 M sacharozy.17 Izolowane nerki szczurów perfundowano roztworem Tyrode'a zawierającym 4,7% Ficoll 400.18
*Ficoll jest zastrzeżonym znakiem towarowym firmy Pharmacia. Informacje na temat właściwości fizycznych i zastosowań uzyskano od firmy Pharmacia.
*Ficoll jest zastrzeżonym znakiem towarowym firmy Pharmacia.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?