Wszystkie zdjęcia(1)
Kluczowe dokumenty
A1501
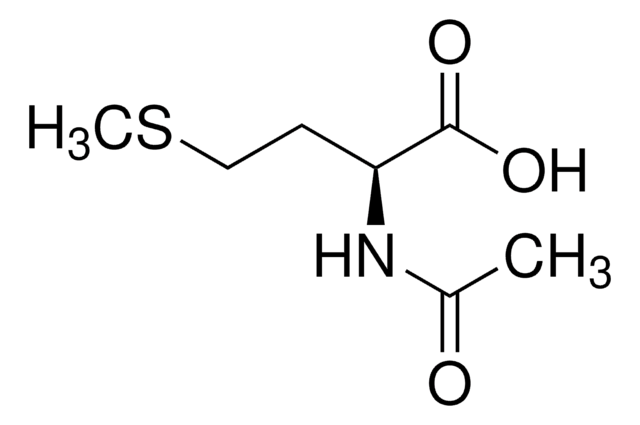
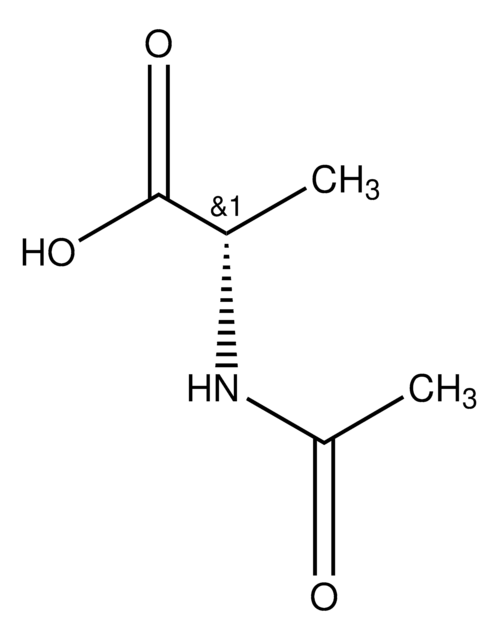
N-Acetyl-D-methionine
~99%, suitable for ligand binding assays
Zaloguj sięWyświetlanie cen organizacyjnych i kontraktowych
About This Item
Wzór empiryczny (zapis Hilla):
C7H13NO3S
Numer CAS:
Masa cząsteczkowa:
191.25
Beilstein:
1725553
Numer WE:
Numer MDL:
Kod UNSPSC:
12352209
eCl@ss:
32160406
Identyfikator substancji w PubChem:
NACRES:
NA.26
Polecane produkty
Nazwa produktu
N-Acetyl-D-methionine, ~99%
Próba
~99%
Poziom jakości
Formularz
powder or crystals
metody
ligand binding assay: suitable
kolor
white
mp
102.3-103.6 °C
temp. przechowywania
−20°C
ciąg SMILES
CSCC[C@@H](NC(C)=O)C(O)=O
InChI
1S/C7H13NO3S/c1-5(9)8-6(7(10)11)3-4-12-2/h6H,3-4H2,1-2H3,(H,8,9)(H,10,11)/t6-/m1/s1
Klucz InChI
XUYPXLNMDZIRQH-ZCFIWIBFSA-N
Szukasz podobnych produktów? Odwiedź Przewodnik dotyczący porównywania produktów
Zastosowanie
N-Acetyl-D-methionine may be used as a substrate to identify, differentiate and characterized N-acylamino acid racemase(s) and N-acyl-D-amino acid amidohydrolase(s).
Ta strona może zawierać tekst przetłumaczony maszynowo.
Kod klasy składowania
11 - Combustible Solids
Klasa zagrożenia wodnego (WGK)
WGK 3
Temperatura zapłonu (°F)
Not applicable
Temperatura zapłonu (°C)
Not applicable
Środki ochrony indywidualnej
Eyeshields, Gloves, type N95 (US)
Wybierz jedną z najnowszych wersji:
Masz już ten produkt?
Dokumenty związane z niedawno zakupionymi produktami zostały zamieszczone w Bibliotece dokumentów.
Wen-Ching Wang et al.
Journal of molecular biology, 342(1), 155-169 (2004-08-18)
N-acylamino acid racemase (NAAAR) catalyzes the racemization of N-acylamino acids and can be used in concert with an aminoacylase to produce enantiopure alpha-amino acids, a process that has potential industrial applications. Here we have cloned and characterized an NAAAR homologue
Pei-Hsun Lin et al.
European journal of biochemistry, 269(19), 4868-4878 (2002-10-02)
An N-acyl-d-amino acid amidohydrolase (N-D-AAase) was identified in cell extracts of a strain, Iso1, isolated from an environment containing N-acetyl-d-methionine. The bacterium was classified as Variovorax paradoxus by phylogenetic analysis. The gene was cloned and sequenced. The gene consisted of
S Pittelkow et al.
Protein expression and purification, 12(2), 269-276 (1998-03-31)
Aminoacylase I (EC 3.5.1.14) is one of the most abundant enzymes in the cortical region of mammalian kidney. Both the porcine and the human enzyme were overexpressed using baculovirus expression vector systems and purified by hydrophobic interaction chromatography and anion-exchange
T Odajima et al.
Cell biochemistry and function, 16(2), 139-147 (1998-06-24)
Urate oxidase from Candida utilis, an enzyme containing an essential thiol, was examined for its sensitivity to lactoperoxidase, an oxidant present in breast milk. Upon exposure to a system composed of lactoperoxidase, hydrogen peroxide and bromide at moderately alkaline pH
M J Wick et al.
Biochemical pharmacology, 37(7), 1225-1231 (1988-04-01)
Both N-hydroxy-2-acetamidofluorene (N-OH-AAF) and the heterocyclic analogue, 2-(N-hydroxyacetamido)carbazole (N-OH-AAC), were shown to be mechanism-based irreversible inhibitors (suicide inhibitors) of partially purified rat hepatic N-acetyltransferase (NAT) activity. Although N-OH-AAC exhibited an apparent first-order inactivation rate constant (ki) that was 7-fold lower
Nasz zespół naukowców ma doświadczenie we wszystkich obszarach badań, w tym w naukach przyrodniczych, materiałoznawstwie, syntezie chemicznej, chromatografii, analityce i wielu innych dziedzinach.
Skontaktuj się z zespołem ds. pomocy technicznej