はじめに
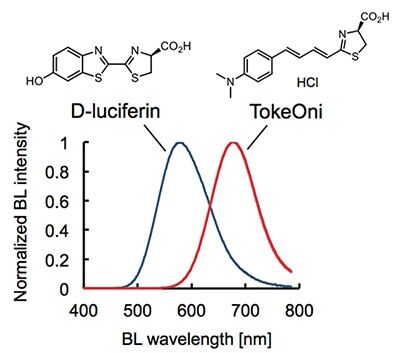
生物発光イメージングは生体組織における細胞増殖、シグナル活性やタンパク質相互作用などを非侵襲的かつ高感度に検出することができることから、この10年程の間に、生物医学研究において応用が急速に拡大した1-3。しかしながら、現在の標準的な発光酵素-基質の組み合わせであるホタルルシフェラーゼ(Fluc)とD-ルシフェリンを用いた発光イメージングシステムには欠点も存在する。例えば、野生型FlucとD-ルシフェリンによって生成される生物発光の最大発光波長λmaxは約560 nmであり、生体組織に含まれるヘモグロビンやメラニンに吸収されやすく4,5、生体深部組織にある標的の検出感度に改善の余地を残している。この問題を解決するために、生体組織透過性に優れる近赤外領域にλmaxを有する生物発光を利用した発光イメージングシステムの開発が望まれていた。
TokeOni(AkaLumine-HCl、808350)は、1)良好な化学的安定性、2)水または生理食塩水への高い溶解性、3)野生型Flucによる近赤外生物発光(λmax = 677 nm)を実現した世界初の実用的な発光基質である。ネイティブFlucを用いた現行のBLIシステムと高い互換性があり、特に生体深部におけるターゲットの検出感度に優れている6。
Tokeoniを用いた深部組織の高感度イメージング
TokeOniは、滅菌水に高濃度(< 40 mM)で溶解し、-80℃において長期間(< 3ヶ月)保存可能であり、ATPとマグネシウムイオンの存在下で、野生型Flucと反応して近赤外発光(λmax = 677 nm)を生成する(図1)。
TokeOniを用いた高感度発光イメージングの例として、マウス骨転移モデルにおけるがん細胞の検出感度をD-ルシフェリンと比較した例を示す。Flucを安定的に恒常発現するヒト前立腺癌細胞PC-3(PC-3/luc)を動脈血流から移植して後肢や腸管骨に腫瘍を形成したSCIDマウスに、100 μLの基質(濃度33 mM:〜50 mg/kg)を4時間の間隔をあけて、それぞれ腹腔内投与し、PerkinElmer社のIVIS-Spectrumを用いて生物発光イメージを取得した。図2に示したように、TokeOniは、同一の骨転移病巣からD-ルシフェリンに比べて5.2倍強い発光を生成し、生体組織深部のがん細胞をより高感度に検出することができた。
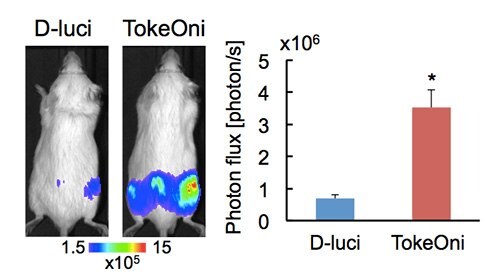
図2TokeOniによる骨転移がん細胞の高感度イメージング。D-ルシフェリン(D-luci)とTokeOniを投与して10分後に撮像した代表的な発光イメージ(左)と後肢骨転移病巣からの発光強度の定量的な解析結果(右)を示した。D-ルシフェリンを注射した4時間後に同じマウスにTokeOniを注射した。n=6、*p<0.05。<0.05.
TokeOniの使用に際して以下の点に注意する必要がある。TokeOniを担がんマウスに腹腔内投与すると、D-ルシフェリンよりも投与後短時間で腫瘍組織からの発光強度が最大になる傾向がある。そのため、発光イメージングに用いる小動物モデルにおいて、予め基質投与後の発光強度の推移を調べたうえで、本実験での発光イメージ取得時間を決定することを推奨する。また、TokeOniを用いてin vitroでのルシフェラーゼアッセイをおこなう場合は、使用する発光測定機器が近赤外領域の光に十分な検出感度を有しているか確認する必要がある。
まとめ
TokeOniは、D-ルシフェリンを用いた深部組織におけるイメージングで検出できなかった、より少量の細胞を観察するための優れた選択肢の一つである。TokeOniによる検出感度が向上によって、生体内のターゲットをより正確に定量的に検出することが可能となる。
References
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?