背景
上皮成長因子受容体 (EGFR) ・リガンド
受容体活性化
EGFR シグナリング
Ras/Raf シグナリングカスケード
ホスファチジルイノシトール3キナーゼ/Akt シグナリングカスケード
シグナル伝達性転写因子 (STAT) 経路
ホスホリパーゼCγシグナリング
Nck/PAKシグナリングカスケード
Cbl仲介型エンドサイトーシス
EGFRの核内への移動
分化中・疾患時のEGFR
まとめ
背景
上皮成長因子受容体(EGFR)は受容体チロシンキナーゼファミリー(RTK)に属し、ファミリーの中で最初に発見されたメンバーです。細胞外環境でさまざまなリガンドによって活性化され、細胞反応を伝達し、細胞増殖、細胞生存、成長や分化など、さまざまな細胞活動に介在します。EGFRは多くの臓器で発現しており、異常な発現はさまざまながんに関与しています。本レビューは主として、EGFR経路のさまざまなシグナリングとそのシグナル伝達経路について紹介します。
上皮成長因子受容体 (EGFR)とリガンド
ErbBファミリーはEGFR(ErbB-1/HER1)、ErbB-2(Neu、HER2)、ErbB-3(HER3)、およびErbB-4(HER4)という4つの受容体で構成されます。このタンパク質の受容体チロシンキナーゼファミリー(RTK)には細胞外リガンド結合ドメイン、疎水性膜貫通ドメイン、および細胞質チロシンキナーゼドメインがあります (表1)。ErbB受容体は、結合特異性を生じさせる3つのジスルフィド結合が特徴的なEGFファミリーの成長因子によって活性化されます。さらに構造的モチーフとして、免疫グロブリン様ドメイン、ヘパリン結合部位、およびグリコシル化部位があります1,2。
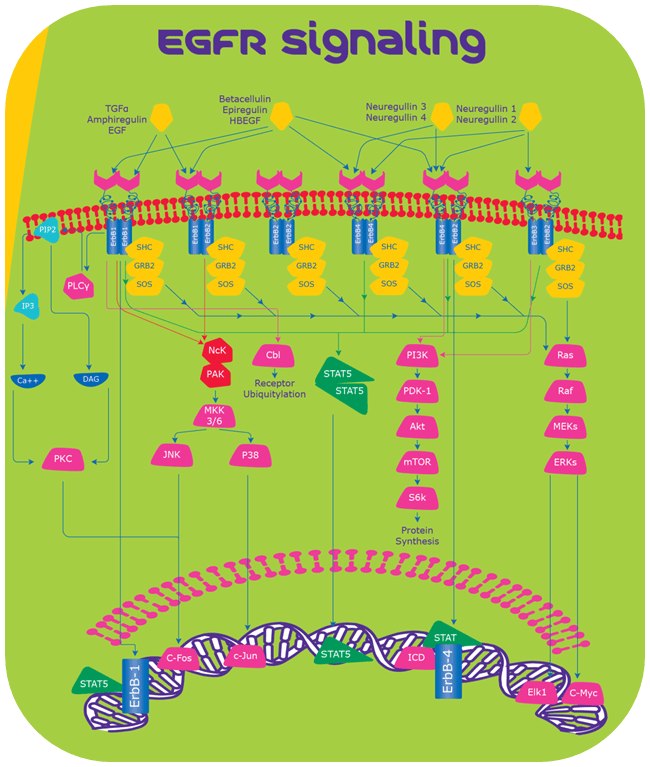
図1.EGFRシグナリング
EGFRシグナリング
Ras/Rafシグナリングカスケード
受容体:2つのErbB受容体の二量体
主な機能:細胞生存・細胞増殖5
ErbB受容体の活性化後、Grb2およびSosから成る複合体が直接またはアダプタータンパク質Shcの関与により、受容体の特異的チロシン残基に結合します6,7。これによりSosの立体構造が変化し、Ras-GDPをリクルートし活性化することが可能になります。Ras-GDPはRaf-1を活性化し、これによりマイトジェン活性化タンパク質キナーゼ(MAPK)を介してさらに細胞外シグナル調節キナーゼ1および2(ERK1およびERK2)を活性化します8,9。活性化されたキナーゼは最終的に核内に移動し、Elk1やC-mycなどの特異的転写因子をリン酸化し、細胞増殖を誘導します。
ホスファチジルイノシトール3キナーゼ/Akt シグナリングカスケード
受容体:ErbB4またはErbB3とErbB2との二量体
主な機能:細胞成長、アポトーシス抵抗、細胞浸潤・遊走10
ホスファチジルイノシトールはp85およびp110サブユニットから成ります。2つのサブユニットはErbB受容体に結合し、二次伝達物質であるホスファチジルイノシトール3,4,5-三リン酸を生成し、さらにセリン/スレオニンキナーゼAKTを活性化します。この活性化により、AKTがmTORをリン酸化し、続いてS6Kがリン酸化されることでタンパク質合成に至ります10。
シグナル伝達性転写因子 (STAT) 経路
受容体:ErbB
主な機能:腫瘍の進行、腫瘍発生、および血管新生11
STATタンパク質がSrcホモロジー2ドメインを介してErbB受容体のリン酸化チロシン残基に結合し、二量体化が起きると核内に移動し、Myc、Nos2、p21、サイトカインなどの特異的標的遺伝子の発現を促します12。
ホスホリパーゼCγシグナリング
受容体:ErbB1
主な機能:イオンチャネル、細胞遊走、カルシウム仲介型シグナリングの調節13
ホスホリパーゼCγはErbB1と相互作用を起こし、ホスファチジルイノシトール4,5-二リン酸(PIP2)を加水分解してイノシトール1,3,5-三リン酸(IP3)および1,2-ジアシルグリセロール(DAG)を生成します。IP3は細胞内カルシウム濃度を上昇させ、DAGはタンパク質キナーゼC(PKC)の活性化を仲介します13。 次に活性化されたPKCがMAPKおよびc-Jun NH2末端キナーゼを活性化します14。
Nck/PAKシグナリングカスケード
受容体:ErbB1
主な機能:細胞生存・細胞遊走15
NckはSH2ドメインを含むアダプタータンパク質で、SH2ドメインはEGF受容体に結合し、下流のシグナリングの引き金となります。NckはSH3ドメインを介してPAK1(p21/CDC42/Rac1活性化キナーゼ-1)の結合を活性化します。次に活性化されたPAK1がMEKK1(MAP/ERKキナーゼ-1)およびMKK4/7(MAPキナーゼ-4/7)を介してJNK(c-Junキナーゼ)をそれぞれ活性化します。JNKは核内に移動し、c-Fosおよびc-Junなどの転写因子をリン酸化します16。
Cbl仲介型エンドサイトーシス
受容体:ErbB1
主な機能:エンドサイトーシス
リガンド結合後、CblはSH2ドメインまたはGRB2アダプタータンパク質を介してEGF受容体に結合する基質になり、受容体のリソソーム分解の引き金となります17。
EGFRの核内への移動
EGF受容体にはリソソーム分解を逃れて核内に移動し、生物機能を調節します。核内でEGF受容体は Cyclin D1 遺伝子などの細胞生死遺伝子の転写を促し、さらにSTATおよびE2F1転写因子の補助因子として働きます18。EGFRの核局在化により抗腫瘍mAbの増殖抑制作用に対する抵抗性が生じ、疾患重症度に関わってきます19。
メルクの高品質で人気の高いEGFタンパク質を研究にご利用ください
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?