DNA損傷応答経路のターゲティングは、がん、細胞シグナル伝達、神経疾患などに関する研究にとって重要です。MDM2、p53、ATM、ATR、p21、CDK2/サイクリンE、GADD45などのDNA損傷の主要なターゲットが、どのように相互作用して、以下のDNA損傷チェックポイントを調節するかについて説明します。
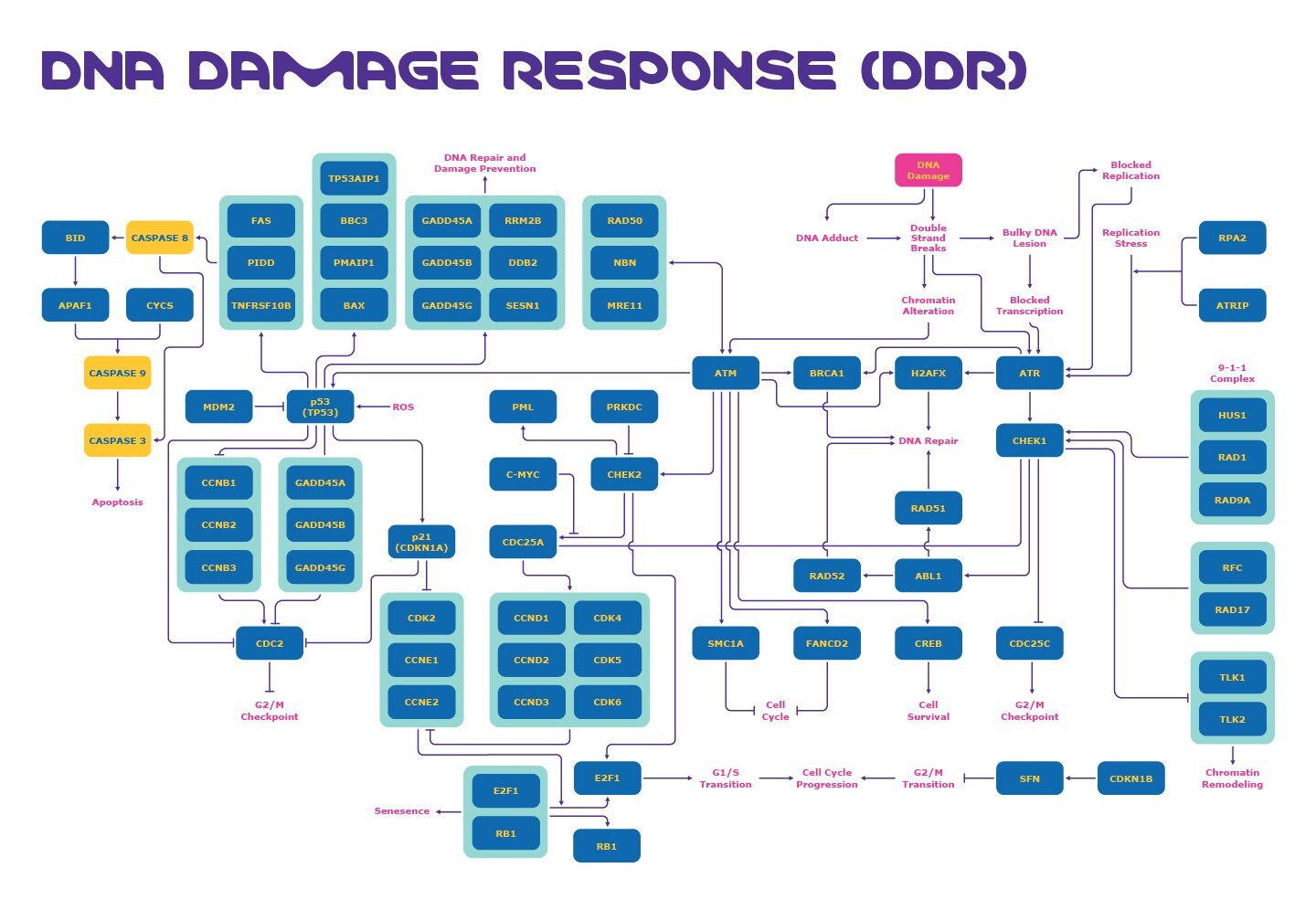
DNA損傷応答経路とは?
DNA損傷応答(DDR)経路は、細胞がDNA損傷を検出すると、DNAを修復するために開始されます。DNA損傷には、内因性DNA損傷や外因性DNA損傷など、さまざまな種類があります。それぞれの例を以下に示します。1
- 内因性: 複製エラー、塩基の脱アミノ化、活性酸素種による酸化的損傷など
- 外因性: イオン化放射、紫外線放射、化学物質/毒素、環境ストレスなど
DNA損傷の影響には、変異、アポトーシスなどがあります。この損傷は、細胞機能の調節不全を招くことがあり、最終的にはがん、神経疾患、および早期老化を引き起こすおそれがあります。2
DNA損傷チェックポイントの主要なターゲット
DNA損傷に応答して活性化される可能性がある細胞周期チェックポイントがあります。これらのDNA損傷チェックポイントには以下が含まれます。
- G1チェックポイント(G1期とS期の間)
- S期内チェックポイント(S期中)
- G2チェックポイント(G2期とM期の間)
DDR経路のこれらのチェックポイントに関連する主要なタンパク質は、このプロセスの理解を深めて、潜在的な治療法を見いだすためのターゲットとして使用できます。DNA損傷チェックポイントのこれらの主要なターゲットには以下が含まれます。
- MDM2(マウス二重微小染色体2)
- p53(腫瘍タンパクp53)
- ATM(毛細血管拡張性運動失調症変異型)
- ATR(毛細血管拡張性運動失調症およびRad3関連)
- p21(サイクリン依存性キナーゼ阻害剤)
- CDK2/サイクリンE(サイクリン依存性キナーゼ2)
DDRターゲットは、G1/S、S、およびG2/Mチェックポイントに関与するメカニズムにおいて重要な役割を果たします。3 特に、ATM、ATR、およびp53の役割は、DNA損傷応答の研究でよく知られています。
ATMおよびATR
ATMは、DNA損傷応答の種々の側面において重要です(図1)。ATMキナーゼは、クロマチンの構造変化を引き起こすDNA二重鎖切断によって活性化され、チェックポイントキナーゼ2(CHEK2)の活性化を介してG1チェックポイントをトリガーします。さらに、CHEK2は、CDK2/サイクリンEを阻害するのを防ぐCDC25Aを阻害して、最終的に細胞のS期への移行を阻止します。3
ATRキナーゼは、DNA二重鎖切断および転写のブロックによって活性化され、S期内チェックポイントを活性化します。ATRは、CDC25Aの分解を誘導するチェックポイントキナーゼ1(CHEK1)を活性化して、細胞がS期を継続するのを中断させます。3 ATRキナーゼとCHEK1もG2チェックポイントを活性化します。CHEK1は、細胞がM期へ移行するのを防ぐCDC25Cを阻害します。3
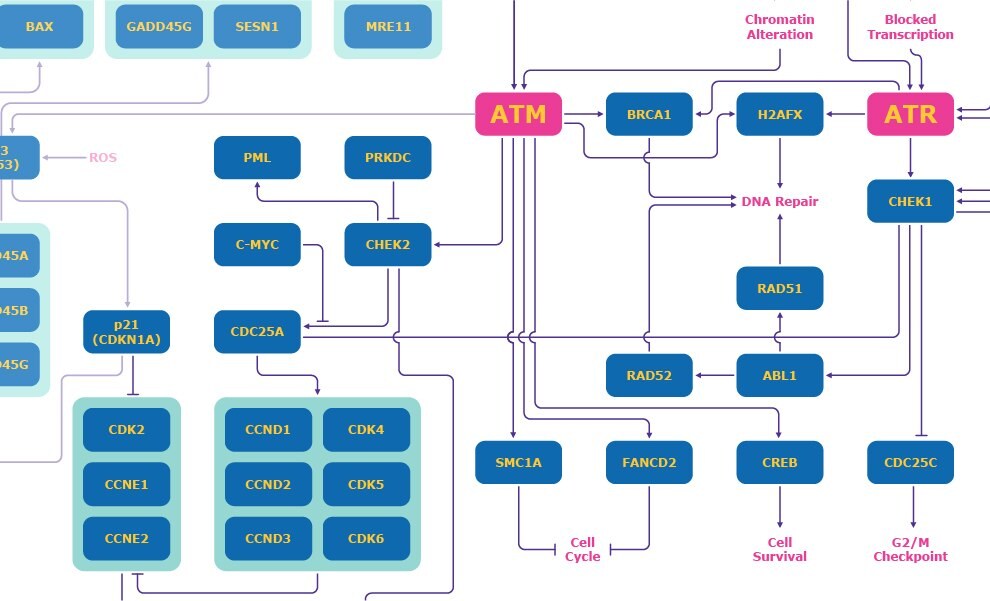
図1.ATMおよびATRメカニズムを中心としたDNA損傷応答経路
p53
G1チェックポイントはp53にも依存します。腫瘍抑制タンパク質のp53は、「ゲノムの守護神」としても知られ、ユビキチンリガーゼのMDM2との負のフィードバックループ相互作用のため通常は低レベルで見られます。4 ATMは、DNA損傷に応答してp53のリン酸化を誘導し、MDM2の影響を抑えてp53を活性化することができます。活性酸素種(ROS)もp53を活性化します。これにより、CDK2/サイクリンEを阻害するp21が誘導されて、S期への移行が防止されます(図2)。5
また、活性化されたp53は、細胞周期停止とアポトーシスに影響を及ぼす産物を含有するGADD45複合体を上方制御して、S期への進行を防ぎます。さらに、p53はDNA修復を開始できます。6 また、GADD45複合体は、G2/M期の停止を引き起こすCDC2を阻害して、G2チェックポイントでの有糸分裂へのエントリーを防止できます。4
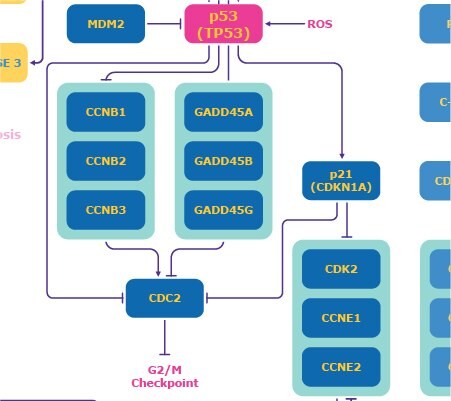
図2.p53を中心としたDNA損傷応答経路
このページに記載されている経路と情報は、教育のみを目的としています。研究を行う前に必ず文献を参照してください。
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?