抗体の再現性、特異性、性能を保証するための追加バリデーションデータ
私たちの高度な抗体バリデーションへの取り組み
高度な抗体バリデーションとは、抗体のターゲット抗原に対する特異性が、以前に定義した発現データと一致することを研究者にさらに保証するためのアッセイまたは方法です。懸念を有する多くの研究者は、市販の抗体が目的とするターゲットに特異的に結合することを示すより確実なエビデンスを求めています。免疫検出アプリケーションに基づく抗体バリデーションによるより厳密な裏付けを求めるご要望に応えるために、私たちは多くの抗体について、高度なバリデーションを実施しています。現在、製品ページに表示されている高度なバリデーション(Enhanced validation:EV)のデータは、カタログで『EV』記号がついた抗体について入手できます。私たちが提供する『EV』記号がついた抗体にはすべて、このような1つまたは複数の高度なバリデーション戦略によって得られたデータを添付しています。
市販の抗体バリデーションの現状
市販の抗体メーカーは、免疫後のスクリーニング時に、ウェスタンブロッティング(WB)または免疫組織染色(IHC)のみで目的とする抗体の結合を評価するのが一般的です。このようなスクリーニングを適用できる場合には、初期段階において、開発中の抗体が期待されるターゲットを認識し、それ以前のロットと同様の性能を示すことが保証されます。しかし、このような単純なスクリーニングではアプリケーションの適合性およびロット間の真の一貫性を保証するには不十分です。
したがって、私たちは以降も、製品の使用目的に応じて選択したサンプルを使用して、できるだけ多くの追加免疫検出アプリケーションで試験を行っています。これらには、免疫組織染色、免疫細胞染色(ICC)、ウェスタンブロッティング、ELISA、免疫沈降などがあります。このような徹底したアプリケーションの試験は、ターゲットに対する抗体の特異性評価に有益であり、お客様が使用する可能性が高いアプリケーションとサンプルを用いて実際の状況において妥当性のあるバリデーションを行うことができます。研究者は、このようなアプリケーションに特異的なデータを検討し、研究者の意図する使用目的に合わせて適切に評価する必要があります。抗体メーカーによるアプリケーションデータの検討に加えて、エピトープ、動物種の反応性、クローン性、適切な宿主動物種、および適切なコントロールの開発について厳しく検討することは、抗体製品を選択して使用する上で、研究者の重要な責任です。
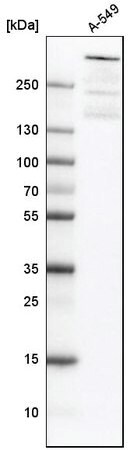
ヒト細胞株A-549に対する抗ATRX抗体を用いたウェスタンブロッティング。製品番号 HPA001906

ヒト扁桃組織に対する抗desmoglein抗体による免疫組織染色の高度な抗体バリデーション。 重層扁平上皮(A)ならびにヒト扁桃陰窩を覆う上皮細胞(C)において、膜結合部に免疫反応性が認められました。同一の組織をネガティブコントロール試薬で処理したところ(B、C)、検出可能なシグナルは認められませんでした。
製品番号 MABT118
リコンビナント発現抗体
リコンビナントモノクローナル抗体による高度なバリデーション
抗体メーカーによって関連するアプリケーションにおける抗体の結合に関して特性評価が提供された後に、研究者が適切な選択と最適化を行うことは、抗体の性能とその使用で得られる科学的結論を確実なものにするために重要です。抗体をバリデートするために、ターゲットタンパク質に対する特異性、再現性、高い親和性を有することを示す必要があります。
リコンビナント抗体の特異性
非特異的な抗体は、抗体設計上で検出対象としたタンパク質に加えて他のタンパク質も認識することがあり、複数のターゲットに結合することがよくあります。私たちのリコンビナント抗体は、全く新しい世代のモノクローナル抗体です。リコンビナント発現系を使用して製造する私たちのリコンビナント抗体は、その抗体をコードするDNA配列レベルまで定義されており、遺伝子工学で「組み換えた」細胞で製造し、最高の特異性が得られるように精製されています。
リコンビナント抗体の再現性および高い親和性
動物を用いて従来の方法で産生される抗体にはロット間でばらつきがみられる可能性があるため、ライフサイエンス分野では現在、再現性が課題となっています。生物を使用して産生される抗体の課題には、発現の喪失、宿主における重鎖と軽鎖の発現の変化、変異、頻繁な試験などがあり、再クローニングまでもが課題になっています。リコンビナント抗体は、その抗体を産生するDNA配列で定義されているため、ロット間において強固かつ極めて再現可能な一貫性を得ることができ、動物による製造によってもたらされる変動の多くを回避できます。従って、リコンビナント抗体は、同じ最適な性能で常に提供でき、動物による産生で頻繁に起こる供給の問題やクローンのわずかな変化(ドリフト)に悩まされることはありません。ターゲットタンパク質に結合する抗体は、異なるエピトープ(線状または配座)や同じターゲットの異なるアイソタイプを認識する可能性があります。私たちのリコンビナント抗体は、抗体の使用がバリデートされている各アッセイにおいて、強固で親和性の高い抗体性能を発揮します。

リコンビナント抗体は、従来のポリクローナルおよびモノクローナル抗体と同様の性能を持ちながら、組換え技術と発現法によって特異性と再現性が向上しています。(A)希釈倍率1:100の製品番号ZRB04338、Anti-EGFR、clone 11E19 ZooMAb® Rabbit Monoclonal で染色後、Alexa Fluor® 488(緑色)標識済みヤギ抗ウサギ二次抗体を用いて視覚化したNIH/3T3細胞株の免疫蛍光染色。アクチンフィラメントをファロイジン(赤色)で標識。核はDAPI(青)で染色。この抗体は、細胞膜、細胞質を染色して陽性反応を示します。
遺伝学的戦略
遺伝学的戦略-ノックアウト/ノックダウン法による抗体特異性の確認
期待される結果:ノックダウン/ノックアウトバリデーションにおけるウェスタンブロッティングのバンドの減弱または消失
私たちの遺伝学的バリデーションでは、遺伝子編集法または遺伝子干渉法によりターゲットタンパク質の発現量を消失または減少させて、そのようなサンプルでの抗体認識を野生型と比較することによって、タンパク質検出の特異性の確認を試みます。続いて、ターゲットタンパク質発現量を減少または消失させるために変更を加えた細胞サンプルにWBまたはICC染色を行って、抗体の特異性を評価することができます。次に、変化したタンパク質の発現量を、ターゲットタンパク質を発現することが確認されている野生型サンプルと比較します。
CRISPR/Cas9遺伝子編集法によって、特定の1遺伝子または複数遺伝子を永久的に削除して、対応するタンパク質の発現を「ノックアウト」させた細胞株を作製することが可能です。抗体バリデーションでは、この方法は強力なツールとなりえます。簡単に言うと、ターゲットが「ノックアウト」されたサンプルでは、対象のターゲットが遺伝子上で削除されているため、抗体染色はみられませんが、対する野生型サンプルではターゲットの認識が認められるはずです。これらの2種類のサンプルを比較することによって、非特異性の程度を評価することができます。
また、RNA干渉(RNAi)法を使用して、特異的遺伝子を「ノックダウン」すなわち抑制して、タンパク質の発現量を減少させることもできます。ノックアウト法と同様に、遺伝子を変更した「ノックダウン」サンプルを野生型と比較することができます。遺伝子ノックアウトとは対照的に、RNAiによるサンプルで認められる抗体反応性のシグナル強度は、野生型と比較して減少すると考えられますが、多くの場合、完全には消失しません。

RNAiノックダウンによる遺伝学的バリデーションの例。コントロールsiRNAおよび2種類のターゲット特異的siRNAプローブを導入したA-549細胞に対する抗ATRX抗体を用いたウェスタンブロッティング。siRNAサンプルにおけるATRXの減少によって抗体の特異性が確認できる。
複数の抗体によるベリフィケーション
複数の抗体によるベリフィケーション – IHCまたはICCにおいてターゲットに対して複数の抗体を使用することによる抗体特異性の確認
期待される結果:すべての抗体は、同様の染色パターンまたは同様の実験結果を示すはずである
ある抗体を用いた特定の免疫アプリケーションで得られる結果の信頼性は、同じターゲットに別の抗体を用いてまったく同じプロトコルで同じ結果が得られれば、裏付けることができます。同じ組織由来の切片のような1群のサンプルに対して、重複のないエピトープを有する2つ以上の抗体を適用します。この方法は、結合特性の比較に使用する両抗体をいずれもバリデートできるという付加的な利点もあります。

Anti-A2ML1 抗体 HPA038847 (A)を用いたヒト食道、肝臓、皮膚、扁桃の免疫組織染色では、同ターゲットの別抗体 HPA038848 (B)と同様に、組織内においてターゲットタンパク質の分布が確認された。
RNAシーケンスを用いた直交的バリデーション
RNAシーケンス(RNA-Seq)を用いた直交的バリデーション-抗体非依存的手法(RNA-Seq)と抗体依存的手法を相関させた特異性の確認
期待される結果:抗体染色の強度は、同じサンプルのRNAシーケンスデータと相関を示すはずである
抗体バリデーション過程における直交的バリデーションとは、免疫検出法による結果を、対象とする遺伝子またはタンパク質を測定する抗体非依存的な測定法と比較することを指します。
直交的方法であるRNAシーケンスは、特異的なターゲットについてmRNA量で特定サンプルの遺伝子発現量を測定する方法です。このmRNA量での発現量は、タンパク質発現量に対応するはずです。この高度な抗体バリデーション法では、RNAシーケンスで得られた特定ターゲットのmRNA発現量を高発現組織と低発現組織(5倍の差)について棒グラフで示すとともに、この同じサンプルについてのWBまたはIHCデータもならべて提示します。次のようなmRNA発現量とサンプル染色の直接的な比較を示します:高い発現量=強力な染色、低い発現量=弱い染色または染色なし。
RNAシーケンスを用いた直交的バリデーション


ウェスタンブロッティング(左)とIHC(右)による直交的バリデーション。RNA発現量が高いおよび低いことが明らかになっているサンプルを選択した。左:ヒト細胞株U-251MG(VIM発現量が高い)とMCF-7(VIM発現量が低い)に対する抗VIM抗体を用いたウェスタンブロッティング(左)をRNAシーケンスデータ(右)と相関させて示す。
右:ヒト腎臓(左、PLA2R1発現量が高い)と膵臓(右、PLA2R1発現量が低い)に対する抗PLA2R1抗体を用いた免疫組織染色画像をRNAシーケンスデータと相関させて示す。
機能アッセイによるバリデーション
機能アッセイによるバリデーション ― ターゲット抗原の発現あるいは活性レベルを実験的に変化させ、その免疫検出を通した抗体特異性の確認
期待される結果:WB、ICC、IF、およびFSによる変化させた抗原の活性または発現レベルの免疫検出
多くの抗原の発現および活性レベルは、in vitroにおいて実験操作によって判別できるように変化させることができます。タンパク質の発現または生理活性を変化させる一般的な方法を利用して、ターゲットタンパク質の活性または発現レベルの変化を測定し、抗体の特異性を判定することができます。機能アッセイによるバリデーションは、抗体の特異性のエビデンスを強力に裏付けることができるため、EVの重要な評価法です。

免疫蛍光染色
HeLa細胞をEBSS培地で2時間培養したところ、実験的誘導を行ったHeLa細胞ではオートファゴソーム染色が認められ(A)、未処理の細胞ではオートファゴソーム染色は認められません(B)。細胞は、氷冷メタノール、その後氷冷アセトンを用いて固定および透過処理を行って、オートファゴソーム膜のマーカーであるウサギ抗LC3B抗体(製品番号 L7543)5 μg/mLで染色しました。この抗体にCy3標識済みヤギ抗ウサギIgGを用いて視覚化しました。
ライフサイエンス研究のためにバリデートされた抗体に対する私たちのゆるぎないコミットメント
私たちは、一次抗体製品を提供するリーディングカンパニーです。その抗体製品は、抗体を使用したピアレビュー(査読付き論文)の膨大な数の引用を通じて、日々検証されています。また、業界をリードする品質管理工程およびアプリケーションテストを実施しており、最初から常に期待される性能を発揮する抗体であることを保証します。私たちは、バリデーションに対する長年のコミットメントに加えて、より厳密なバリデーション戦略を多くの抗体製品の開発に組み入れることによってバリデーションプロセスの拡大と改善を継続していきます。Antibody Guaranteeによって製品の品質を約束しますが、もし抗体がデータシートに記載のアプリケーションでワークしなかった場合は、別ロットもしくは別の抗体製品と交換または返金の対応をいたします。
発現/過剰発現によるバリデーション
発現/過剰発現によるバリデーション -ターゲットタンパク質の過剰発現による抗体特異性の確認
期待される結果:WBおよびIFによる過剰発現されたタンパク質の免疫検出
発現/過剰発現によるバリデーションでは、できればターゲット抗原タンパク質をまだ発現していない細胞株を使用し、ターゲット抗原を過剰発現させる遺伝子導入を利用して、抗体の特異性を確認します。過剰発現されたタンパク質の状態を、ターゲットタンパク質の発現がないことが確認されている野生型のコントロールサンプルと比較します。続いて、ターゲットタンパク質を過剰発現するように変化させた細胞サンプルに対してWBまたはIF染色を行って、抗体の特異性を評価します。

ターゲットタンパク質の過剰発現による高度なバリデーション
抗体の認識(ウサギで産生された抗ACY3抗体)は、ウェスタンブロッティングにより、ターゲットタンパク質を過剰発現するように変更を加えた細胞サンブルで確認されるが、野生型サンプル(コントロール)では染色が認められない。
参考文献
研究目的での使用に限定されます。診断の用途では使用できません。
製品仕様に特に記載のない限り、抗体製品はすべて研究用途のみで販売しており、それ以外の目的(商用利用、診断用途、治療用途など、ただしこれらに限定されない)では使用できません。私たちのバリデーションプロセスは研究用途にのみ該当し、抗体がここに記載したような未承認の用途に使用可能であることを確認または保証するものではありません。
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?