抗体とは:抗体-抗原相互作用
抗原や抗体について理解したところで、抗原と抗体の相互作用について考えてみましょう。抗体と、抗原の1つの抗原部位との相互作用の強度は、抗原に対する抗体の親和性として表すことができます。各抗原部位では、抗体の「アーム」の可変領域が、弱い非共有結合的な力によって、抗原の多数の部位と相互作用します。相互作用が大きいほど、親和性も高くなります。抗原抗体複合体の全体的な安定性または強度に関しては、親和性のほうが、情報価値が高いかもしれません。親和性は、エピトープに対する抗体の親和性、抗原と抗体の両方の結合価、および相互作用する部位の立体配置という主に3つの要因によって制御されています。究極的には、これらの要因が、抗体の特異性、すなわち特定の抗体が的確な抗原のエピトープに結合する可能性を定めているのです。
交差反応性とは、抗体または抗体の集団が、その他の抗原のエピトープに結合することを指します。これは、抗体の親和性または特異性が低いことによって、または複数の異なる抗原が同一のまたは非常に類似したエピトープを有しているために起こります。関連するグループの抗原に対する全般的な結合が求められる場合、または進化において抗原のエピトープのタンパク質配列が高度に保存されていない場合に種間標識を試みる場合には、交差反応性が望ましいこともあります。交差反応性によって、抗原濃度が過剰または過少評価される場合があり、これはイムノアッセイでは問題となります。免疫化学技術は、混入分子が高レベルで存在する場合においても、各イムノグロブリンがそれぞれの抗原に対して分子レベルで示す極度の特異性の上に成り立っています。ほとんどの抗原や抗体は複数の相互作用部位を有しているため、相互作用して沈殿物を形成することができます。抗体を使用する実験の例には、ウェスタンブロッティング、免疫組織染色および免疫細胞染色、酵素結合免疫吸着検査法(ELISA)、免疫沈降法、フローサイトメトリーがあります。それぞれについては、本ガイドの後述の章において詳細に説明します。
抗体-抗原相互作用の動態学
抗原-抗体結合の性質
抗原-抗体反応に影響を及ぼす要因
抗体-抗原相互作用の動態学
抗原と抗体の特異的な結合は、水素結合、疎水性相互作用、静電力、ファン・デル・ワールス力によるものです。これらの力は弱く、非共有結合的ですが、抗原と抗体の結合は非常に強力である場合もあります。抗体と同様に、抗原も、同一のエピトープのコピーが複数ある場合や、複数の抗体によって認識される複数のエピトープがある場合など、相互作用する部位を複数有していることがあります。複数の相互作用部位が関与する結合では、より安定した複合体が形成されますが、立体構造上の問題が生じ、結合の可能性が低下することもあります。すべての抗原抗体結合は可逆的で、あらゆる可逆的二分子間相互作用の基本的な熱力学的原理に従います。
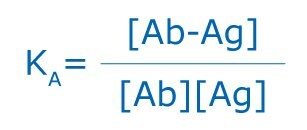
ここで、KAは親和定数、[Ab-Ag]は抗原抗体複合体のモル濃度、[Ab]および[Ag]はそれぞれ抗体(Ab)または抗原(Ag)の占有されていない結合部位のモル濃度です。
平衡状態に至るまでに要する時間は、拡散率や、抗体の抗原に対する親和性に依存しており、大きく異なる場合があります。抗体-抗原結合の親和定数も広範囲にわたる場合があり、105/モル未満から1012/モル超に及びます。親和定数は、温度、pH、溶媒の影響を受けます。モノクローナル抗体については親和定数を求めることができますが、ポリクローナル抗体と抗原の間には複数の結合が形成されるため、ポリクローナル抗体の親和定数を求めることはできません。抗体の抗原に対する親和性の定量測定は、平衡透析によって実施することができます。抗体濃度を一定とし、リガンドの濃度を変えながら平衡透析を繰り返すことにより、Scatchardプロットを作成します。このプロットから、親和性や潜在的な交差反応性に関する情報が得られます。
モノクローナル抗体とポリクローナル抗体の差異は、それぞれの使用の長所や短所の基盤を成しているため、実験手順を設計する場合には、モノクローナル抗体とポリクローナル抗体を区別することが重要です。
抗原-抗体結合の性質
抗体の結合部位は、抗体分子のF(ab)部分に位置しており、重鎖と軽鎖の超可変領域によって構築されています。この部位と抗原の結合の特徴や工程は以下のとおりです:
- 抗原を抗体の結合部位に保持する接合は非共有結合性であるため、本質的に可逆的です。
- これらの結合は、水素結合、静電結合、またはファン・デル・ワールス力によるものです。
- 通常は複数の結合の形成が認められ、抗体と抗原の間に比較的緊密な結合が生じています。
- 細胞の抗原決定基(エピトープとして知られています)と、抗体の抗原結合部位(パラトープ)の間の特異的結合に関与する部位は、これらの分子の非常に小さな部位で、通常はほんの少数のアミノ酸からなっています。
- 特異的結合のためには2分子間の反発を克服しなければならないことから、これらの部位は抗原-抗体反応において重大な意味を有します。
- エピトープがパラトープと接触する際、まずはイオン力および疎水性力によって互いに引き寄せられます。
- これらの力が水和エネルギーを乗り越える助けとなり、エピトープとパラトープが互いに接近するにつれて水分子が排除されます。
- この誘引は、その後ファン・デル・ワールス力が加わることによってさらに強力になり、エピトープとパラトープをさらに接近させます。
抗原-抗体反応に影響を及ぼす要因
抗原抗体反応は、複数の要因の影響を受ける場合があります。一般的な要因は次のとおりです:
温度
抗原-抗体反応に最適な温度は、エピトープやパラトープの化学的性質や、これらの相互作用に関わる結合の種類によります。例として、水素結合の形成は発熱性である傾向にあります。これらの結合は温度が低いほど安定するため、炭水化物抗原を用いる場合には温度が重要となる場合があります。
pH
抗原抗体複合体の平衡定数に対するpHの影響は、pHが6.5から8.4の場合に生じます。pH 6.5未満およびpH 8.4超では、抗原-抗体反応が強力に阻害されます。pH 5.0または9.5での平衡定数は、pH 6.5~7.0における値よりも100倍小さい値となります。極端なpH条件下では、抗体の立体構造変化が起こり、抗原との相補性が損なわれる場合があります。
イオン強度
イオン強度による抗原-抗体反応への影響は、血液型血清学において特に重要であり、ナトリウムイオンや塩素イオンは、反応に著しい影響を及ぼします。例として、通常生理食塩水では、Na+とCl−が複合体の周囲に群がり、部分的に電荷を中和するので、抗体による抗原への結合に干渉する可能性があります。これは、低親和性の抗体を用いる場合には、問題となる可能性があります。γ-グロブリンは、極度の低イオン強度にばく露すると凝集し、赤血球のリポタンパク質と可逆性の複合体を形成し、沈降することがよく知られています。
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?