持続可能エネルギー技術における金属有機構造体の用途
Stephen R. Caskey1, Adam J. Matzger2
Material Matters 2009, Vol.4, No.4
はじめに
高表面積材料の分野は非常に成熟していると考えられています。しかし、代替エネルギー用途向け高表面積材料に関しては依然としてその改良が急務です。現在、ゼオライト、金属酸化物、および活性炭がこの市場を独占していますが、より高度な材料の開発がさまざまな用途で求められています1。近年、有望な解決策が、これまであまり想定しされていなかった分野からもたらされました。それは配位ポリマーです。数十年もの間、非常に詳しく研究されてきたにもかかわらず、多孔質配位ネットワークを広い範囲にわたって、しかも高い信頼度で構築できる金属配位子相互作用の一種が見つかったのはほんの約10年前であり、最も高表面積のゼオライトより高い表面積を持つ金属有機材料が見出されたことがきっかけで発見されました。金属有機構造体(MOF:metal-organic framework)という用語は、このような配位ポリマーを表すものとして広く使用されています。MOFのさらなる開発によって、最高表面積の活性炭を上回る記録的な表面積を持つ材料が得られています2-4。MOFの中には、1グラムの表面積がアメリカンフットボール競技場の面積(120 × 53.33ヤード = 6,400平方ヤード、約5,351 m2)に達するものもあります。
最もよく研究されている2つのMOF、すなわち「MOF-5」5とCu-BTCとも呼ばれる「HKUST-1」6(Hong Kong University of Science and Technology、香港科技大学)は1999年に初めて報告されました。MOF-5は、図1に示すように、有機リンカーとしてテレフタル酸ジアニオンを持つZn(II)クラスターで構成されています。表面への多層ガス吸着が可能な、MOF-5のBET(Brunauer-Emmett-Teller)表面積は約3,500 m2/gです。HKUST-1は、トリメシン酸トリアニオンでリンクされたpaddlewheel型Cu(II)ダイマーで構成されています(図1)。HKUST-1(Basolite™ C 300(製品番号:688614)として市販)の表面積は約1,900 m2/gです。最も高表面積である既知の材料の1つであるMOF-177(製品番号:794325)は、プロトタイプ的な高性能MOFです(図2)7。MOF-177中の金属クラスターはMOF-5のものと同じです。しかしMOF-5とは異なり、リンカーは直線状ではなく、H3BTBと呼ばれることもあるトリトピック(tritopic)カルボン酸の1,3,5-tris(4’-carboxyphenyl)benzene(製品番号:686859)から誘導されます。MOF-177は、MOF-5と同じ条件下(N,N-ジエチルホルムアミド、100℃)で合成され、そのBET表面積は4,750 m2/gに達します8。
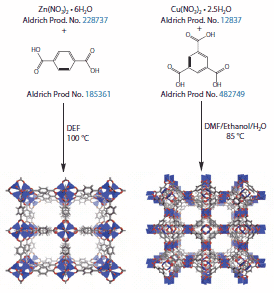
図1代表的なMOFの合成方法
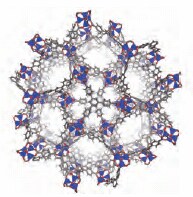
図2MOF-177の結晶構造図
MOFの化学
一般に、MOFは、塩基の存在下でソルボサーマル条件または水熱条件の下で合成されます。代表的な合成方法を図1に示します。多くのMOFは、純粋なN,N-ジエチルホルムアミド(DEF)またはN,N-ジメチルホルムアミド(DMF)溶媒中で調製されますが、これらは、高温で分解して緩やかにアミン塩基を生成し、これがリンカーの有機官能基を脱プロトン化して金属有機クラスターを生成します。この反応は、溶媒の漏れおよび/またはキャップの腐食を防止するためのテフロンライナー付きキャップで密封されたガラス製シンチレーションバイアル(約100 mg)またはガラス製広口びん(1~10 g)の中で行います。その後、反応溶液を50~250℃まで加熱することによって結晶性物質が形成されます。続いて結晶から溶媒を除去します。まず、結晶をさまざまな低沸点の非配位性または弱配位性溶媒(CHCl3、CH2Cl2、メタノール、エーテルなど)の中に浸漬して、材料の細孔からDEF、DMFおよび/または水を取り除きます。最後に、溶液から結晶をろ過し、高温真空下で乾燥させて細孔から溶媒を完全に除去します。いったん溶媒を除去すると、MOFは空気や湿気の影響を受けやすくなり、空気中で不可逆的に分解したり再水和したりする場合もあります。MOFの表面積を最大化するためには、新しい、未使用のDEFまたはDMF(これらは時間とともに、あるいは空気にさらされると劣化する傾向があります)を使用すること、反応混合物を加熱前にろ過および/または超音波処理すること、N2によって反応溶媒を脱気することのほか、当然ながら、上に述べたような活性化/溶媒除去を適切に行うことが推奨されます。これらの各手順によって、結晶欠陥が低減し材料の表面積を大きくすることができます。新規材料の特性分析に使用される最も重要な分析法には、ガス吸着による表面積分析、X線回折(XRD、粉末および/または単結晶)、微量元素分析(CHN)、IR、熱重量分析(TGA)などがあります。既知のMOFの場合、新たに合成した各バッチについて、XRDと表面積分析によって相純度を確認する必要があります。ただし、多くの場合、相互貫入(最初の構造体の細孔内に別の構造体が含まれている状態)の存在を検出することは困難です。このような余分の構造体によって細孔が塞がれてしまうため、材料の特性に大きな影響を及ぼすことがあります9。.
今日では、高性能MOF化合物の合成に必要な化合物や金属塩(硝酸塩)、および溶媒が市販されています。また、MOF-177(リンカー化合物の製品番号:686859)7、UMCM-150(714747)10、mesoMOF-1(719250)11、NOTT-101(716502)12、などのよく知られた構造体の合成に適したリンカー化合物も入手することが可能で、レファレンス材料として、あるいは新規MOFの開発に利用することができます(図3)。

図3市販されている高性能MOF用リンカー化合物の代表例
応用例
MOFの用途として最もよく研究されている分野は、自動車用のクリーンな代替エネルギーのためのガス貯蔵です。研究が進められている2つの主な候補は水素ガスとメタンガスです。水素は、間違いなくよりクリーンな(環境にやさしい)エネルギーですが、製造、安全な貯蔵、および大量輸送が難しいために、これまでその実用性は限られていました。つまり、水素はエネルギー出力が高い上に燃焼副生成物が水であるために環境への影響が小さいことから、魅力的ではあります。しかし、水素は分子量が小さく、水素分子間の引力が非常に弱いために、その輸送方法が非常に大きな問題です。所定の温度、圧力において一定の空間内に貯蔵できる水素の量は、表面への水素の物理吸着結合によって増加させることができるため、弱い引力でも水素分子をさらに充填できます。MOFは、最も高表面積の既知材料として、これらの要件を満たす最も大きな可能性を持っています。一方、MOFのさらなる可能性として分離および精製用途への応用があります。分離の難しい化合物の場合、多くは蒸留もしくはある1つの成分から除去の容易な別の成分への変換など、多量のエネルギーを要するプロセスが用いられます。これらのプロセスを単純化することで、エネルギー資源の大幅な節約に結びつく可能性があります。したがって、本稿では次に、エネルギー用途および燃焼排ガスからのCO2の分離の観点からMOFの利用について議論します。
水素貯蔵
初期の頃、室温にて高レベルの水素をMOFに貯蔵した報告は大きな関心を集めましたが、これら初期の研究成果についてはその再現が困難であったために、その後、極低温における貯蔵研究への移行が進みました。現在、極低温水素貯蔵はMOF-177を含むさまざまなMOFについて研究され13、77K(-196℃)約55 barで7.5重量%の水素が可逆的に吸蔵されることが報告されています。図4は、高圧水素貯蔵の点でMOF-177が他のMOFより優れていることを示しています8。この値は、水素貯蔵システムに関するDOEの最終目標である7.5%(2009年に改定)にはまだはるかに及びませんが14、それでも、物理吸着材料での最大の過剰水素吸蔵量(excess hydrogen uptake)25の1つです。高表面積MOFは一般に水素貯蔵容量が大きい傾向にありますが、UMCM-2の場合のように3、高表面積であれば常に大量の水素を吸蔵できるとは限りません。このMOFのBET表面積は、すでに報告されている全物質中最大の5,200 m2/gですが、6.9重量%という過剰水素質量吸蔵量はMOF-177に及びません。この結果は、MOFについてまだ完全には理解されていない細孔の体積、形状、および/またはその他の特徴と関係している可能性があります。このように、MOFの水素貯蔵容量を現状より合理的に向上させるには、まだ大きな課題と可能性が残されています。

図4さまざまなMOFの水素貯蔵量。塗りつぶした記号は吸着データを、白抜きの記号は脱離データを示します。米国化学会の許可を得て引用。
多くの研究が、高表面積である点と吸着脱離の可逆性を維持しながら水素に対するMOFの親和性を増大させることに焦点が当てられています。この場合、水素親和性の増大には必然的に水素吸着熱の上昇が伴うと考えられます。物理吸着材料における吸着熱を支配する要因はよく理解されていませんが、小さな細孔や、細孔の形状(円筒、長方形、その他)、および配位不飽和な金属中心が要因として挙げられ、それぞれが強固な水素結合を促進する可能性があると推測されます。最近まで、biphenyl-3,5,3’,5’-tetracarboxylic acidから合成されるCu系MOFであるMOF-505が、77K、1気圧で最大の容量を持つ低圧水素吸蔵材料(2.6重量%)として報告されており、高い水素吸着熱と強い水素親和性を示します15。もう1つのCu系材料であるUMCM-150の水素吸着熱は、この材料より低い7.3 kJ/molです。しかし、MOF-505を大幅に超える高表面積を持つため、77K、1barで2.1重量%という非常に高い過剰質量水素吸蔵量を示します10。MOF-74とそのCo、Ni、およびMg系類似化合物16は、すべて2,5-dihydroxyterephthalic acid(製品番号:382132)を使用して合成され、配位不飽和な金属中心を持つ小さな円筒状の細孔を備えています。これらの物質はまた、77K、1気圧で高い水素吸着熱を持つことも知られていますが17,18、一般に表面積が比較的低いため、その特性は制限されます8。Huppらは、1,2,4,5-tetrakis(4’-carboxyphenyl)benzene(製品番号:715298)と3-di(4-pyridyl)-2,3-butanediolを柱とするZn系MOFを、リチウムまたはマグネシウムイオンによって改質することで親和性と水素吸蔵量を増加させました。しかし残念ながら、これらの材料の表面積は約800 m2/gという低い値しか示しませんでした19。なお注意しなければならないのは、低圧力領域における水素親和性を高めることは、最終的にはあまり効果が得られないかもしれないという点です。つまり、貯蔵システムの動作圧力が1気圧未満になる可能性は低いため、基本的にこの圧力未満で吸蔵したガスは実際には供給(利用)できないガスになります。
メタン貯蔵
圧縮天然ガス(CNG:compressed natural gas)自動車は、今日その利用がすでに始まっています。CNG車の燃料タンクのガス(メタン)圧力は、3,600 psi(248 bar、2.48 × 107 Pa)に達します。同じ経済的エネルギー出力をもち、より貯蔵と輸送の安全性を改善するために、DOEはメタン貯蔵について35bar 以下で180 v(STP) / v(v(STP):メタンの標準温度および圧力における体積、v:吸着材の体積)という目標を設定しています20。IRMOF(isoreticular MOF)シリーズ21の多くのMOF、すなわち同じ金属クラスターを持ち、直線状の有機リンカーの種類が異なるZn系MOFが、メタン貯蔵用として評価されました。その結果、36気圧でIRMOF-6(155 cm3 (STP)/cm3)は、MOF-5(135 cm3 (STP)/cm3)とIRMOF-3(120 cm3 (STP)/cm3)を上回り、このシリーズで最高の値を示しました。IRMOFシリーズに最大30 barまでの圧力で吸着したメタンのラマンスペクトルを調べた結果、有機リンカーの違いだけが、メタンの吸着親和性に大きな影響を及ぼすことが明らかになっています22。最近、Zhouは、アントラセン誘導体リンカーを持つCu-MOF、PCN-14が高いメタン吸蔵量を持つことを報告しています(メタンの絶対吸着容量は、35 bar、290Kで230 v/vと推定されています)20。この成果は素晴らしいものではありますが、一方でこの物質がDOEの目標を超えた理由の1つが結晶密度とかさ密度の違いによるものではないかとの報告がされています23。
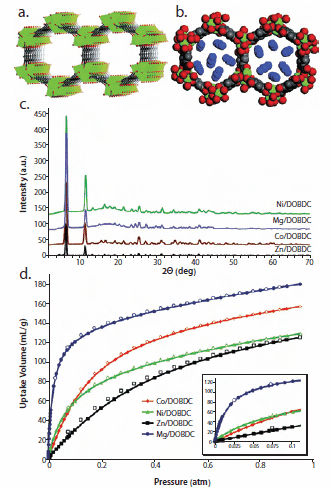
図5a)MOF-74類似化合物の構造、b)CO2分子を含んだMOF-74類似化合物の構造、c)MOF-74類似化合物の粉末XRDパターン、d)MOF-74(CoII、NiII、MgII、およびZnII)類似化合物の低圧における二酸化炭素吸着量。米国化学会の許可を得て引用。
二酸化炭素の吸蔵
代替エネルギーに対する世界的な注目の高まりにもかかわらず、二酸化炭素の排出問題はますます深刻化しています。たとえば、メタンガスを1次燃料源として組み込んでも、その燃焼副産物としてCO2が依然として排出されます。現在、CO2の単一排出源として最大のものは発電所であり、1気圧で約15%のCO2濃度の燃焼排ガス(燃焼煙の排出)が発生しています。CO2の貯蔵はあまり難しい課題ではありませんが、燃焼排ガス流からのCO2分離は深刻な問題であり、何らかの地質学的隔離技術が効果的に実施される前に、高CO2親和性材料の開発によって対処しなければなりません。最近我々は、Zn系材料であるMOF-74とそのCo、Ni、およびMg系類似化合物を低圧におけるCO2吸蔵に使用した場合、MOF-74のMg系類似化合物(Mg/DOBDC)が、1気圧、室温で約35重量%のCO2を吸蔵することを明らかにしました16(図5)。この値は、同じ条件下でゼオライト13X(モレキュラーシーブ13X)を含む他のどの物理吸着材料よりも著しく高い値です。我々の報告の後、Blom、Dietzel、およびその共同研究者がこの結果を確認し、CO2分子がMOF-74のNi系類似化合物の金属中心に結合していることを示すX線結晶構造データを報告しました24。燃焼排ガス中に他の成分が存在するような場合にもこのような吸蔵反応を達成できる技術の開発が、アミンによる化学吸着に基づいた既存の吸蔵技術の置き換えを考える上で最終的に必要となります。
まとめ
配位ポリマーの一種である金属有機構造体は、多くの代替エネルギー用途で利用される非常に有用な新規化合物です。MOFは簡単な合成方法を用いて容易に調製可能であり、目的に合わせた高表面積材料を手に入れることができます。また、現在のMOF技術を基に、水素とメタンについてそれぞれ極低温および室温貯蔵の基準が設定されています。さらに、MOFを使用した化合物分離という新たな技術の可能性によって、クリーンな代替エネルギーを供給できる見通しが開けます。
References
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?