T8003
Tripsina
Type I, ~10,000 BAEE units/mg protein
About This Item
Prodotti consigliati
Tipo
Type I
Forma fisica
solid
Attività specifica
~10,000 BAEE units/mg protein
PM
23.8 kDa
Composizione
protein, 90-100%
Solubilità
hydrochloric acid: soluble 1 mM, clear
Attività estranea
Chymotrypsin ≤4 BTEE units/mg protein
Condizioni di spedizione
wet ice
Temperatura di conservazione
−20°C
Cerchi prodotti simili? Visita Guida al confronto tra prodotti
Categorie correlate
Applicazioni
Azioni biochim/fisiol
Gli inibitori delle serin proteasi, tra cui ad esempio DFP, TLCK, APMSF, AEBSEF e aprotinina, inibiscono la tripsina.
Componenti
Avvertenza
Definizione di unità
Nota sulla preparazione
Inibitore
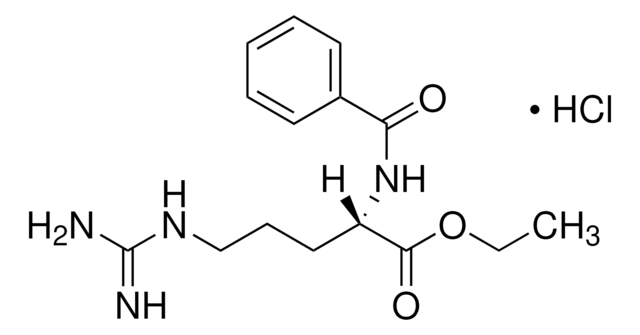
Substrato
Avvertenze
Danger
Indicazioni di pericolo
Consigli di prudenza
Classi di pericolo
Eye Irrit. 2 - Resp. Sens. 1 - Skin Irrit. 2 - STOT SE 3
Organi bersaglio
Respiratory system
Codice della classe di stoccaggio
11 - Combustible Solids
Classe di pericolosità dell'acqua (WGK)
WGK 1
Dispositivi di protezione individuale
dust mask type N95 (US), Eyeshields, Faceshields, Gloves
Certificati d'analisi (COA)
Cerca il Certificati d'analisi (COA) digitando il numero di lotto/batch corrispondente. I numeri di lotto o di batch sono stampati sull'etichetta dei prodotti dopo la parola ‘Lotto’ o ‘Batch’.
Possiedi già questo prodotto?
I documenti relativi ai prodotti acquistati recentemente sono disponibili nell’Archivio dei documenti.
I clienti hanno visto anche
Protocolli
Enzymatic Assay of Trypsin Inhibitor
This procedure is for products with a specification for Trypsin activity using Na-Benzoyl-L-arginine ethyl ester (BAEE) as a substrate. The procedure is a continuous spectrophotometric rate determination (A253, Light path = 1 cm).
Il team dei nostri ricercatori vanta grande esperienza in tutte le aree della ricerca quali Life Science, scienza dei materiali, sintesi chimica, cromatografia, discipline analitiche, ecc..
Contatta l'Assistenza Tecnica.