Pré-clínica

Testes pré-clínicos determinam que o composto-alvo é seguro e eficaz antes que possa ser testado em seres humanos, no preparo para protocolização de um pedido de novo medicamento experimental (IND). As considerações durante a etapa pré-clínica incluem:
- Propriedades detalhadas dos materiais
- Testes de segurança in vitro detalhados
- Expansão dos testes de segurança in vivo
- Desenvolvimento de processos
Recursos de biotecnologia
FDA Investigational New Drug (IND) Application
Aplicativo Drug Discovery and Development
Bioprocessamento a montante
Fórum: Emerging BioTalk
Gene Therapy and Viral Vaccine Contract Manufacturing
Folheto: ADC Express™
Biopharmaceutical Application Guide
Brochura: Integrated Bioprocess Solutions
Os serviços de testes toxicológicos são essenciais. Um amplo espectro de testes toxicológicos in vitro e in vivo é necessário e deve ser elaborado conforme as diretrizes internacionais, sendo os testes realizados em total conformidade com os regulamentos de boas práticas laboratoriais (BPL).
Considerações sobre o desenvolvimento de processos
- Desenvolvimento de linhagens celulares
- Seleção de clones
- Triagem de meios e alimento
- Desenvolvimento de processos a montante (upstream)
- Estabelecimento de banco de células mestre
- Desenvolvimento de processos a jusante (downstream)
- Desenvolvimento de formulações
- Desenvolvimento e otimização de métodos analíticos
- Apoio ao desenvolvimento de processos analíticos
- Programas analíticos de comparabilidade de biossimilares
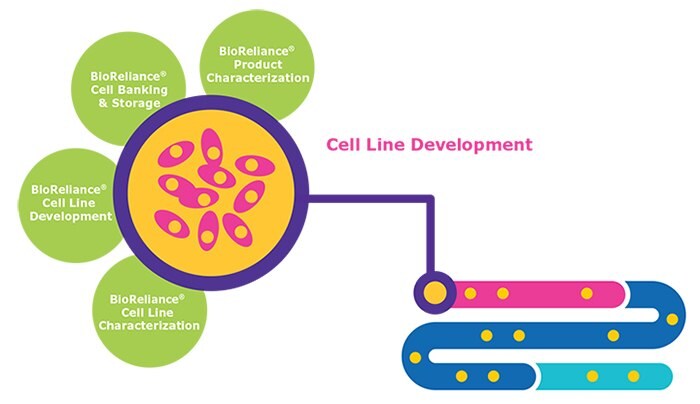
Considerações sobre o desenvolvimento de linhagens celulares
- Escolha de clones – é essencial encontrar linhagens que podem produzir o medicamento biológico com título e qualidade suficientemente altos
- Estudos de robustez – melhor prática para realização de estudos que replicam as condições de escalonamento
- Estabilidade genética – a produção e a qualidade das proteínas devem permanecer estáveis após > 60 gerações de células
Considerações sobre o desenvolvimento de processos
- Eficiência do processo – eliminação de etapas supérfluas, além de otimização de áreas multifuncionais e utilização da capacidade total
- Viabilidade de processos – devem poder ser reproduzidos com fidelidade por meio de escalonamento e transferência de tecnologia a outra operação
- Viabilidade financeira – equilíbrio entre produtividade e custos para viabilidade financeira de modo geral

Considerações sobre tecnologia
- Flexibilidade pode reduzir o custo de mercadorias – equipamentos de uso único podem melhorar a flexibilidade, o desenvolvimento de moldes e a rápida configuração de conjuntos, além de reduzir os custos de limpeza
- Escalabilidade é essencial – na escolha de tecnologias nos estágios mais iniciais, como escalonamento de um biorreator usado para cultura celular de mamíferos de 3 l para 200 l para 2000 l
- Avaliação da facilidade de uso – as soluções incluem caminhos de fluxo de processos estéreis pré-montados; conectores que permitem conexão, desconexão e reconexão assépticas
Considerações regulatórias
- Segurança de pacientes – como prioridade, os marcos do desenvolvimento clínico devem avaliar a segurança e a eficácia de produtos
- Qualidade do produto e robustez do processo – o desenvolvimento de processos deve ser acompanhado de coleta e análise dos dados
- Diálogo com autoridades regulatórias – saber em quais países ocorrerá a protocolização deve determinar quem inspecionará a instalação de fabricação
Considerações comerciais
- Velocidade até a fase clínica – estão sendo feitos investimentos altos em pequisa e desenvolvimento sem retornos
- Eficiência do processo – deve considerar proativamente o escalonamento posterior, não apenas a velocidade nos estágios iniciais
- Estratégia de protocolização – identificar o país certo para protocolizar primeiro e obter acesso ao mercado rapidamente
Os recursos certos lhe permitem focar na descoberta de inovações que podem ajudar os pacientes que precisam delas. Selecione qualquer estágio do processo de desenvolvimento para saber mais. Ou clique nos links de produtos e serviços para ver os recursos de apoio que oferecem oportunidades de uso imediato no início da criação da sua startup.
Fluxo de trabalho do centro de recursos de biotecnologia


Descoberta
Identificação das considerações, recursos e apoio necessários para desenvolver um novo candidato a medicamento biológico

Fase I-II
Agilização do desenvolvimento do seu processo com dicas, modelos e guias de aplicações

Fase III e fabricação
Progresso do escalonamento e transferência de tecnologia à produção de qualidade para estudos clínicos e comercialização

Programas para startups
Conexão com recursos e programas de financiamento que podem potencializar sua molécula

Regulatório
Navegar por um dos setores mais regulamentados do mundo requer inicialmente um guia confiável
Para continuar lendo, faça login ou crie uma conta.
Ainda não tem uma conta?