Fabricación de vacunas vectoriales víricas
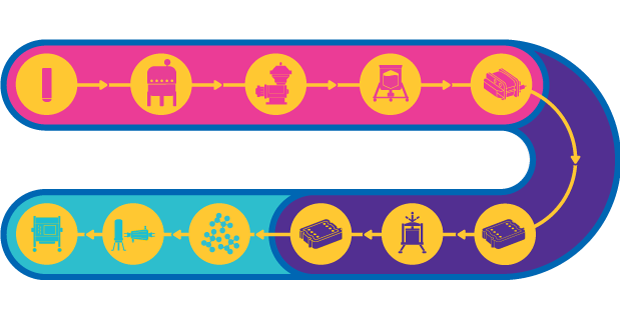
Fig 1.Tren de procesos para vacunas vectoriales víricas
En una vacuna de vectores vivos se utiliza un microorganismo atenuado o inofensivo, como un adenovirus, para transportar partes de un antígeno con el fin de estimular una respuesta inmunitaria. Las vacunas vectorizadas son capaces de inducir una potente inmunidad celular, que es esencial para enfermedades complejas como el SIDA, el paludismo y el cáncer, entre otras.
El proceso de fabricación de vectores para vacunas está bastante estructurado, pero pueden surgir algunos problemas, ya que pueden utilizarse diversos virus diferentes con propiedades variables. En el caso de los vectores víricos grandes, la esterilidad del proceso es crucial debido a la pérdida de rendimiento asociada a la esterilización por filtración. También existen problemas con la agregación y la estabilidad de los vectores.
Además, muchos procesos de fase I/II implican cultivos celulares adherentes; como consecuencia, el escalado a fase III y la fabricación comercial pueden requerir ajustes del proceso para alcanzar los objetivos de producción. En las últimas fases, el rendimiento y la pureza del producto son fundamentales, ya que se requieren elevadas concentraciones de administración en el producto final.
Recursos relacionados
Bioprocesamiento
Biopharmaceutical Applications Guide - Vaccines
Folleto: Vaccine Bioprocessing Handbook
Minimanual: Viral Vector Vaccine Bioprocessing
Seminario virtual: Process Development Guidance for AAV and Lentivirus Manufacturing Based on Cost Modeling
Seminario virtual: Sf-RVN Cell Line & CD Media Platform, A Production Platform for VLP and AAV
Libro blanco: Developing an Accelerated and More Cost-Effective Single-Use Adenoviral Vector Vaccine Manufacturing Process
Reducción del ADN
Purificación y clarificación
Artículo técnico: Purification or Removal of Viruses including Adeno-associated Virus
Artículo: Robust Harvest Clarification For Adeno-Associated Viral Vectors Via Depth Filtration
Artículo: Clarification of vaccines: An overview of filter based technology trends and best practices
Artículo: Filter-Based Clarification of Viral Vaccines and Vectors Biosafety
Artículo: How to Ensure Biosafety Of Novel Viral Therapies
Aceleración del tiempo hasta la fase clínica al tiempo que se garantiza un escalado fiable
Los procesos de cultivo upstream desarrollados para la fabricación de vacunas vectoriales víricas deben optimizarse para satisfacer los requisitos de productividad. Esta optimización incluye los pasos de lisis celular y clarificación que son esenciales para la eliminación de células y residuos celulares y para garantizar una potente recolección de vectores. El proceso upstream sólo tiene éxito, sin embargo, si puede escalarse de forma fiable para satisfacer la demanda prevista del mercado.
Consecución de los objetivos de rendimiento y eficiencia con una potente depuración de impurezas
Los ácidos nucleicos de las células lisadas son un contaminante común en los procesos de producción de vacunas vectoriales víricas. La normativa exige que la concentración de ácidos nucleicos de la célula huésped arrastrados sea inferior a 10 ng/dosis de la vacuna vírica atenuada. El tratamiento con endonucleasas Benzonase® seguido de filtración de flujo tangencial es una combinación sólida y potente para degradar y eliminar los componentes de ácidos nucleicos residuales.
Maximización de la recuperación downstream
Los lotes clínicos a pequeña escala suelen purificarse mediante la ultracentrifugación en gradiente de densidad de CsCl, mientras que la producción a gran escala requiere un proceso de cromatografía de dos o tres pasos. El intercambio de aniones se utiliza normalmente para eliminar las HCP, el ADN, el ARN y otros contaminantes importantes, mientras que la cromatografía de exclusión por tamaño se utiliza para la eliminación de trazas de contaminantes.
Garantía de la seguridad del paciente
La filtración esterilizante garantiza la esterilidad del producto formulado final y la seguridad del paciente. Se requiere un tamaño de poro de filtro de 0,22 µm o inferior para eliminar los contaminantes microbianos. Una consideración clave para el proceso de esterilización por filtración es el contenido de agregados víricos. Estos agregados deben controlarse optimizando la formulación; de lo contrario, se dificultará el proceso de esterilización por filtración con la posibilidad de grandes pérdidas de rendimiento.
Tratamiento con nucleasas y clarificación
Garantice una sólida escalabilidad.
- • Nuclease treatment with Benzonase® suitable for biopharmaceutical production EMPROVE® bio
- • Benzonase® Detection with Benzonase® Elisa Kit II to detect left over Benzonase® endonuclease in the process
- Clarificación primaria/secundaria con filtros de profundidad Millistak+® HC POD
- • Primary Clarification with Clarisolve® Depth Filters
- Filtros de profundidad para clarificación y soluciones de pretratamiento

Donwstream - Filtración de flujo tangencial
Consiga los objetivos de rendimiento, eficiencia y recuperación del ADNp al tiempo que garantiza una eliminación potente de impurezas

Productos químicos de procesos y formulación downstream

Disoluciones tampón y medios para cultivo celular líquido en bioprocesos
Ofrecemos las prestaciones de esterilización de líquidos mediante filtración de la mayor calidad del sector, suministrando medios de cultivo celular, tampones y productos CIP y SIP listos para usar de instalaciones GMP de todo el mundo para optimizar su producción biofarmacéutica.
Esterilización mediante filtración y llenado final
Garantice la seguridad del paciente con un proceso de esterilización por filtración fiable y robusto.
· Esterilización mediante filtración y llenado final
· Estrategias para esterilización mediante filtración
Muestreo estéril con disoluciones para muestreo estéril Novaseptum® Go
· Llenado y acabado con soluciones de un solo uso Mobius® para llenado y acabado

Para seguir leyendo, inicie sesión o cree una cuenta.
¿No tiene una cuenta?



