Synteza w fazie stałej
Peptydy są wytwarzane przy użyciu metod chemicznych FMOC lub BOC w fazie stałej na żywicy nośnikowej PEG-Polistyren. Po zakończeniu syntezy, grupy zabezpieczające łańcuch boczny są usuwane, a peptydy są jednocześnie odcinane od żywicy. Rozszczepiony i zdeprotezowany materiał peptydowy jest następnie wytrącany, przemywany i rozpuszczany w buforze zawierającym H2O/ACN/HOAC przed liofilizacją.
Kontrola jakości peptydów jest określana za pomocą spektrometrii mas ESI (potwierdzającej produkt pełnej długości) i HPLC w odwróconej fazie (RP-HPLC; określającej czystość peptydu. Peptydy niespełniające wymaganych specyfikacji czystości są oczyszczane za pomocą RP-HPLC.
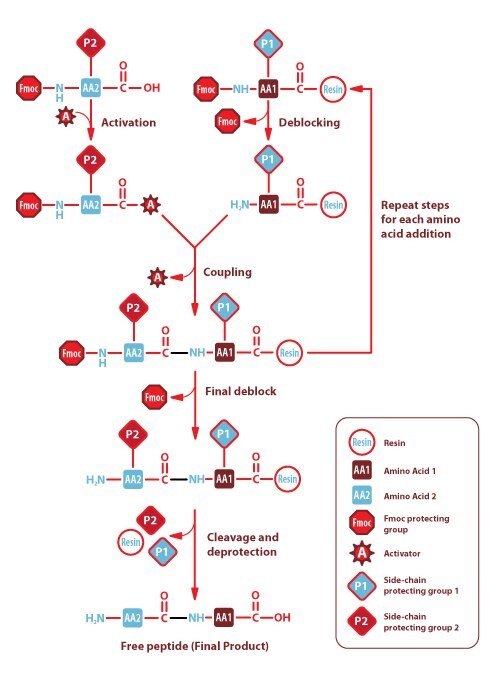
Rysunek 1.FMOC w fazie stałej
Zmienność między partiami
- Czystość peptydu - Czystość peptydu odnosi się do ilości pożądanego produktu peptydowego w stosunku do wszystkich innych zanieczyszczeń, z wyjątkiem wilgoci, jak określono za pomocą analitycznej HPLC. Czystość peptydów jest najczęstszą zmiennością i może powodować dużą zmienność między partiami. Peptydy o wyższej czystości powinny wykazywać mniejszą zmienność w porównaniu do ich mniej czystych odpowiedników. Peptydy o niższej czystości mogą zawierać różne ilości zanieczyszczeń dla każdej partii syntezy. W niektórych przypadkach zanieczyszczenia peptydowe z jedną lub mniejszą liczbą delecji aminokwasowych mogą nadal być aktywne i przyczyniać się do ogólnej aktywności peptydu.
- Agregacja - Peptydy hydrofobowe mają wysoką tendencję do agregacji. Aktywność peptydu może w dużym stopniu zależeć od tego, które formy agregatów są nadal aktywne. Peptydy w wysokich stężeniach mogą również prowadzić do większej agregacji.
- Przemiany chemiczne - Peptydy mogą przechodzić szereg przemian chemicznych podczas przechowywania, co może prowadzić do braku aktywności. Typowe przykłady obejmują peptydy zawierające Asp-Gly prowadzące do tworzenia izo-Asp, sieciowanie peptydów zawierających Cys poprzez tworzenie wiązań dwusiarczkowych oraz utlenianie Met do sulfotlenków i tworzenie piroglutaminianów.
- Zanieczyszczenia niepeptydowe - Niektóre zanieczyszczenia mogą być toksyczne dla komórek. Jeśli peptydy są używane do badań hodowli komórkowych, ditiotreitol (DTT) może być tolerowany w stężeniu mniejszym niż 1 uM w większości komórek. Peptydy o niższej czystości narażone na powszechne procesy wytrącania powinny mieć większość DTT usuniętą z końcowego materiału peptydowego. Peptydy oczyszczone metodą RP-HPLC są generalnie wolne od DTT.
Stabilność peptydów
Stabilność peptydów zależy od składu aminokwasowego i sekwencji. Peptydy liofilizowane są generalnie bardziej stabilne niż te w roztworze. Przechowywanie peptydów w postaci liofilizowanej w temperaturze -20 oC lub -80 oC zminimalizuje ich degradację. Ekspozycja na pH>8 i ekspozycja na tlen atmosferyczny powinny być zminimalizowane, jeśli to możliwe. Poniżej przedstawiono potencjalne ścieżki degradacji peptydów:
- Hydroliza: Ogólnie problem dla peptydów zawierających Asp (D). Należy unikać sekwencji zawierających kombinację Asp-Pro (D-P) lub Asp-Gly (D-G), ponieważ mogą one ulegać odwodnieniu, w wyniku czego powstaje cykliczny półprodukt imidowy. W mniejszym stopniu sekwencje zawierające Ser (S) mogą również tworzyć cykliczne półprodukty imidowe, które mogą rozszczepiać łańcuch peptydowy.
- Oksydacja: Reszty Cys (C) i Met (M) są dominującymi aminokwasami, które ulegają odwracalnemu utlenianiu. Utlenianie cysteiny jest przyspieszone przy wyższym pH, gdzie tiol jest łatwiej deprotonowany i łatwo tworzy wewnątrz- lub międzyłańcuchowe wiązania dwusiarczkowe. Wiązania dwusiarczkowe mogą być odwrócone przez traktowanie detiothreitolem (DTT) lub chlorowodorkiem tris(2-karboksyetylofosfiny) (TCEP). Pozostałości metioniny utleniają się zarówno na drodze chemicznej, jak i fotochemicznej, tworząc sulfotlenek metioniny i/lub sulfon metioniny, z których oba są trudne do odwrócenia.
- Powstawanie diketopiperazyny i kwasu piroglutaminowego:Powstawanie diketopiperazyny zwykle występuje, gdy glicyna (G) znajduje się w trzeciej pozycji od N-końca, a tym bardziej, gdy Pro (P) lub Gly (G) znajduje się w pozycji 1 lub 2. Reakcja obejmuje atak nukleofilowy azotu N-końcowego na karbonyl amidowy między drugim i trzecim aminokwasem, co powoduje rozszczepienie pierwszych 2 aminokwasów w postaci diketopiperazyny. Tworzenie kwasu piroglutaminowego jest prawie nieuniknione, jeśli Gln (Q) znajduje się w N-końcowej pozycji sekwencji. N-końcowy azot atakuje węgiel karbonylowy łańcucha bocznego Gln (Q), tworząc deaminowany analog peptydu piroglutamaylowego. Konwersja może również zachodzić w sekwencjach peptydowych zawierających Asn (N) w pozycji N-końcowej, ale w znacznie mniejszym stopniu.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?