Żywica ChemMatrix® do syntezy peptydów w fazie stałej
ChemMatrix® to zastrzeżona, w 100% oparta na PEG (glikolu polietylenowym) żywica firmy PCAS BioMatrix. Łączy w sobie mocne strony dwóch głównych systemów żywic - stabilność chemiczną żywic polistyrenowych i doskonałą wydajność żywic szczepionych PEG, dzięki czemu jest najlepszym wyborem do syntezy dużych lub hydrofobowych peptydów, a nawet białek na nośniku stałym.
W ostatnich dziesięcioleciach żywice polistyrenowe były głównym wyborem do syntezy peptydów na nośniku stałym ze względu na ich dobre wyniki w syntezie małych peptydów. Niemniej jednak, wraz ze wzrostem łańcucha aminokwasowego podczas syntezy, wzrasta tendencja peptydu do tworzenia struktur drugorzędowych. Hydrofobowe środowisko żywicy polistyrenowej wzmacnia agregacyjne zachowanie peptydu, czyniąc syntezę dużych peptydów niezwykle trudną lub nawet niemożliwą. Surowe produkty syntezy dużych peptydów na żywicach polistyrenowych wykazują mieszaninę sekwencji delecyjnych i niekompletnych fragmentów. Żywice szczepione PEG pomogły osiągnąć lepszą czystość surowych peptydów, czyniąc żywicę bardziej polarną i poprawiając właściwości pęcznienia zarówno w rozpuszczalnikach polarnych, jak i niepolarnych. Wadą takich żywic szczepionych PEG jest to, że pozwalają tylko na mniejsze obciążenia i są mniej stabilne chemicznie, co prowadzi do potencjalnego wymywania podczas etapu rozszczepiania.
Żywica ChemMatrix® została zaprojektowana od podstaw, zaczynając od nowego typu monomeru. Ostateczna żywica polimerowa jest zbudowana wyłącznie z pierwotnych wiązań eterowych i dlatego wykazuje wysoką stabilność chemiczną, unikając wymywania (Rysunek 1).1
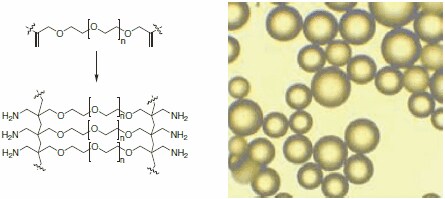
Rysunek 1.Szkielet żywicy Aminomethyl-ChemMatrix® jest zbudowany w całości z chemicznie stabilnych wiązań polieterowych (po lewej). Obraz mikroskopowy kulek ChemMatrix® (po prawej).
Jednocześnie zwiększona polarność żywicy pozwala na stosowanie różnych rozpuszczalników polarnych, w tym: wody, THF, DMF, metanolu i acetonitrylu, w których żywica wykazuje doskonałe właściwości pęcznienia (Rysunek 2). Podczas praktycznego stosowania należy wziąć pod uwagę wysokie właściwości pęcznienia, ponieważ mokra żywica ChemMatrix® będzie zajmować znacznie więcej miejsca w naczyniu reakcyjnym niż konwencjonalne żywice polistyrenowe. Typowe zakresy obciążenia wynoszą od 0,4 do 0,7 mmol/g, co jest porównywalną zdolnością wiązania jak żywice polistyrenowe.
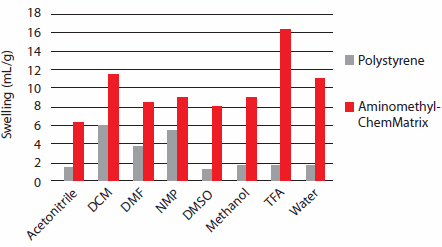
Rysunek 2.Właściwości pęcznienia żywicy ChemMatrix® w porównaniu z żywicą polistyrenową.
Dwie ostatnie niezależne publikacje dostarczają niezwykłych dowodów na niezrównaną wydajność żywicy ChemMatrix®. W przypadku syntezy proteazy HIV-1, dużego peptydu składającego się z 99 aminokwasów, żywica ChemMatrix® została porównana bezpośrednio z polistyrenem.2 Jak wyraźnie pokazują poniższe chromatogramy, pożądany peptyd jest głównym składnikiem surowego produktu przy użyciu ChemMatrix® jako stałego nośnika (Rysunek 3). Żywice polistyrenowe dostarczają jedynie surowych mieszanin uniemożliwiających bezpośrednią, liniową syntezę długich peptydów.
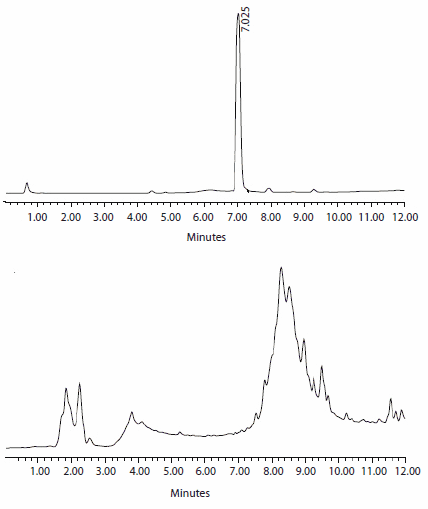
Rysunek 3.Chromatogramy HPLC proteazy HIV-1 (99 aminokwasów) po 78 aminokwasach. Synteza na żywicy ChemMatrix® daje pożądany peptyd bezpośrednio bez dalszego oczyszczania (góra), podczas gdy żywica polistyrenowa daje tylko bardzo surową mieszaninę (dół).
W drugim zdumiewającym przykładzie, Bacsa et al. zgłosili w 2010 roku, wspomaganą mikrofalami syntezę polipeptydu Aβ(1-42).3 Aβ (1-42) odgrywa kluczową rolę w patogenezie choroby Alzheimera, ponieważ tworzy struktury β-arkuszowe i amyloidowe, które indukują neurotoksyczność. Jest to zatem kluczowy materiał potrzebny do dalszego badania molekularnych mechanizmów choroby Alzheimera i potencjalnych leków do jej leczenia. Ze względu na swoje zachowanie agregacyjne peptyd ten jest bardzo trudny do syntezy. Żywica ChemMatrix® umożliwia bezpośrednią, liniową syntezę przy użyciu standardowej strategii syntezy Fmoc/t-Bu z zastosowaniem DIC/HOBt jako prostego i niedrogiego odczynnika sprzęgającego. Z wyjątkiem sprzęgania trzech wrażliwych na racemizację reszt histydynowych, które przeprowadzono w temperaturze pokojowej, syntezę przeprowadzono w kontrolowanych warunkach mikrofalowych w temperaturze 86°C. Żywica ChemMatrix pozostała całkowicie stabilna w tych warunkach.4 Ostatecznie, Aβ(1-42) otrzymano w ciągu 15 godzin ogólnego czasu przetwarzania z wysoką wydajnością i czystością (78% surowej wydajności).3
Oprócz syntezy peptydów żywica ChemMatrix® była również z powodzeniem stosowana w syntezie kombinatorycznej,5 do syntezy pochodnych oligonukleotydów,6 PNA,7 asymetrycznie podstawionych ftalocyjanin,8 oraz hybryd peptydowych zawierających nienaturalne reszty chemiczne.9
Podsumowując, ChemMatrix® pokonuje wyzwania związane z syntezą dłuższych i bardziej złożonych peptydów terapeutycznych. Peptydy produkowane przy użyciu ChemMatrix® mają wyższą czystość i mogą być otrzymywane z lepszą wydajnością. Peptydy, które do tej pory były osiągalne tylko poprzez ligację lub techniki rekombinacji, mogą być teraz syntetyzowane bezpośrednio na stałym nośniku.
Do syntezy kwasów peptydowych zalecamy stosowanie ChemMatrix® z kotwicą HMPB, ponieważ żywica ta zapewni wysoką czystość surowca i wydajność odzysku na poziomie 90-95%. Wang-ChemMatrix® zapewni podobną czystość surowego peptydu, ale wydajność odzysku jest niższa (60-70%). Żywice HMPB-ChemMatrix® są również oferowane jako wstępnie załadowane najpopularniejszymi aminokwasami. W literaturze opublikowano ostatnio szereg protokołów stosowania żywicy ChemMatrix.10
Cechy żywicy ChemMatrix®
- Wyjątkowa stabilność
Żywica ChemMatrix® jest wykonana wyłącznie z pierwotnych wiązań eterowych, które są wysoce stabilne chemicznie. Podczas syntezy i rozszczepiania nie występuje wymywanie. - Wysokie obciążenie
Żywice ChemMatrix® mają obciążenie 0.4-0,7 mmol/g. - Kompatybilność z rozpuszczalnikami
ChemMatrix® pozwala na użycie prawie każdego rodzaju rozpuszczalnika, nawet wody. Wysokie właściwości pęcznienia ChemMatrix® w wodzie pozwalają na wysoką przepustowość po-syntetycznych badań przesiewowych. - Wszechstronny wybór
Żywica ChemMatrix® jest oferowana z szeroką gamą łączników do kwasów peptydowych, amidów i fragmentów. Do syntezy peptydów dostępne są również wstępnie załadowane żywice. - Demonstrowana wyższość
Żywica ChemMatrix® została udowodniona pod kątem łatwiejszego i szybszego opracowywania długich, złożonych i hydrofobowych peptydów. Im dłuższy, bardziej złożony lub hydrofobowy jest peptyd, tym większą poprawę można zaobserwować dzięki ChemMatrix®. - Synteza wspomagana mikrofalami
Nie obserwuje się wymywania na syntezatorach mikrofalowych w temperaturze 80 °C.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?