Ultrafiltracja/diafiltracja (UF/DF) w produkcji plazmidowego DNA
Produkcja plazmidowego DNA (pDNA) dla mRNA, szczepionek DNA opartych na plazmidzie i zastosowań wektorów wirusowych, obejmuje szereg etapów hodowli, zbioru, lizy, oczyszczania i koncentracji DNA do dalszych zastosowań. Chromatografia jest wykorzystywana jako część procesu oczyszczania plazmidu, ale pDNA jest często rozcieńczane podczas tego etapu. Na tym etapie plazmid często znajduje się również w nieodpowiednim buforze do dalszych zastosowań. W tym miejscu z pomocą przychodzi ultrafiltracja i diafiltracja (UF/DF).
Jak Ultrafiltracja i Diafiltracja są wykorzystywane w produkcji DNA?
Podczas UF/DF plazmid jest zatężany i diafiltrowany w odpowiednim buforze. Zazwyczaj odbywa się to przy użyciu filtracji z przepływem stycznym (TFF), ponieważ technika ta jest łatwo skalowalna, wysoce selektywna i opłacalna.
Ultrafiltracja
Podczas ultrafiltracji cząsteczki w roztworze są oddzielane na podstawie odcięcia wielkości. Wybór wielkości porów membrany, która może zatrzymać plazmid, ale przepuszcza wodę, bufory, sole i inne substancje chemiczne, pozwala na zagęszczenie plazmidu.
Diafiltracja
W diafiltracji bufor elucyjny chromatografii jest wymieniany na bufor końcowy w tej samej objętości. Ten etap ma miejsce po zatężeniu plazmidu za pomocą ultrafiltracji. Bufor końcowy jest dodawany do paszy, gdy bufor chromatograficzny jest rozcieńczany.
Filtracja z przepływem stycznym
Zarówno ultrafiltracja, jak i diafiltracja są wykonywane w ramach filtracji z przepływem stycznym. W przypadku filtracji z przepływem stycznym, wsad przepływa równolegle do membrany zamiast przez nią. Pozwalając cząstkom przepływać prostopadle do powierzchni membrany, materiał jest mniej podatny na zatykanie filtra.
Ponieważ początkowe stężenie plazmidów jest na ogół znacznie niższe niż w typowym strumieniu przeciwciał lub rekombinowanych białek, zastosowanie TFF przed chromatografią działa również jako etap zatężania w celu dalszej poprawy oczyszczania.
Optymalizacja parametrów ultrafiltracji/diafiltracji
Ten etap separacji i zatężania oparty na membranach musi być zoptymalizowany w celu osiągnięcia wysokiej wydajności bez narażania integralności plazmidu. Wydajność etapu TFF zależy od warunków zasilania, odcięcia masy cząsteczkowej (MWCO), strumienia zasilania i filtratu/permeatu oraz ciśnienia w układzie. Pożądaną czystość plazmidu, formułę i specyfikację stężenia bez uszkodzenia produktu można osiągnąć poprzez optymalizację tych parametrów hydraulicznych. Ponadto należy zawsze unikać wprowadzania powietrza, ponieważ interfazy powietrze-ciecz mogą wpływać na integralność plazmidu.
Poprawa retencji plazmidu podczas TFF
TFF opiera się na różnicy wielkości między pDNA a zanieczyszczeniami obecnymi w lizacie, takimi jak liniowe DNA, RNA i endotoksyny. Dlatego membrana TFF musi mieć odpowiedni MWCO, aby zatrzymać pDNA i umożliwić przesiewanie zanieczyszczeń i początkowego buforu. Ze względu na swoją strukturę, plazmidy mogą czasami przechodzić przez pory, które są mniejsze niż ich pozorna masa cząsteczkowa. To przesiewanie może być bardziej dominujące wraz ze wzrostem strumienia. Współczynnik przesiewania wzrasta również przy wyższej sile jonowej z powodu zmniejszenia efektywnego rozmiaru plazmidu obserwowanego w tych warunkach1.
Wykazano, że wyższe stężenie soli zmniejsza promień plazmidu1. W tych warunkach struktura plazmidu wydaje się być bardziej skręcona, wykazując skondensowany efektywny rozmiar.
Utrata pDNA w permeacie może być potencjalnie rozwiązana poprzez polaryzację membrany (przy użyciu trybu pełnej recyrkulacji z permeatem skierowanym do zbiornika zasilającego) przed rozpoczęciem cyklu TFF z linią permeatu skierowaną do wylotu. Spowoduje to utworzenie stabilnej warstwy polaryzacyjnej, która poprawi retencję.
Zarządzanie zwiększoną lepkością
Oprócz tych możliwości retencji i oczyszczania, TFF powinien być w stanie zarządzać zwiększoną lepkością na całym etapie procesu i mieć wysoką wydajność, aby umożliwić akceptowalny ślad w skali.
Ponieważ lepkość również wzrasta, szczególnie przy stężeniach zbliżających się i przekraczających 10 mg/ml, nie zaleca się stosowania szczelnych sit. Konfiguracje urządzeń TFF z grubym sitem typu C lub zawieszonym sitem typu V powinny być stosowane do średnich (5-10 X) i wyższych stężeń (30-50 X); wymagana jest jednak optymalizacja procesu TFF.
Optymalizacja ciśnienia transbłonowego i strumienia
Pod względem parametrów preferowany jest niższy TMP. Użycie dwupompowego, sterowanego permeatem systemu może być preferowane dla 100 kD i większych MWCO2. W zależności od konkretnej konfiguracji zastosowanej membrany, etap jest zwykle obsługiwany przy TMP ≤10 psi dla strumienia permeatu ~20-50 l/m²/h (LMH). Plazmid jest zwykle całkowicie zatrzymywany przy niskim strumieniu filtratu, a przesiewanie można zaobserwować przy wyższych strumieniach3.
Strumień zasilający wybrany do zatężania i diafiltracji zwykle mieści się w zakresie od 4 do 6 l/min/m2 (LMM) w celu zmniejszenia naprężeń mechanicznych, które mogą ostatecznie prowadzić do degradacji DNA. Wysokie obciążenie w zakresie od 70 do 140 l/min2 można osiągnąć, jeśli te parametry ciśnienia i strumienia są dobrze zoptymalizowane z odpowiednią membraną.
Te typowe parametry operacyjne zostały podsumowane w Tabeli 1.
Studium przypadku: Wymiana buforu przy użyciu kasety Pellicon® 2 z membraną Ultracel® 300 kD do ultrafiltracji/diafiltracji (UF/DF) plazmidowego DNA
Cel: Wymiana buforu przy użyciu filtracji z przepływem stycznym (TFF).
Pellicon® 2 kasety z membranami Biomax® lub membranami Ultracel® oraz sitem C lub V mogą być używane do zatężania i diafiltracji pDNA z wysokim obciążeniem i wydajnością. Konfiguracja V-screen jest szczególnie zalecana dla strumieni zasilających o wysokim stężeniu lub wysokiej lepkości. W przypadku zastosowań jednorazowych, kapsułki Pellicon® z membraną Ultracel® i sitem C są optymalną alternatywą. Wybrany MWCO zależy od struktury pDNA i może wynosić od 30 kD do 300 kD. Standardową zasadą jest stosowanie membrany o średnicy porów 3-5 razy mniejszej niż średnica produktu będącego przedmiotem zainteresowania. Dla popularnych plazmidów o wielkości 5-20 kbp często wybiera się 100 kD.
Materiały
- Urządzenie - kaseta Pellicon®, rozmiar 88 cm2
- Membrana - 300 kD membrana Ultracel® (kompozytowa regenerowana celuloza); zatrzymuje DNA o masie cząsteczkowej ~10 kD, jednocześnie przepuszczając wodę, zanieczyszczenia jonowe i niskocząsteczkowe
- Sito zasilające - sito C zostało wybrane dla umiarkowanych lepkości
Proces wymiany buforu
- Przygotowanie membrany
- Płukanie wodą: 20 L/m2
- Recyrkulacja wody na miejscu: 0.2 N NaOH, 20 L/m2 pojedyncze przejście
- Płukanie buforem: 20 L/m2 10 mM Tris, 1 mM EDTA, pH 8 (TE) - Etap koncentracji
- Redukcja objętości zbiornika z permeatem do odpadów - Etap diafiltracji
- Diafiltracja o stałej objętości: dodawanie buforu TE z taką samą szybkością jak usuwanie permeatu - Etap odzyskiwania
- opróżnienie zbiornika, a następnie przepłukanie linii retentatu i zbiornika
Wyniki wymiany buforowej<
Diafiltracyjną wymianę buforu przeprowadzono przy użyciu membrany Ultracel® 300 kD w celu zatrzymania pDNA i przepuszczenia wody oraz zanieczyszczeń o niskiej masie cząsteczkowej. Przeprowadzono eksperyment krytycznego strumienia przy przepływie krzyżowym od 5 do 8 LMM, aby wykazać, że wysokie strumienie 80-125 LMH były akceptowalne bez zanieczyszczenia. Diafiltracja o stałej objętości przy 4 LMM przez 5 DV do buforu TE wykazała spadek TMP (brak zanieczyszczeń). Płukanie retentatu wykazało wydajność na poziomie 96%.
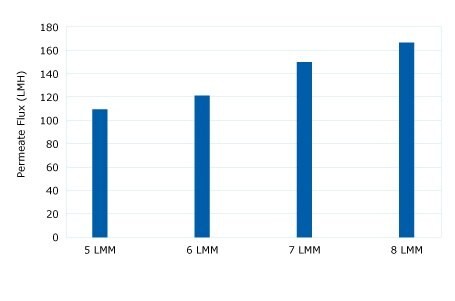
Rysunek 1.Krytyczna ocena strumienia
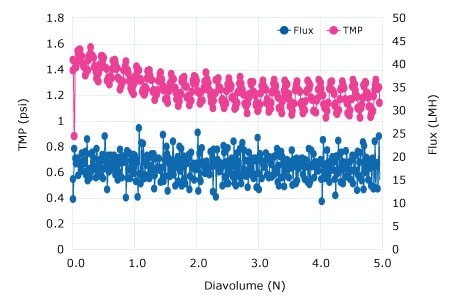
Rysunek 2.Przebieg diafiltracji
Zachowanie zgodności z aktualnymi Dobrymi Praktykami Wytwarzania (cGMP) w dowolnym momencie procesu produkcji leków może być złożonym i trudnym zadaniem. Aby ułatwić i przyspieszyć proces ciągłej oceny ryzyka, dowiedz się więcej o naszym Emprove® Program.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?