Czym jest chromatografia wielokolumnowa?
Pierwotne wychwytywanie chromatograficzne jest jednym z głównych wąskich gardeł w dalszych etapach bioprocesów, zarówno pod względem czasu, jak i kosztów. Opracowywanych jest kilka technologii intensyfikacji chromatografii wychwytowej w celu stworzenia bardziej zintensyfikowanego, wydajnego i potencjalnie ciągłego bioprocesu. W tym artykule omówimy jedną z metod stosowanych do intensyfikacji procesu chromatografii wychwytu: chromatografię wielokolumnową (MCC).
Read more about
- Batch Chromatography vs. Chromatografia wielokolumnowa
- Zalety chromatografii wielokolumnowej
- Studium przypadku: Integracja MCC z procesem ciągłym
Chromatografia wsadowa a chromatografia wielokolumnowa
W tradycyjnej chromatografii wsadowej produkt jest ładowany do jednej kolumny, płukany, a następnie wymywany do dalszego przetwarzania. Aby zapobiec niedopuszczalnej utracie produktu, dynamiczna zdolność wiązania (DBC) żywicy wychwytującej jest określana podczas opracowywania jako zaledwie 5% lub 10% przebicia produktu. Podczas produkcji kolumna jest następnie ładowana do 80-85% tej DBC, co odpowiada w przybliżeniu tylko 60-70% wykorzystania żywicy. Wszystkie operacje (ładowanie, mycie, elucja itp.) są wykonywane na tej pojedynczej kolumnie, a przepływ produktu jest zatrzymywany podczas etapów innych niż ładowanie, takich jak regeneracja, mycie i elucja.
W przeciwieństwie do tego, chromatografia wielokolumnowa wykorzystuje mniejsze kolumny, które są umieszczone szeregowo. W MCC produkt jest ładowany na pierwszą kolumnę, a przełom jest wychwytywany bezpośrednio na drugiej kolumnie (Rysunek 1, Krok 1). Gdy kolumna 1 zostanie nasycona, zasilanie przełącza się na bezpośrednie ładowanie kolumny 2, która następnie przebija się do kolumny 3. Podczas ładowania kolumny 2, kolumna 1 jest przemywana, wymywana i regenerowana (Rysunek 1, krok 2). Po zakończeniu i nasyceniu kolumny 2, następuje cykl, w którym kolumna 2 jest myta, eluowana i regenerowana. Kolumna 3 bezpośrednio ładuje przełom do nowo oczyszczonej i zrównoważonej kolumny 1. (Rysunek 1, krok 3).
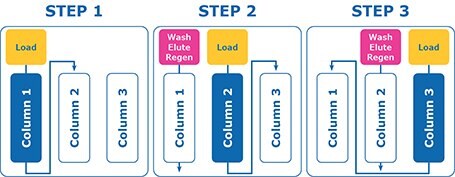
Rysunek 1.Przepływ pracy chromatografii wielokolumnowej. MCC umożliwia jednoczesne ładowanie, płukanie, elucję i regenerację wielu kolumn.
Ta kompletna sekwencja nazywana jest cyklem i może być powtarzana tyle razy, ile jest to konieczne do przetworzenia całego materiału lub do momentu osiągnięcia zatwierdzonej maksymalnej liczby cykli na żywicy chromatograficznej.
Zalety chromatografii wielokolumnowej
Wdrożenie chromatografii wielokolumnowej ma trzy kluczowe zalety:
- Zmniejszone zapotrzebowanie na żywicę. Pełniejsze wykorzystanie zazwyczaj zmniejsza zapotrzebowanie na żywicę o 20%, w zależności od procesu, produktu i żywicy.
- Zdolność do ciągłej pracy przy minimalnym zbiorniku wyrównawczym.
- Zdolność do szybkich cykli. We wczesnej fazie produkcji materiału klinicznego, tylko ułamek całkowitego czasu cyklu jest wykorzystywany na żywicy Protein A, ponieważ potrzeby produktu kampanii są ograniczone. MCC pozwala zwiększyć liczbę cykli używanych w pojedynczej partii, aby lepiej wykorzystać wskaźniki ponownego użycia żywicy.
Studium przypadku: Integracja MCC z ciągłym procesem Downstream m Ab
Cel
Cel
Cel./h3>
Celem było połączenie i uruchomienie kompletnego ciągłego procesu w celu wykazania korzyści, takich jak obniżone koszty, zwiększona produktywność i mniejszy wpływ na środowisko. Zostało to udowodnione poprzez wykonanie czterech przebiegów procesu w skali bioreaktora o pojemności ~1000 l przy mianie ~4 g/L mAb. Celem etapu wychwytywania było również zademonstrowanie możliwości wychwytywania mAb w sposób ciągły i niezawodny za pomocą wielokolumnowego systemu wychwytywania.
Materiały i metody
Przeciwciała monoklonalne wytwarzano w bioreaktorze o pojemności 1000 l, pracującym w trybie wsadowym. Hodowlę komórkową poddano wstępnej obróbce za pomocą pDADMAC® kationowego flokulanta polimerowego i oczyszczono przez Filtry wgłębne Clarisolve® 40MS, a następnie filtr sterylizujący Millipore Express® SHC. Ta oczyszczona pula była w sposób ciągły ładowana do Protein A Resin (3 x 0.55 L, 10 cm Ø x 7 cm BH) z wykorzystaniem wielokolumnowego systemu wychwytywania przy średnim natężeniu przepływu 0,28 l/min przez 2,5 dnia. Piki elucyjne były stale przesyłane do inaktywacji wirusów. Zestaw do inaktywacji wirusów (VI) składał się z jednorazowych zbiorników o pojemności 3 l z możliwością ciągłego obniżania pH, utrzymywania roztworu przez żądany czas i ponownego dostosowywania pH przed polerowaniem. Produkt był następnie polerowany w trybie przepływowym i wysyłany do kolejnej operacji. Wszystkie operacje ciągłe były wykonywane przy użyciu wzajemnie połączonych systemów (Rysunek 2) w celu wyzwalania działań procesowych i wysyłania alarmów zwrotnych w przypadku wystąpienia odchyleń. Czujniki UV po kolumnie wyzwalały przełączanie między kolumnami ładującymi w oparciu o wykrywanie przebicia i przełączanie między odpadami a frakcją podczas wykrywania piku elucji. Zawór został zainstalowany na wlocie skidu do inaktywacji wirusów, aby przekierować frakcje do jednego lub drugiego zbiornika w oparciu o te poziomy zbiorników. Alarmy zwrotne, takie jak przeciążenie zbiornika, mogą być wysyłane z powrotem w celu przerwania wielokolumnowego systemu wychwytywania. Poziom ostatniego zbiornika systemu inaktywacji kontrolował uruchomienie systemów chromatografii polerującej.
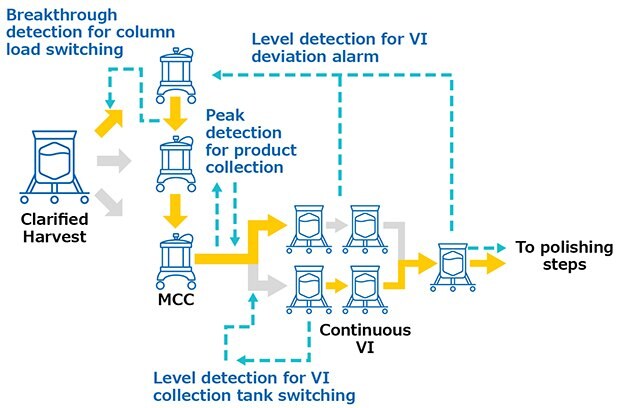
Rysunek 2.Połączenia systemowe podczas testów walidacyjnych.
Produkcja mAb z MCC
Podczas 4 przebiegów procesu możliwe było konsekwentne przetwarzanie kilogramowych ilości mAb w wielokolumnowym systemie wychwytywania przebieg po przebiegu poprzez optymalizację i równoważenie parametrów operacyjnych całego zestawu DSP. Przeprowadziliśmy około 30 cykli na kolumnę podczas pierwszych trzech przebiegów i 46 cykli podczas ostatniego przebiegu, co dało łącznie 146 operacji wiązania/wydzielania.
Przebiegi walidacyjne
Czwarty przebieg procesu miał największą liczbę cykli. Podczas tego przebiegu ciągłe wychwytywanie przeprowadzono na kolumnach z białkiem A w 46 cyklach w ciągu ponad 2 dni. Widma UV związane z każdą kolumną pokazano na Rysunku 3A-C, z nałożonymi widmami dla wszystkich trzech kolumn (Rysunek 3D) wskazującymi na stałą wydajność podczas 139 operacji wiązania/wydzielania. Podobnie jak w przypadku weryfikacji koncepcji i zgodnie z oczekiwaniami, pierwszy cykl jest nieregularny, po którym następują regularne i powtarzalne piki. Zaobserwowano jedną krótką przerwę (*), związaną z pauzą wywołaną z następnego kroku (inaktywacja wirusa) i połączoną z alarmem poziomu w zbiorniku. Poza tym nie zaobserwowano żadnych innych przerw.
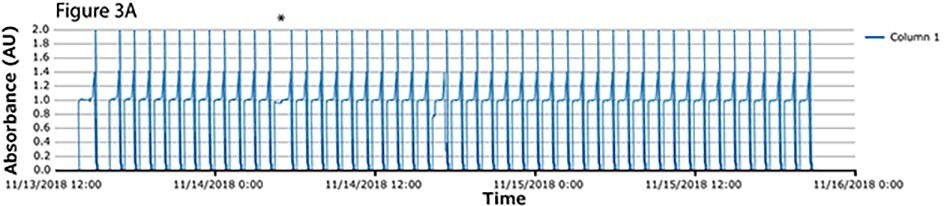
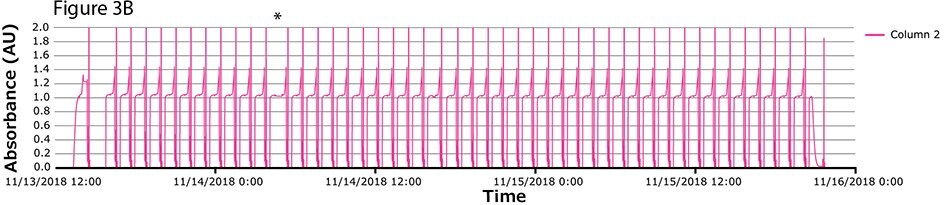
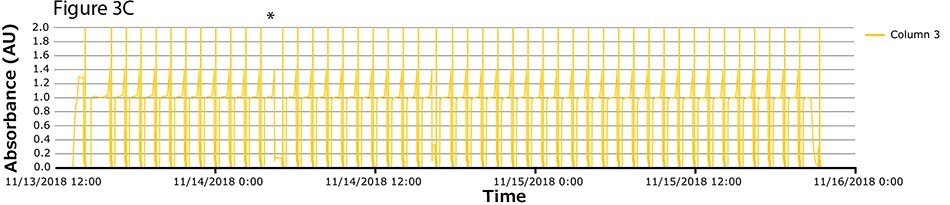
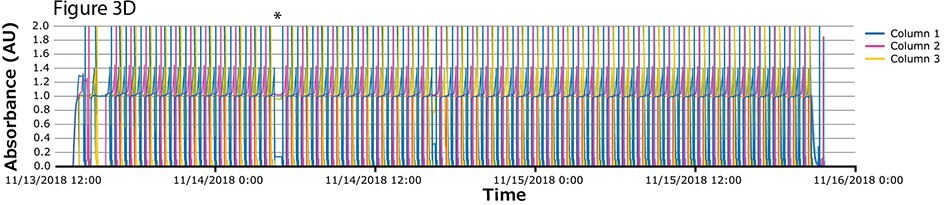
Rysunek 3.Chromatogramy czwartego przebiegu walidacyjnego. (A) Kolumna 1, (B) Kolumna 2, (C) Kolumna 3, (D) Nałożenie kolumn 1, 2 i 3.
Zdefiniowany procent przebicia (BT) odpowiada różnicy między plateau zanieczyszczenia a maksymalną wartością UV oczyszczonego zbioru (Rysunek 4). Rysunek 5 ilustruje sygnały UV plateau zanieczyszczenia (kropki) i przebicia (kwadraty) wyzwalające przełącznik kolumny w systemie ciągłego wychwytywania przez 139 cykli czwartego przebiegu walidacji. Na wykresie można zaobserwować dwa trendy. Kropki wskazują stabilną absorbancję podczas ładowania, odpowiadającą zanieczyszczeniom wychodzącym z ładowanej kolumny. Kwadraty na wykresie przedstawiają absorbancję (produktu i zanieczyszczeń) w każdym cyklu i odpowiadają wartości przełączania absorbancji między kolumnami po osiągnięciu zdefiniowanego punktu granicznego. Podczas tego projektu wartość przełączania wynosiła 60% BT. Rysunek 8 pokazuje ekstremalną regularność poziomu plateau zanieczyszczeń i wykrywania przebicia cykl po cyklu, z odchyleniem standardowym poniżej dokładności czujnika (Tabela 2), pokazując, że wydajność w różnych cyklach w całym procesie była bardzo spójna i porównywalna.
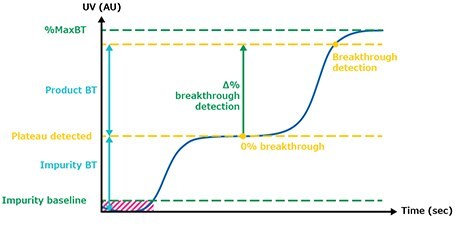
Rysunek 4.Przełomowe wykrywanie.
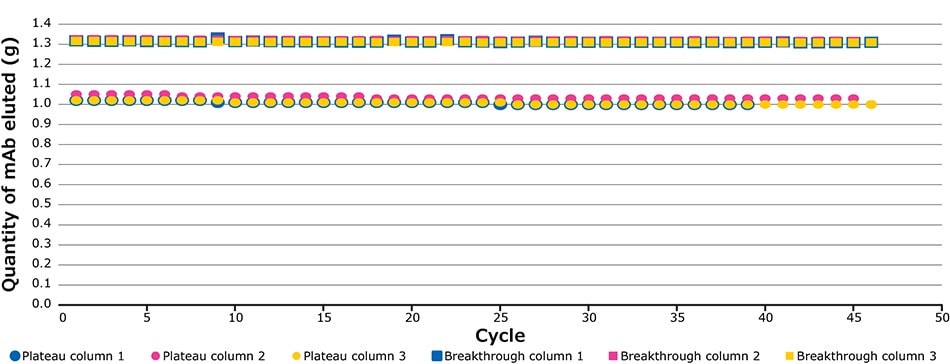
Rysunek 5.Poziomy plateau i przebicia podczas czwartego przebiegu walidacji.
Perspektywy wdrożenia procesu
W niniejszym raporcie przedstawiono użyteczność zautomatyzowanego systemu wychwytywania wielokolumnowego do zintensyfikowanego oczyszczania 1000 l zbioru hodowli komórkowej zawierającego 3,2 kg mAb w ciągu 55 godzin, aby umożliwić ciągłą zautomatyzowaną produkcję i niższe koszty towarów.
W porównaniu do trybu wsadowego (1 kolumna), wychwytywanie wielokolumnowe zużywa znacznie mniejszą objętość białka A (Rysunek 6).
Używając systemu MCC, objętość wymaganego białka A można zmniejszyć nawet 43-krotnie w porównaniu do trybu wsadowego z pojedynczym cyklem. Wydajność wzrosła z 30 g.mAb/L.żywicy/h dla trybu wsadowego do 40 g.mAb/L.żywicy/h dla 46 cykli z wielokolumnowym systemem wychwytywania. Dzięki systemowi MCC możliwe jest oczyszczenie do 3000 l mAb o stężeniu 4 g/L w ciągu 24 godzin.
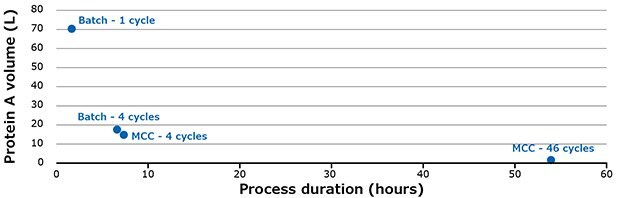
Rysunek 6.Różne scenariusze oczyszczania 3,2 kg mAbs.
Przetwarzanie nowej generacji ma na celu obniżenie kosztów poprzez znaczne zwiększenie wydajności przy jednoczesnej intensyfikacji procesu, aby był mniejszy, tańszy, szybszy lub wszystkie trzy. Kluczowym wąskim gardłem dla poprawy wydajności jest podstawowy etap chromatograficznego wychwytywania, w którym objętości są duże, a istniejąca technologia jednokolumnowa może zapewnić jedynie wysoce przerywany strumień produktu wyjściowego.
Jak opisano tutaj, technologia chromatografii wielokolumnowej znacznie zmniejsza objętość wymaganej żywicy białka A, umożliwia ciągłe przetwarzanie, zwiększa wydajność i zmniejsza koszty. Ta ciągła technologia, w połączeniu z zaletami sprzętu jednorazowego użytku, zwiększa produktywność mAb, zmniejsza powierzchnię zakładu, obniża nakłady inwestycyjne, poprawia elastyczność zakładu i zmniejsza ryzyko dla produktu.
Aby uzyskać więcej informacji na temat chromatografii wielokolumnowej i dowiedzieć się więcej o naszym systemie chromatografii wielokolumnowej, odwiedź naszą systemy chromatograficzne do bioprzetwarzania page.
Podziękowania
"Niniejsza praca została sfinansowana z programu badań i innowacji Unii Europejskiej Horyzont 2020 w ramach umowy o dotację nr 635557."
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?