Filtracja z przepływem stycznym w procesie produkcji koniugatów przeciwciał i leków (ADC)
Filtracja z przepływem stycznym (TFF) jest niezbędna w produkcji koniugatów przeciwciał i leków (ADC), rodzaju leku, w którym lek cytotoksyczny jest połączony z przeciwciałem monoklonalnym w celu ukierunkowanego rozpoznania. Ultrafiltracja (UF) służy do zagęszczania produktu białkowego, a diafiltracja (DF) do wymiany buforu i/lub usuwania zanieczyszczeń związanych z procesem z roztworu ADC, w tym pozostałości łącznika, rozpuszczalnika organicznego i/lub wolnego leku (Rysunek 1).

Rysunek 1.Przykład procesu produkcyjnego ADC.
Konserwacja rozpuszczalnika organicznego jest wymagana podczas przetwarzania roztworu ADC bezpośrednio po koniugacji, dla którego filtr TFF musi być kompatybilny z rozpuszczalnikiem. Produkcja ADC wymaga również strategii hermetyzacji podczas etapów TFF po koniugacji, aby chronić operatorów przed zagrożeniami dla zdrowia związanymi z narażeniem na bardzo silną cząsteczkę ADC i wolny lek, jednocześnie zapobiegając zanieczyszczeniu produktu i środowiska. W rezultacie samodzielne, jednorazowe urządzenia TFF są naturalnym wyborem dla operacji UF/DF w produkcji ADC (dowiedz się więcej o różnych metodach filtracji z przepływem stycznym tutaj).
Poniżej opisujemy najlepsze praktyki dotyczące stosowania naszych kapsułek Pellicon® w przetwarzaniu ADC i udostępniamy dwa badania z wykorzystaniem kapsułek Pellicon® i kaset Pellicon® w procesie produkcji ADC.
TFF Filter Organic Solvent Clearance and Compatibility
Etap koniugacji ADC zachodzi w obecności rozpuszczalnika organicznego, takiego jak dimetylosulfotlenek (DMSO) lub dimetyloacetamid (DMAc). Aby przetworzyć surowy roztwór ADC, filtr TFF musi zapewniać kompatybilność z rozpuszczalnikami organicznymi i skuteczne usuwanie zanieczyszczeń.
Użyliśmy kapsułek Pellicon® Capsules i kaset Pellicon® 3, aby zademonstrować klirens 20% DMAc i 20% DMSO przez diafiltrację (odpowiednio Rysunki 2 i 3). Oba filtry działały z wydajnym usuwaniem rozpuszczalnika i śledziły teoretyczny proces, w którym nie zakłada się zatrzymywania rozpuszczalnika przez membranę, obliczony przy użyciu współczynnika przesiewania (S) równego 1. Spadek szybkości usuwania DMSO po ~ 8 diavolumes może wynikać z obecności martwych nóg w systemie i interakcji ładunku.
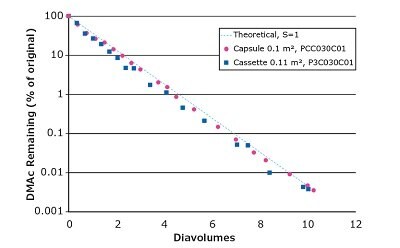
Rysunek 2.Diafiltracja 20% DMAc z roztworu wodnego.
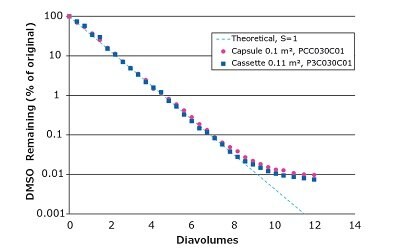
Rysunek 3.Diafiltracja 20% DMSO z roztworu wodnego.
Porównanie parametrów przed i po diafiltracji, w tym dyfuzji powietrza, spadku ciśnienia, przepuszczalności membrany i retencji białka, wskazuje na stabilność kapsułki do DMAc i DMSO w badanych warunkach (Rysunki 4 i 5).
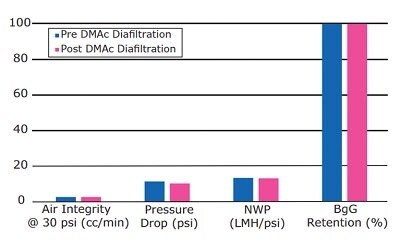
Rysunek 4.Zgodność kapsułki Pellicon® z DMAc.
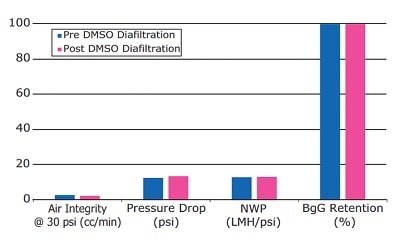
Rysunek 5.Zgodność kapsułki Pellicon® z DMSO.
Best Practices for ADC Processing with Pellicon® Capsule
.
Podczas stosowania kapsułek Pellicon® Capsule do surowców ADC, poniższe wytyczne operacyjne powinny generalnie skutkować dobrą wydajnością procesu. Wytyczne te mogą być modyfikowane w razie potrzeby w oparciu o wyniki prac rozwojowych nad procesem.
- Zainstaluj kapsułki Pellicon® Capsule z membraną Ultracel® 30 kDa w systemie jednorazowego użytku TFF do filtracji zmodyfikowanych mAb lub ADC o masie cząsteczkowej ~150 kDa. Instalacja kapsułki nie wymaga uchwytu kompresyjnego ani jednorazowych wkładek/płytek do przechowywania roztworu zasilającego.1
- W razie potrzeby potwierdź integralność kapsułki Pellicon®.
- Uzdatnić system TFF i membranę poprzez przepłukanie buforem zasilającym w ilości 20 l/m2 (sanityzacja nie jest wymagana). Po kondycjonowaniu należy zapobiec przedostawaniu się powietrza do kapsułki, aby uniknąć tworzenia się piany i uszkodzenia białka przez interfejs powietrze/ciecz.
- Dodaj roztwór zasilający do zbiornika zasilającego. Jeśli objętość wsadu przekracza pojemność zbiornika, należy kontynuować dodawanie w trybie wsadowym o stałej objętości (natężenie przepływu wsadu do zbiornika równe natężeniu przepływu permeatu).
- Stężać do momentu osiągnięcia stężenia docelowego dla diafiltracji przy użyciu natężenia przepływu wsadu 5 l/min/m2, TMP 10-20 psi (optymalne TMP określone przez uruchomienie skoków TMP), w temperaturze pokojowej. W przypadku ADC typowe stężenia docelowe dla diafiltracji mieszczą się w zakresie od 25 do 30 g/l.
- Przeprowadź diafiltrację w trybie recyrkulacji o stałej objętości (natężenie przepływu buforu równe natężeniu przepływu permeatu); ta metoda zazwyczaj zapewnia najbardziej wydajną wymianę buforu.
- Przeprowadź końcowe zatężanie. Nadmierne stężenie w razie potrzeby, aby zrekompensować wszelkie rozcieńczenia spodziewane podczas odzyskiwania i etapów formułowania.
- Odzyskaj produkt z systemu Pellicon® Capsule i TFF w sposób zapewniający pożądaną wydajność, jakość i stężenie. Rozsądnym podejściem do odzyskiwania jest depolaryzacja membrany, opróżnienie zbiornika zasilającego do pojemnika zbiorczego, a następnie przeprowadzenie wypierania buforu (z najwyższego punktu systemu, w dół przez kapsułę) lub recyrkulacji buforu z jedną minimalną objętością roboczą.2,3
- Usuń kapsułę i pozostałą część zwilżonej ścieżki przepływu razem z jednorazowego użytku systemu TFF, aby utrzymać ścieżkę przepływu zamkniętą, zmniejszając ryzyko narażenia operatora na płyn procesowy.
- Aby zwiększyć skalę, zwiększ powierzchnię proporcjonalnie do objętości wsadu, zachowując to samo znormalizowane natężenie przepływu wsadu, TMP i temperaturę.
Studium przypadku ADC Mimic
Z powodu toksyczności związanej z ADC, "mimetyki" ADC są często używane do badania ADC. Te mimetyki są nietoksyczne i mogą być traktowane tak samo jak cytotoksyczne ADC podczas koniugacji i oczyszczania.
Zastosowanie Pellicon® Capsule w przetwarzaniu ADC zostało zaprezentowane w badaniu zgłoszonym przez Czapkowskiego i wsp.4 Oczyszczony w kolumnie mimetyk ADC (~150 kDa) został użyty do oceny i porównania parametrów wydajności Pellicon® Capsule i kasety Pellicon® 3 z membraną Ultracel® 30 kDa. Roztwór mimetyku ADC został wzbogacony DMSO i poddany diafiltracji przy natężeniu przepływu 5 l/min/m2, TMP 15 psi i temperaturze pokojowej. Wyniki wskazują na skuteczny klirens DMSO z roztworu zasilającego ADC naśladującego zarówno format kapsułki, jak i kasety (Rysunek 6). Ponadto strumienie permeatu były stabilne podczas całego etapu diafiltracji dla obu filtrów, wydajność była wysoka i porównywalna, a poziomy agregatów były również podobne (Tabela 1).
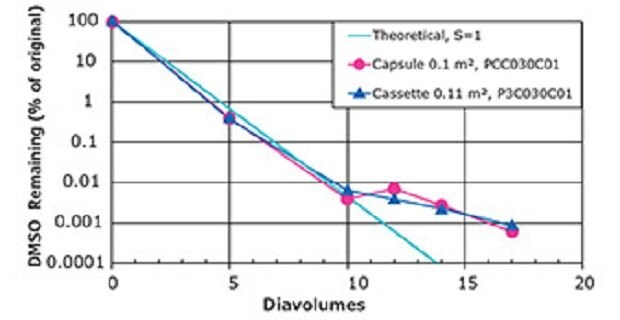
Rysunek 6.Usunięcie 6,8% DMSO przez diafiltrację 26-28 g/L ADC mimic. Dane z Czapkowski et al.4.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?