Flash NanoPrecipitation (FNP) - zasady i zastosowania w obrazowaniu medycznym i dostarczaniu leków
Leon Z. Wang, Robert K. Prud’homme*
Department of Chemical and Biological Engineering, Princeton University, Princeton, New Jersey, US
Material Matters™, 2020, 15.3
Sekcje artykułu
Wprowadzenie
Zasada Flash NanoPrecipitation (FNP) została po raz pierwszy opisana w 2003 roku przez Johnsona i Prud'homme'a jako nowatorska metoda generowania wysoce obciążonych nanocząstek poprzez szybkie mieszanie i proces wytrącania.1 Od tego czasu technologia FNP rozwinęła się, wpływając na różne dziedziny, od kapsułkowania leków po dostarczanie pestycydów. FNP to skalowalny proces mieszania, który wykorzystuje różne skale czasowe zarodkowania, agregacji i stabilizacji. W najbardziej podstawowej formie, wysoce hydrofobowa cząsteczka i amfifilowy polimer są rozpuszczane w mieszalnym z wodą rozpuszczalniku organicznym. Ten organiczny strumień jest następnie szybko mieszany z wodnym strumieniem antyrozpuszczalnika przy użyciu specjalnie zaprojektowanych turbulentnych komór mieszania. Podczas tego mieszania zachodzą konkurencyjne procesy kinetyczne: (1) zarodkowanie i agregacja hydrofobowej substancji czynnej, (2) adsorpcja sterycznego polimeru stabilizującego na agregacie, co ostatecznie zatrzymuje dalszy wzrost. Stosunek substancji aktywnej do polimeru kontroluje rozmiar; przy niewystarczającej ilości polimeru nanocząstki rosną zbyt duże, a przy nadmiarze polimeru stabilizującego mogą tworzyć się micele. Przy lub powyżej progowej intensywności mieszania (liczba Reynoldsa, Re), gdzie czas mieszania jest krótszy niż czas wzrostu nanocząstek, rozmiar nanocząstek nie zależy już od szybkości przepływu, a jedynie od składu strumienia.2 Kluczem do mieszania jest turbulencja, która jest skalowalna i która zasadniczo różni się od przepływów w urządzeniach mikroprzepływowych, które z natury wiążą się z niskimi liczbami Reynoldsa.
Ewolucja mieszalników i skalowalność
Oryginalna konstrukcja mieszalnika składała się z dwóch przeciwstawnych strumieni o równym pędzie, które zderzały się w cylindrycznej objętości mieszania. Wykorzystując ręczne strzykawki lub pompy strzykawkowe do napędzania strumieni, ten mieszalnik z ograniczonym strumieniem uderzeniowym (CIJ) umożliwiał produkcję małych partii do szybkiego przesiewania i opracowywania receptur (Rysunek 1). Stabilność rozmiaru nanocząstek po utworzeniu zależy od szybkości wzrostu w wyniku dojrzewania Ostwalda, która zależy od rozpuszczalności substancji czynnej w fazie roztworu.3 Ponieważ mieszalnik CIJ wymaga równych prędkości strumienia, wynikowy stosunek rozpuszczalnika do antyrozpuszczalnika wynosi 1:1. Stosunek antyrozpuszczalnika, a tym samym aktywną rozpuszczalność, można zmniejszyć, zbierając dane wyjściowe CIJ do kąpieli gaszącej. Zazwyczaj używamy objętości kąpieli gaszącej, aby uzyskać końcowe stężenie rozpuszczalnika na poziomie 10%. Liu i in. opracowali nową konstrukcję mieszalnika z czterema strumieniami mieszającymi wykorzystującymi styczny przepływ turbulentny (Rysunek 1). Nazwany mieszalnikiem z wieloma wlotami wirowymi (MIVM), każdy strumień w MIVM przyczynia się niezależnie do procesu mikromieszania.4
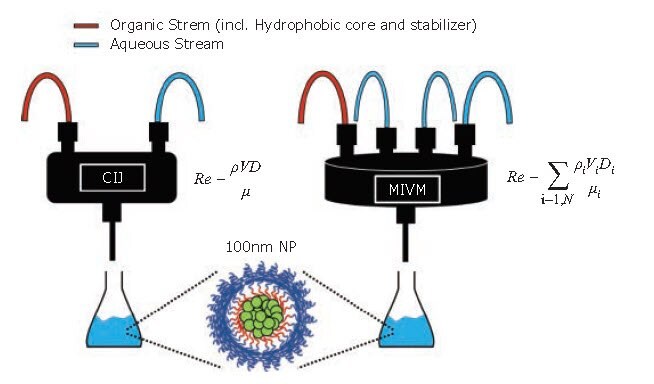
Rysunek 1.Schemat procesu FNP w różnych skalach. (Po lewej) Mieszalnik CIJ umożliwia syntezę wielu małych partii w krótkich odstępach czasu w celu sprawdzenia formulacji. (Po prawej) MIVM może skalować preparaty do produkcji litrów roztworów nanocząstek. (Równania dla liczby Reynoldsa, Re, zdefiniowane w ref. 1 i 4).
W przeciwieństwie do mieszalnika CIJ, momenty strumieni nie muszą być dopasowane do MIVM, co pozwala na większą elastyczność w formułowaniu nanocząstek. Na przykład, dwa różne rozpuszczalniki organiczne mogą być wykorzystywane w oddzielnych strumieniach - każdy zawierający inny API. Dodatkowo, jeśli na etapie mieszania dojdzie do wystarczającego rozcieńczenia substancji organicznej, nie jest wymagana dodatkowa kąpiel hartownicza - co pozwala na prawdziwie ciągły proces produkcji nanocząstek. Markwalter i in. rozszerzyli projekt MIVM poprzez opracowanie zmniejszonej wersji, która wymagała mniejszej ilości materiału na partię nanocząstek.5 Porównanie obok siebie urządzeń mieszających o różnej skali nie wykazało znaczących różnic w wielkości lub właściwościach cząstek, o ile stosowana jest wystarczająca intensywność mieszania.6 Porównania między mieszalnikami MIVM i CIJ pokazują, że rozmiary i rozkłady nanocząstek są identyczne powyżej progowej liczby Re (Rysunek 2B). Ślady dynamicznego rozpraszania światła (DLS) i obrazy TEM nanocząstek sformułowanych przy użyciu MIVM i CIJ również nie wykazują widocznych różnic w rozmiarze lub właściwościach (Rysunek 2A, 2C, 2D).6 Pozwala to na płynny proces rozwoju, w którym badania przesiewowe i preparaty na małą skalę są wykonywane przy użyciu mieszalnika CIJ, a następnie skalowane przy użyciu MIVM. Mieszalnik MIVM na dużą skalę jest obecnie wykorzystywany w firmie WuXi AppTec (Szanghaj) do produkcji nanocząstek leku przeciwmalarycznego o wielkości 250 nm z prędkością 2 l/min w partiach o objętości 300 l.
.

Rysunek 2.Porównanie formulacji nanocząstek metodą CIJ i MIVM. (A) Ślad DLS nanocząstek z rdzeniem z octanu witaminy E i stabilizatorem PS-b-PEG. Rozmiar nanocząstek jest niezależny od typu mieszalnika. (B) Względny rozmiar nanocząstek w zależności od liczby Reynoldsa mieszania dla preparatów CIJ i MIVM. Powyżej progowej liczby Reynoldsa wynoszącej 50000, wielkość nanocząstek jest niewrażliwa na szybkość przepływu. (C, D) Obrazy TEM nanocząstek CIJ i MIVM nie wykazują znaczących różnic między nanocząstkami wytworzonymi przez dwa typy mieszalników.
Wybór stabilizatora
Jak wspomniano wcześniej, stabilizator amfifilowy odgrywa kluczową rolę podczas tworzenia nanocząstek. W przypadku większości zastosowań FNP, wstępne badania przesiewowe zazwyczaj wykorzystują nierozkładalne kopolimery blokowe. Polistyren-blok-glikol polietylenowy (PS-b-PEG) jest wszechstronnym stabilizatorem do wielu zastosowań. Po włączeniu do nanocząstki, hydrofilowe łańcuchy PEG tworzą gęstą zewnętrzną koronę wokół hydrofobowego rdzenia. Ta gęsta warstwa PEG nadaje korzystne właściwości biologiczne, takie jak długi czas krążenia i penetracja śluzu.7 Zamiana części lub całości kopolimeru PEG na kwas poliakrylowy (PAA) lub metakrylan 2-(dimetyloamino) etylu (DMEMA) może nadać nanocząstce odpowiednio ujemne lub dodatnie ładunki powierzchniowe. Ponieważ ładunek powierzchniowy wpływa na biodystrybucję i klirens nanocząstek, dostrojenie ładunku powierzchniowego może pomóc w ukierunkowaniu nanocząstek na określone tkanki będące przedmiotem zainteresowania. W przypadku zastosowań wymagających biodegradowalnych nanocząstek, blok polistyrenu można zamienić na kwas polimlekowy (PLA) lub polikaprolakton (PCL).8 Degradacja hydrolityczna tych polimerów pozwala na powolne i długotrwałe uwalnianie leku z nanocząstek, a ostatecznie jego usunięcie. Rysunek 3 zawiera struktury chemiczne powszechnie stosowanych stabilizatorów kopolimerów blokowych. W przypadku globalnych zastosowań zdrowotnych koszty produkcji dyktują użycie tańszych materiałów podczas procesu formułowania. W tych systemach można stosować bardziej przystępne cenowo stabilizatory, w tym hydroksypropylometylocelulozę bursztynian octanu (HPMC-AS), lecytynę, zeinę lub kazeinę.9

Rysunek 3.Typowe stabilizatory polimerowe stosowane w FNP. Stosunkowo niedrogie kopolimery blokowe na bazie polistyrenu (A, B, C) są zwykle używane do prototypowania lub zastosowań ex-vivo. Biodegradowalne kopolimery (D, E) są wykorzystywane w zastosowaniach terapeutycznych.
Zastosowania w preparatach do podawania doustnego
Jednym z zastosowań FNP jest enkapsulacja leków hydrofobowych w celu poprawy biodostępności API. Klofazymina (CFZ) to hydrofobowa cząsteczka początkowo stosowana w leczeniu trądu, ale ostatnio okazała się również skuteczna w zwalczaniu zakażeń Cryptosporidium, głównej przyczyny biegunki w krajach rozwijających się. Jednak CFZ, w czystej postaci, cierpi z powodu powolnego rozpuszczania w przewodzie pokarmowym, a zatem nie nadaje się do szybkiego leczenia wymaganego w przypadku Cryptosporidium. Szybka nanoprecypitacja zapewnia zwiększoną rozpuszczalność i lepsze rozpuszczanie CFZ. Po kapsułkowaniu w procesie szybkiego wytrącania i stabilizacji FNP, hydrofobowa cząsteczka aktywna może zostać wychwycona i zachowana w postaci amorficznej. Dodatkowo, niewielki rozmiar nanocząstek FNP zwiększa powierzchnię właściwą, co zwiększa szybkość rozpuszczania leku. Oba czynniki poprawiają rozpuszczalność i biodostępność CFZ po podaniu doustnym. W pracy wykonanej przez Zhang i wsp, CFZ został zamknięty w nanocząstkach przy bardzo wysokiej skuteczności enkapsulacji (92%) przy użyciu różnych tanich stabilizatorów.9 Ślady DSC potwierdziły, że enkapsulacja w nanocząstki zachowała amorficzny stan CFZ (Rysunek 4A) nawet po przetworzeniu NPs w suchy proszek poprzez suszenie rozpyłowe lub liofilizację. Po inkubacji w symulowanym płynie żołądkowym i jelitowym, nanocząstki CFZ wykazywały 50-90x wyższe poziomy przesycenia i całkowite rozpuszczenie po 6 godzinach. Feng i wsp. wykazali również, że zdolność FNP do stabilizacji amorficznej postaci API i poprawy rozpuszczania nie była unikalna dla CFZ.10 Lumefantryna (LMN) to kolejny hydrofobowy API, który jest skutecznym lekiem na malarię. Podobnie jak klofazymina, lumefantryna również cierpi z powodu słabej biodostępności i wchłaniania w przewodzie pokarmowym. W badaniu LMN została zamknięta w nanocząsteczkach przy użyciu niedrogich naturalnych polimerów. Podobnie jak w poprzednim badaniu z CFZ, FNP wykazał zdolność do tłumienia krystalizacji LMN i poprawił rozpuszczanie w symulowanym płynie jelitowym o ponad 2 rzędy wielkości (Rysunek 4B). Amorficzna postać nanocząstek zmniejszyła również różnicę między rozpuszczaniem w płynach jelitowych w stanie karmionym i na czczo. Formulacja nanocząstek może zmniejszyć wrażliwość uwalniania na warunki środowiskowe, w tym wysoką temperaturę lub wilgotność, w porównaniu z tradycyjnymi dyspersjami suszonymi rozpyłowo tego samego API.11
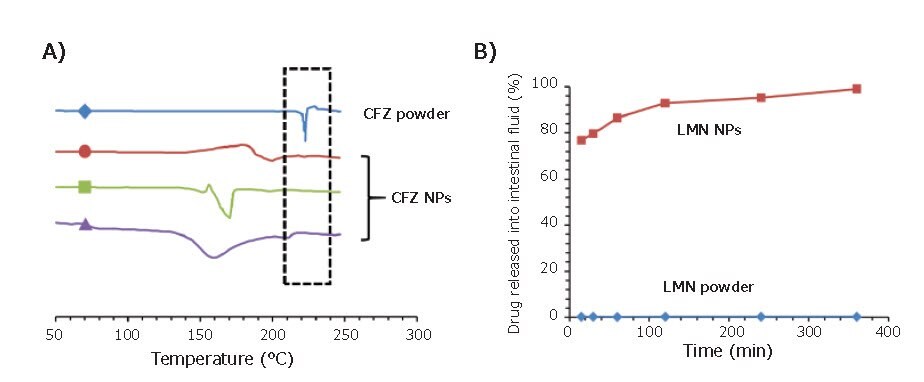
Rysunek 4.Zastosowania FNP w enkapsulacji doustnych środków terapeutycznych. (A) Ślad DSC trzech formulacji nanocząstek klofazyminy. Proszek CFZ wykazuje pik krystalizacji w temperaturze 22 °C, podczas gdy preparaty nanocząstek mogą zachować CFZ w stanie amorficznym. (B) Testy uwalniania leku z preparatów LMN w symulowanym płynie jelitowym. Nanocząstki wykazują prawie pełne uwalnianie po 2 godzinach, podczas gdy proszek LMN wykazuje <1% leku w roztworze.
Zastosowania w obrazowaniu medycznym
Środki kontrastowe są powszechnie stosowane w diagnostyce medycznej, aby umożliwić bardziej ukierunkowane i czułe obrazowanie. Powszechnie stosowane środki kontrastowe, takie jak FDG do PET, są bezpośrednio wstrzykiwane pacjentowi, a zatem muszą być rozpuszczalne w wodzie. FNP umożliwia enkapsulację związków nierozpuszczalnych w wodzie, otwierając drzwi dla wielu wcześniej niedostępnych hydrofobowych środków kontrastowych. Co więcej, proces FNP wyróżnia się w generowaniu wysoce obciążonych nanocząstek, które mogą drastycznie poprawić czułość obrazowania poprzez stężenie środków kontrastowych w rdzeniu nanocząstki. W jednym z przykładów, barwniki na bazie ftalocyjaniny są enkapsulowane przy 35% obciążeniu rdzenia przy użyciu stabilizatora PS-b-PEG.12 Przy tych wysokich stężeniach rdzenia, nanocząstki mogą być stosowane do obrazowania fotoakustycznego wspomaganego kontrastem. Lu i wsp. wykorzystali obrazowanie fotoakustyczne do zbadania biodystrybucji nanocząstek w mysim modelu guza.13 Ostre i zdefiniowane widmo absorbancji barwnika organicznego umożliwia obrazowanie multipleksowe, w którym sygnały są zbierane przy różnych długościach fal i dekonwoluowane w celu wygenerowania połączonego obrazu. Korzystając z tej technologii, można jednocześnie wizualizować sygnał nanocząstek i natlenowanej/odtlenowanej krwi (Rysunek 5A). Bardziej konwencjonalne obrazowanie fluorescencyjne może być również wykorzystywane do śledzenia biodystrybucji, jak pokazano na Rysunku 5B. Na tym obrazie żelowych mikrocząstek zawierających fluorescencyjne nanocząstki, rozmiar mikrocząstek określa wychwytywanie w płucach. Pinkerton i wsp. rozszerzyli diagnostyczne zastosowania FNP do MRI poprzez enkapsulację nanokryształów na bazie tlenku żelaza (IONC).14 Ponieważ silny sygnał T2 MRI jest wysoce zależny od wielkości i gęstości IONC, małe skupiska IONC zostały sformułowane w nanocząstki o masie do 25%, przy użyciu FNP w jednoetapowym procesie montażu. Hydroksy-końcowy PS-b-PEG został użyty jako stabilizator w celu zwiększenia wychwytu przez makrofagi wątrobowe. W ortotopowym mysim modelu NSCLC, te nanocząstki IONCs były w stanie zwiększyć kontrast MRI wątroby i umożliwić wykrywanie niewidocznych przerzutów nowotworowych (Rysunek 5C).
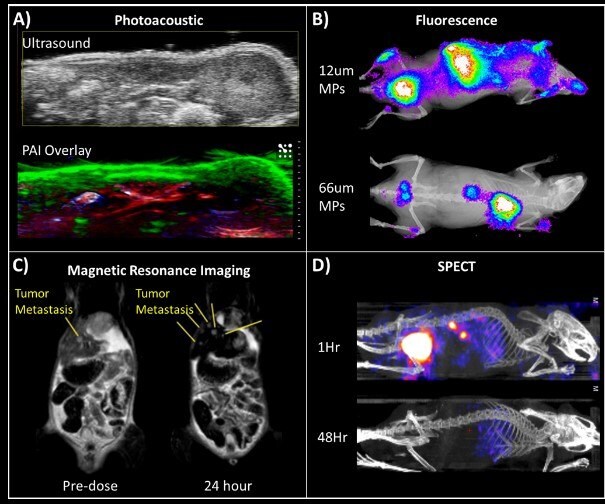
Rysunek 5.Zastosowania nanocząstek FNP w obrazowaniu biologicznym. (A) Obrazowanie multipleksowe z wykorzystaniem tomografii fotoakustycznej na modelu mysim pokazuje akumulację nanocząstek w skórze (zielony). Można również wizualizować natlenowaną i odtlenowaną krew (odpowiednio czerwony i niebieski). (B) Fluorescencja nanocząstek otoczonych barwnikiem. Biodegradowalne mikrocząstki zawierające te nanocząstki wstrzyknięto myszom. Mniejsze cząstki gromadziły się w wątrobie, podczas gdy większe były śledzone do płuc. (C) Obrazowanie MRI przerzutów do wątroby w mysim modelu guza przy użyciu nanocząstek otoczonych nanokryształami na bazie tlenku żelaza (IONC). Żółte linie wskazują lokalizacje przerzutów do wątroby przed i po wstrzyknięciu nanocząstek IONC. Nanocząsteczki utrzymują się w zdrowych tkankach (pojawiając się na czarno) - generując kontrast, który pozwala na lepszą wizualizację przerzutów. (D) Obrazowanie SPECT nanocząstek znakowanych 111In pokazuje biodystrybucję i profil klirensu w czasie.
Użycie obrazowania PET lub SPECT opartego na radioznacznikach może dodatkowo zwiększyć czułość i rozdzielczość obrazowania.15 Wymagana jest synteza nanocząstek z możliwością "załadowania" tych znaczników w szybki i wydajny sposób. Jednym z podejść jest sprzężenie cząsteczki chelatującej na hydrofilowym końcu stabilizatora. Radiotracery mogą być następnie wychwytywane do tych chelatorów w celu utworzenia nanocząstek aktywnych w SPECT/PET. W badaniu SPECT do chelatowania 111In wykorzystano DPTA (kwas dietylenotriaminopentaoctowy) sprzężony z PS-b-PEG. Nanocząstki te zostały następnie wykorzystane w badaniu farmakokinetycznym w celu ilościowego określenia mechanizmu klirensu i szybkości klirensu nanocząstek (Rysunek 5D). Niedawno Lu i wsp. zademonstrowali metodę radioznakowania nanocząstek pokrytych PEG z 64-Cu do stosowania w PET, która ma przewagę nad koniugacją powierzchniową. Enkapsulacja chelatora metalu na bazie ftalocyjaniny następuje najpierw, gdy bardzo hydrofobowa ftalocyjanina znajduje się w rdzeniu nanocząstki. W późniejszym czasie nanocząstki są "aktywowane PET" - aktywny PET Cu-64 jest ładowany do rdzenia poprzez szybki i prosty etap inkubacji.16 To radioznakowanie rdzenia minimalizuje potencjalne efekty poza celem wynikające z ekspozycji chelatorów na powierzchni nanocząstki.
Zastosowania w celowaniu do określonych typów komórek
Ulepszone celowanie nanocząstek do pożądanych narządów lub typów komórek może zarówno zwiększyć skuteczność terapii, jak i czułość obrazowania diagnostycznego. Osiąga się to poprzez dołączenie ligandów celujących na zewnątrz nanonośników. Te ligandy celujące obejmują przeciwciała, peptydy, cukry i małe cząsteczki, które specyficznie wiążą się z receptorem na docelowej komórce. W jednym z przykładów, nanocząsteczki sprzężone z mannozydami były w stanie specyficznie wiązać się z receptorem mannozy makrofagów J774E (Rysunek 6A).17 Ta forma specyficznego wiązania z komórkami prezentującymi antygen może rozszerzyć możliwości szczepionek opartych na nanocząsteczkach. W dziedzinie onkologii FNP wykorzystano do sformułowania nanocząstek ukierunkowanych na kwas foliowy, umożliwiających lokalizację w komórkach nowotworowych KB (Rysunek 6B). We współpracy z Janssen Pharmaceutics, Elias i wsp. wykazali, że białka rusztowania oparte na konsensusowej domenie ludzkiej fibronektyny, zwane centrynami, mogą być również stosowane w terapiach ukierunkowanych na nanocząsteczki. Centryryny ukierunkowane na EGFR zostały sfunkcjonalizowane na nanocząstkach PS-b-PEG i z powodzeniem zlokalizowane na komórkach raka piersi HER2 (Rysunek 6C).
O ile w większości badań najpierw formułowano nanocząstki, a następnie modyfikowano powierzchnię nanocząstek, funkcjonalizacja może również nastąpić przed utworzeniem nanocząstek poprzez bezpośrednią reakcję ligandu celującego z polimerem stabilizującym. Modyfikacja polimeru przed FNP pozwala na precyzyjne ilościowe określenie procentu funkcjonalizacji na powierzchni nanocząstek. Co więcej, dostrajanie sfunkcjonalizowanych powierzchni odbywa się poprzez łączenie zmodyfikowanego polimeru ze znanymi porcjami niezmodyfikowanego polimeru podczas FNP. W jednym z przykładów hormon LHRH został zmodyfikowany na końcu polimeru PS-b-PEG, a następnie użyty do sformułowania nanocząstek FNP o różnym stopniu funkcjonalizacji.18 In vitro wyniki wykazały silny wychwyt nanocząstek przez komórki raka piersi MS578T (Rysunek 6D).
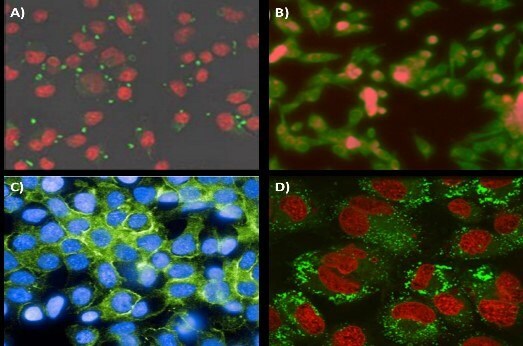
Rysunek 6.Ukierunkowane zastosowanie nanocząstek FNP. (A) Ukierunkowana na mannozyd lokalizacja nanocząstek do receptora mannozy makrofagów J774E. Koniugacja mannozydu do zewnętrznej korony nanocząstek PEG. Nanocząstki są wizualizowane na zielono, a komórki na czerwono. (B) Nanocząstki zmodyfikowane kwasem foliowym celujące w komórki linii nowotworowej KB. Fluorescencja nanocząstek jest pokazana na czerwono, podczas gdy komórki są zabarwione na zielono. (C) Rusztowanie Centyrin celujące w receptory GFR na komórkach linii HER2. (D) Wchłanianie nanocząstek 80 nm z powierzchniowo sprzężonym hormonem uwalniającym hormon luteinizujący (LHRH) do komórek raka piersi MS578T. Nanocząstki i komórki są wizualizowane odpowiednio na zielono i czerwono.
Zastosowania w enkapsulacji substancji czynnych rozpuszczalnych w wodzie
Chociaż FNP dobrze sprawdza się w enkapsulacji hydrofobowych API o log P >5, wiele mniej hydrofobowych leków może być również enkapsulowanych. Obecnie naukowcy badają dwa podejścia do rozszerzenia możliwości FNP w zakresie enkapsulacji hydrofilowych API. W odwróconej nanoprecypitacji Flash (iFNP), wytrącanie hydrofilowej substancji czynnej następuje przy użyciu organicznego strumienia antyrozpuszczalnika. W przeciwieństwie do tradycyjnej nanocząstki FNP, ta "odwrócona" nanocząstka ma hydrofobowe końce skierowane na zewnątrz i hydrofilowe ogony skierowane do wewnątrz. W drugim etapie powlekania FNP, hydrofilowy polimer jest powlekany na nanocząstkę iFNP w celu przeniesienia jej do fazy wodnej (Rysunek 7A).19 Inne podejście do enkapsulacji hydrofilowych API obejmuje wykorzystanie hydrofobowego parowania jonów (HIP). Poprzez wprowadzenie przeciwjonu do pary z hydrofilowym API elektrostatycznie, skutecznie wyłączając naładowane grupy - umożliwiając wynikową parę jonów do wytrącenia podczas FNP. Gindy i wsp. wykorzystali tę metodę do sparowania jonowego i enkapsulacji siRNA za pomocą kationowego lipidu z wydajnością większą niż 70% (Rysunek 7B).21 Ristroph i wsp. dokonali przeglądu enkapsulacji peptydów i małocząsteczkowych API przez HIP.21
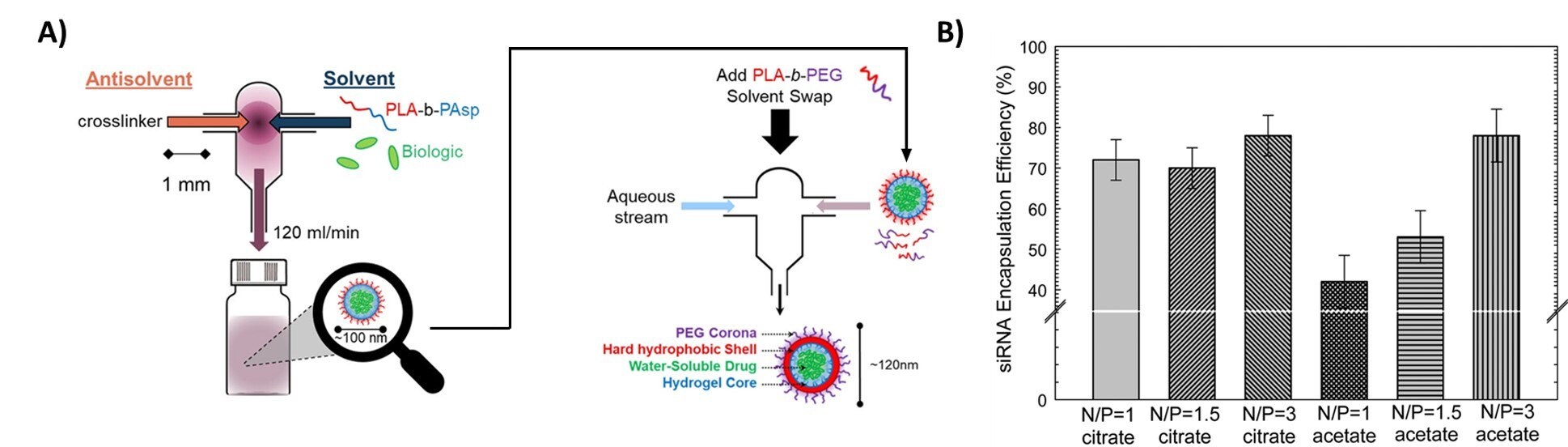
Rysunek 7.Enkapsulacja hydrofilowych substancji czynnych (A) Procedura iFNP. Wytrącanie substancji biologicznej lub innej hydrofilowej substancji czynnej następuje poprzez zmieszanie z organicznym nierozpuszczalnikiem. Powstała odwrócona nanocząstka jest następnie powlekana drugim polimerem w celu utworzenia nanocząstki dyspergującej w wodzie. Powielono za zgodą z referencji 20, prawa autorskie 2014 ACS Publishing. (B) Enkapsulacja siRNA przy użyciu parowania ładunków. Neutralizacja anionowego siRNA przez kationowe lipidy pozwala na tworzenie nanocząstek siRNA o bardzo wysokiej wydajności enkapsulacji. Powielono za zgodą z referencji 21, prawa autorskie 2019 Royal Society of Chemistry.
Wnioski
Nanomedycyna stale się zmienia, wraz z postępem w technikach formułowania i terapiach. Platforma FNP zapewnia technikę produkcji próbek laboratoryjnych na małą skalę do badań i ma prostą ścieżkę do produkcji komercyjnej na dużą skalę. Ma zastosowanie do szerokiej gamy substancji czynnych, od substancji hydrofobowych po rozpuszczalne substancje czynne, które stają się hydrofobowe dzięki parowaniu jonowemu, po rozpuszczalne oligonukleotydy, peptydy i białka dzięki odwrotnej FNP. FNP, jako technologia platformowa, również stale ewoluuje, zarówno w celu rozszerzenia zastosowań, jak i ulepszenia samego procesu. W niniejszym przeglądzie przedstawiono tylko wybrane zastosowania biomedyczne, ale mamy nadzieję, że otworzy on drzwi dla większej liczby innowacji w terapiach i diagnostyce opartych na nanocząstkach. Samouczek wideo na temat działania mieszalników CIJ i MIVM do tworzenia nanocząstek FNP został opublikowany.22
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?