NanoFabTx™: Platforma mikroprzepływowa dla szczepionek mRNA
Ben Knappett1, Richard Gray1, Zhen Ye2, Rajiv Kumar2, Elizabeth Aisenbrey2, Nicolynn Davis2
1Dolomite Microfluidics, 2Merck
Pandemia COVID-19 znacznie przyspieszyła badania nad szczepionkami, z mRNA na czele tych wysiłków. Aby szczepionki mRNA były skuteczne, niezbędny jest nośnik, który może dostarczyć szczepionkę do miejsca docelowego i chronić mRNA przed szybką degradacją w organizmie. Wymóg ten doprowadził do opracowania wielu nośników na bazie lipidów, znanych również jako nanocząstki lipidowe (LNP) lub liposomy. Podczas gdy konwencjonalna produkcja nośników na bazie lipidów wiąże się z długotrwałą optymalizacją metodą prób i błędów, alternatywne podejścia wykorzystujące mikroprzepływy mogą usprawnić wczesny etap opracowywania szczepionek. Nasze zestawy odczynników i urządzeń mikroprzepływowych NanoFabTx™ zapewniają gotową do użycia platformę do badań przesiewowych wielu preparatów, a ostatecznie syntezy mRNA lub liposomów otoczonych lekami do oceny przedklinicznej.
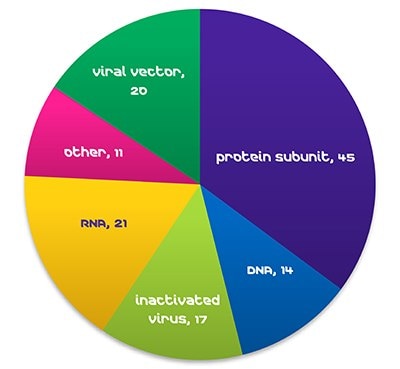
Rysunek 1. Szczepionki przeciwko COVID-19 w fazie badań klinicznych, WHO, 29 października 2021 r.Globalne zapotrzebowanie na szczepionki gwałtownie rośnie, z >25% rocznym wzrostem dawek w stosunkowo normalnych czasach (WHO, 2019). Pojawienie się nowych wirusów, takich jak Ebola, MERS, SARS i obecna pandemia COVID-19, prowadzi do dramatycznego wzrostu popytu i silnej presji na skrócenie czasu opracowywania szczepionek. Pod koniec października 2021 r. szczepionki RNA stanowiły 17% szczepionek przeciwko COVID-19 w fazie rozwoju klinicznego (WHO).
Czym są szczepionki mRNA?
W przeciwieństwie do tradycyjnych szczepionek, które często wykorzystują osłabioną lub zabitą formę patogenu, chemicznie syntetyzowane szczepionki mRNA (lub informacyjny RNA) niosą ze sobą tylko tyle informacji, aby nauczyć nasze komórki wytwarzania niewielkiej części patogenu. Gdy fragment patogenu zostanie wyprodukowany przez nasze komórki, nasz układ odpornościowy rozpoznaje, że nie należy on do nich i wyzwala odpowiedź immunologiczną, która chroni nas przed przyszłymi infekcjami. Nie jest możliwe, aby nasze komórki wytworzyły cały patogen ze szczepionki mRNA, co zwiększa bezpieczeństwo.
Dodatkowo stwierdzono, że szczepionki mRNA generują niezawodną odpowiedź immunologiczną i są dobrze tolerowane przez zdrowe osoby z niewielką liczbą skutków ubocznych. Ponieważ szczepionki mRNA mogą być tworzone w laboratorium i nie wymagają hodowli komórkowej, produkcja jest szybsza i bardziej ustandaryzowana, co może potencjalnie poprawić reakcję na pojawiające się epidemie.
RNA jest delikatną cząsteczką i w stanie wolnym uległby rozkładowi w organizmie w wyniku naturalnych procesów enzymatycznych. Skuteczne dostarczanie mRNA do komórek jest zatem kluczowym wyzwaniem w opracowywaniu szczepionek mRNA. Zamknięcie mRNA w nośnikach lipidowych (liposomach i LNP) jest idealnym sposobem na zapewnienie, że szczepionka mRNA może z powodzeniem dostać się do komórek i zostać dostarczona do cytoplazmy (Rysunek 2).
Dostarczanie szczepionki mRNA za pomocą nośników lipidowych
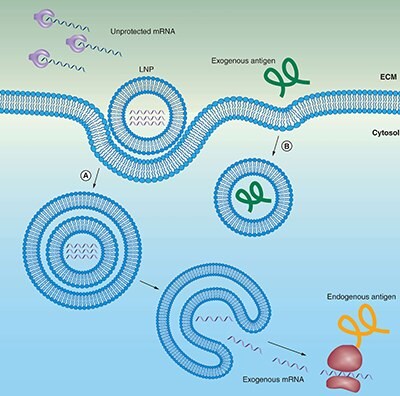
Rysunek 2.Nośniki lipidowe (liposomy) chronią mRNA przed degradacją i ułatwiają endocytozę i ucieczkę endosomalną.
(A) mRNA może być zamknięty w liposomach w celu ochrony przed degradacją enzymatyczną. Dodatnio naładowane liposomy sprzyjają lokalizacji mRNA na ujemnie naładowanej błonie komórkowej, w tym późniejszej endocytozie do cytozolu. Aby dotrzeć do cytoplazmy w celu transkrypcji, mRNA musi wydostać się zarówno z endosomu, jak i nośnika lipidowego.
(B) Szczepionki oparte na białkach zewnątrzkomórkowych są endocytowane w podobny sposób, ale nie muszą wydostawać się z endosomu, aby mogły być prezentowane na MHCII.
Cechy nośników lipidowych:
- Nanonośniki lipidowe ściśle przypominają strukturę błon komórkowych
- Mogą być stosowane do dostarczania zarówno leków hydrofobowych, jak i hydrofilowych
- Naturalny skład i nano-rozmiary pozwalają im być skutecznymi nośnikami, docierającymi do wewnętrznych tkanek i komórek w celu zdeponowania aktywnych składników farmaceutycznych, kwasów nukleinowych, białek, szczepów DNA lub RNA
- b>
- Dzięki dekoracji powierzchni ligandami i/lub współdostarczaniu z adiuwantami, nośniki lipidowe mogą być ukierunkowane na pożądane typy komórek
.Wybór lipidów jest kluczowym czynnikiem dla dostarczania mRNA i wymaga szeregu kroków w celu optymalizacji określonego składu lipidów, rozmiaru, stabilności, ładunku, funkcjonalizacji powierzchni, a także enkapsulacji mRNA i skuteczności uwalniania. Szczepionki Moderna i Pfizer oparte na lipidach mRNA pokazują znaczenie tej technologii w epidemiologicznej walce z chorobą COVID-19.
Mikrofluidy dla usprawnionej i wysokoprzepustowej optymalizacji lipidów
Nośniki lipidowe były konwencjonalnie wytwarzane metodami wsadowymi (Rysunek 3B), poprzez powolne dodawanie roztworu lipidów do mieszanej fazy wodnej. Podejście to zapewnia słabą kontrolę wielkości powstałego LNP, niską wydajność enkapsulacji i wymaga ponownej walidacji za każdym razem, gdy proces jest skalowany z laboratorium do instalacji pilotażowej do pełnej produkcji. Metody mikroprzepływowe (Rysunek 3A) mogą pomóc w każdym z tych obszarów.

Rysunek 3. Schematyczne przedstawienie procesu tworzenia liposomów.
(A) mikroprzepływowy proces samoorganizacji liposomów
(B) standardowa procedura wstrzykiwania etanolu w partiach
Zalety mikroprzepływów dla enkapsulacji nanocząstek mRNA:
- Skrócenie czasu realizacji
- Zwiększenie wydajności i jakości
- Zmniejszenie kosztów rozwoju<
- Wysoka wydajność
- Możliwość automatyzacji i łatwego skalowania do produkcji
Jak to działa?
Mikroprzepływowe metody syntezy bezpośrednio mieszają fazę lipidowo-organiczną z wodnym roztworem mRNA w małym mikserze, gdzie następuje szybkie i powtarzalne tworzenie nośnika lipidowego i enkapsulacja RNA. Ostatnio opracowano zautomatyzowane rozwiązania mikroprzepływowe. Na przykład Dolomite Automated Nanoparticle System (ANPS) zwiększa produktywność i skraca czas opracowywania poprzez automatyczne generowanie wielu próbek w różnych warunkach procesowych. Po zoptymalizowaniu, system może pracować w sposób ciągły, wytwarzając duże ilości materiału do badań in vitro i in vivo.
Wprowadzenie do mikroprzepływowego systemu NanoF<abTx™ zestawy do optymalizacji nośników lipidowych
Zestawy urządzeń i odczynników do nanoformulacji NanoFabTx™ dobrze nadają się do opracowywania szczepionek mRNA, ponieważ rozwiązują dwa główne wyzwania związane z ich opracowywaniem: (1) wybór i optymalizacja formulacji lipidowej oraz (2) skalowalne metody montażu.
Urządzenie NanoFabTx™ i zestawy odczynników oferują:
- Usprawnioną strategię badań przesiewowych i wyboru pożądanych formulacji bez potrzeby długotrwałej optymalizacji metodą prób i błędów
- Wybór różnych formulacji lipidowych, które zostały zbadane i wybrane do dostarczania leków/RNA
- Zestaw urządzeń mikroprzepływowych do tworzenia liposomów otoczonych mRNA o wąskiej dyspersji wielkości i wysokiej spójności między partiami
- Kompleksowe protokoły, wstępnie zmontowane rozdzielacze mikroprzepływowe i wymagane akcesoria kompatybilne z systemem mikroprzepływowym Dolomite, pompami strzykawkowymi lub tradycyjnymi metodami nanoprecypitacji
Kontrola rozmiaru i składu przy użyciu zestawu NanoFabTx™ mikroprzepływowy zestaw nanourządzeń
Zestaw NanoFabTx™ może być używany do testowania różnych parametrów formulacji bez długotrwałej optymalizacji metodą prób i błędów. Rozmiar liposomu można precyzyjnie dostosować poprzez optymalizację parametrów, takich jak współczynnik szybkości przepływu (FRR) (Rysunek 4A). Korzystając z zestawu NanoFabTx™ microfluidic nano device kit, można syntetyzować liposomy o stałym rozmiarze, niezależnie od składu lub stężenia lipidów (Rysunek 4B). To szybkie badanie przesiewowe lipidów jest niezbędne do opracowania szczepionki na wczesnym etapie i często nieosiągalne przy użyciu konwencjonalnych metod nawilżania / wytłaczania błon lipidowych.
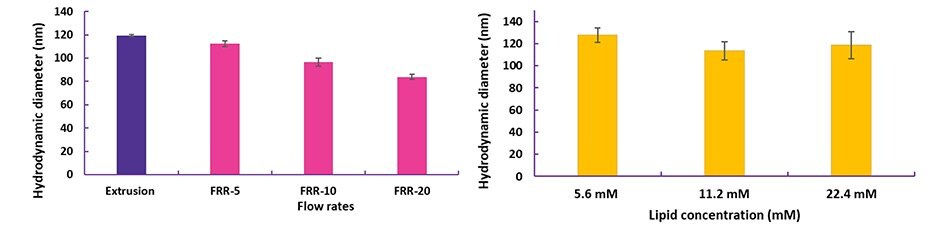
Rysunek 4. Optymalizacja liposomów przygotowanych za pomocą zestawu mikroprzepływowego NanoFabTx™
(A) Liposomy PEGylowane enkapsulujące małą cząsteczkę syntetyzowano przy różnych stosunkach szybkości przepływu (FRR, organiczny:wodny).
(B) Liposomy kationowe enkapsulujące siRNA syntetyzowano przy różnych całkowitych stężeniach lipidów. Rozmiary liposomów mierzono za pomocą dynamicznego rozpraszania światła (DLS).
Wewnątrzkomórkowe dostarczanie liposomów zawierających siRNA przygotowanych z użyciem Nano Fab Tx™
Dostarczanie i wychwyt liposomów zawierających siRNA opracowanych przy użyciu zestawów odczynników i urządzeń NanoFabTx™ zostały ocenione w wielu zastosowaniach. Po pierwsze, wychwyt kationowych liposomów zawierających fluorescencyjnie znakowany FAMsiRNA wykazano w komórkach raka płuc A549 in vitro (Rysunek 5). Nie zaobserwowano wychwytu gołego FAMsiRNA. Dla porównania, ponad 90% komórek traktowanych liposomem zawierającym FAMsiRNA (Lipo- FAMsiRNA) wykazuje silny sygnał fluorescencyjny wskazujący na silny wychwyt FAMsiRNA po skompleksowaniu z kationowymi liposomami.
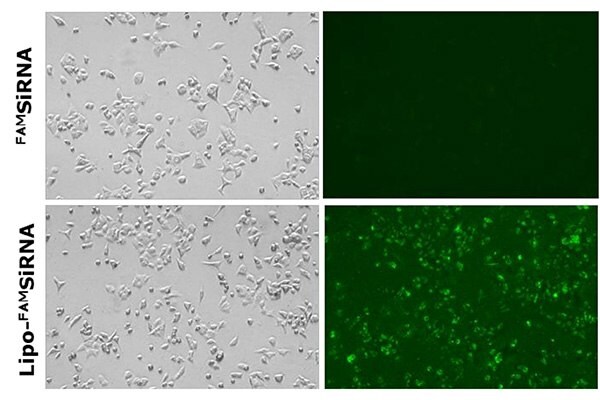
Rysunek 5.Dostarczanie nagiego FAMSiRNA (górny panel) i FAMSiRNA skompleksowanego z kationowym liposomem (dolny panel) w linii komórkowej raka płuc A549. Wszystkie obrazy zostały uzyskane przy użyciu mikroskopu fluorescencyjnego.
Oceniono również dostarczanie siRNA i jego zdolność do wyciszania komórek HeLa znakowanych GFP in vitro. Liposomy o różnych stosunkach N/P (azot (N) DOTAP/fosforan (P) siRNA) przygotowano przy użyciu zestawu odczynników i urządzeń NanoFabTx™ i sprawdzono pod kątem optymalnej wydajności transfekcji. Stosunki N/P wynoszące 7,5 i 5 skutkowały podobną skutecznością transfekcji i zmniejszoną ekspresją GFP o około 40% w porównaniu z nieleczonymi komórkami kontrolnymi. Ponadto, aby zoptymalizować skuteczność eliminacji GFP-siRNA, sprawdzono trzy różne sekwencje siRNA. Dwie sekwencje (siGFP-126 i siGFP-240) spowodowały 40-50% wyciszenie (zmniejszoną ekspresję GFP) w komórkach GFP-HeLa (Rys. 6C&D). Wyniki te sugerują, że liposomy przygotowane przez platformę NanoFabTx™ nie tylko dostarczyły siRNA do komórek GFP-HeLa, ale także skutecznie wyciszyły docelowy gen. Dodatkowo, bezpośrednie porównanie metod przygotowania liposomów (mikroprzepływy vs. wytłaczanie) wykazało podobną skuteczność transfekcji, chociaż mikroprzepływy okazały się łatwiejsze niż pracochłonna metoda wytłaczania.
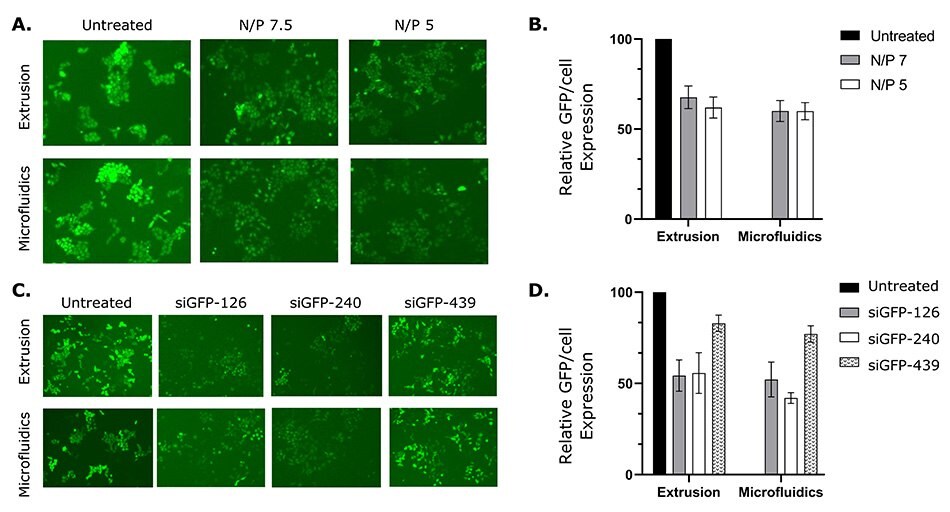
Rysunek 6.Liposomy zawierające siRNA przygotowane z użyciem odczynnika NanoFabTx™ i zestawów urządzeń wyciszają ekspresję GFP w komórkach GFP-HeLa.
(A) Reprezentatywne obrazy fluorescencyjne i
(B) względna ekspresja GFP/komórkę (ekspresja GFP/komórkę względem nieleczonej kontroli) komórek GFP-HeLa traktowanych liposomem-siRNA przy różnych stosunkach N/P.
(C) Reprezentatywne obrazy fluorescencyjne i
(D) względna ekspresja GFP/komórkę komórek GFP-HeLa traktowanych liposomem-siRNA skompleksowanym z różnymi sekwencjami siRNA.
NanoFab Tx™ w rozwoju szczepionek<
Demonstrują one możliwości zestawów odczynników i urządzeń NanoFabTX™ w syntezie różnych liposomów do dostarczania RNA i innych środków terapeutycznych. Elastyczność platformy NanoFabTX™ umożliwia optymalizację poprzez badanie parametrów, takich jak skład i stosunek szybkości przepływu, aż do osiągnięcia pożądanego rozmiaru liposomu, enkapsulacji leku i ukierunkowanego dostarczania. MilliporeSigma i Dolomite nawiązały współpracę przy opracowywaniu rozwiązań mikroprzepływowych do syntezy liposomów za pomocą naszych wstępnie zmontowanych zestawów urządzeń NanoFabTX™ i zoptymalizowanych protokołów. Zestawy te pozwalają na szybką syntezę dobrze zdefiniowanych cząstek, mogą być dostosowane do leków terapeutycznych, takich jak mRNA i rozwój szczepionek, i mogą być skalowane przy użyciu Zautomatyzowanego systemu nanocząstek Dolomite (ANPS) do oceny przedklinicznej. Nowy ANPS, oprócz zestawów NanoFabTX™, pozwala użytkownikom zautomatyzować eksperymenty w celu wytworzenia małych próbek liposomów, nanocząstek lipidowych i innych rodzajów nanocząstek organicznych, aby sprostać następującym kluczowym wyzwaniom w wakcynologii:
- Ukierunkowana ewolucja szczepów bakterii dla plazmidów
- Ukierunkowana ewolucja optymalnego szczepu drożdży/bakterii do produkcji szczepionek
- Badania przesiewowe przeciwciał
- Rozwój i produkcja preparatów adiuwantowych
- Rozwój i produkcja cząsteczek dostarczających szczepionkę
Zestawy odczynników NanoFabTx™
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?