Podejścia do projektowania nanonośników na bazie lipidów do dostarczania mRNA
Xing Duan, Xiangrong Song*
Department of Critical Care Medicine, Department of Clinical Pharmacy, Frontiers Science Center for Disease-related Molecular Network, State Key Laboratory of Biotherapy and Cancer Center, West China Hospital, Sichuan University, Chengdu, 610041, China.
Wprowadzenie
Różne nośniki, w tym nanonośniki na bazie lipidów (LNP), nanocząstki polimerowe, nanoemulsje kationowe (CNE) i inne systemy dostarczania, zostały zsyntetyzowane w celu ochrony mRNA przed degradacją przez powszechnie występującą RNazę i mają kluczowe znaczenie dla rozwoju leków mRNA. LNP są najbardziej znanymi systemami dostarczania leków mRNA ze względu na ich wysoką skuteczność i niską toksyczność. Dwie szczepionki mRNA oparte na LNP, BNT162b2 (od Pfizer BioNTech) i mRNA-1273 (od Moderna), zostały zatwierdzone przez amerykańską FDA do kontrolowania pandemii SARS-CoV-2.1 Ogólnie rzecz biorąc, LNP składają się z czterech składników: kationowych lub jonizowalnych lipidów, neutralnych fosfolipidów, cholesterolu i lipidów modyfikowanych glikolem polietylenowym. Lipidy kationowe zostały po raz pierwszy użyte do skonstruowania systemów dostarczania LNP i były szeroko stosowane do dostarczania leków genowych, w tym DNA, siRNA i plazmidów i in. Jednak jego rozwój był ograniczony przez stosunkowo niską skuteczność w dostarczaniu mRNA i pewne toksyczne skutki uboczne. Dlatego też prawidłowe wykorzystanie lipidów kationowych do opracowania skutecznych LNP jest istotnym problemem naukowym, który należy pilnie zbadać.
Ionizowalne lipidy są integralną częścią bezpieczeństwa i skuteczności LNP i mają kluczowe znaczenie w określaniu ładowania, ekspresji i ukierunkowania mRNA.2 Na przykład, jonizowalnymi lipidami stosowanymi w Patisiran, BNT162b2 i mRNA-1273 są DLin-MC3-DMA (MC3), ALC-0315 i SM-102. Nadal jednak należy wyjaśnić, w jaki sposób struktura chemiczna jonizowalnych lipidów wpływa na skuteczność dostarczania mRNA przez LNP. Jednocześnie opracowanie skutecznych LNP wymaga skrupulatnego zaprojektowania formulacji i wyboru odpowiednich dróg podania. Dlatego w tym przeglądzie badamy, jak prawidłowo stosować lipidy kationowe, opracowywać wysoce wydajne lipidy jonizowalne, prowadzić innowacyjne badania nad przepisywaniem LNP i wybierać drogę podawania LNP.
Liposomy kationowe do mRNA
Liposomy są uważane za najwcześniejsze nanocząstki lipidowe, ponieważ składają się z lipidów i w większości przypadków są w skali nano. Liposomy mogą skutecznie poprawić rozpuszczalność leków w wodzie i pomóc większości leków rozpuszczalnych w lipidach wejść do kliniki, takich jak liposomy doksorubicyny i Epaxal. W przypadku dostarczania leków zawierających kwasy nukleinowe, liposomy kationowe złożone z lipidów kationowych o stałym ładunku dodatnim mogą skutecznie przenosić ujemnie naładowane kwasy nukleinowe. Lipidy kationowe były szeroko stosowane w dostarczaniu mRNA, w tym chlorek N-[1-(2,3-dioleoyloxy)propylo]-N,N,N-trimetyloamoniowy (DOTMA), 1,2-dioleoyloxy-3-trimethylammonium propane chloride (DOTAP)3, 1,2-stearoyl-3-trimethylammonium-propane (DSTAP) i 1,2-dimyristoyl-3-trimethylammonium-propane (DMTAP). Nanocząstki lipidowe zbudowane z tych kationowych lipidów i innych materiałów pomocniczych mogą skutecznie dostarczać leki nukleinowe do organizmu. Jednak wraz z pojawieniem się jonizowalnych lipidów, systemy dostarczania kwasów nukleinowych oparte na jonizowalnych lipidach wykazują bardziej efektywne działanie niż te oparte na lipidach kationowych. Dlatego też rozwój lipidów kationowych wszedł w okres wąskiego gardła.
Selective Organ Targeting (SORT) Delivery System
Na szczęście naukowcy znaleźli skuteczny sposób na wykorzystanie lipidów kationowych, z których najważniejszym jest teoria selektywnego celowania w narządy (SORT). Cheng i wsp. zastąpili niektóre lipidy pomocnicze lipidami kationowymi, aby skonstruować system dostarczania mRNA z określoną funkcją celowania w narządy. Dodanie kationowych lipidów może skutecznie regulować potencjał zeta LNP i rodzaj białka adsorbowanego przez LNP podczas transportu w organizmie, realizując w ten sposób organoselektywne LNP. (Rysunek 1).4
Modyfikacja powierzchni i funkcjonalizacja liposomów kationowych
Z drugiej strony, silnie dodatnio naładowane kationowe nanocząsteczki mogą niszczyć komórki krwi i powodować hemolizę. Jednocześnie będą one usuwane przez układ siateczkowo-śródbłonkowy z powodu wchłaniania nadmiaru białek surowicy, co skutkuje niską skutecznością dostarczania mRNA do organizmu. Aby sprostać temu wyzwaniu, Song i wsp. przygotowali ujemnie naładowane szczepionki mRNA poprzez modyfikację naturalnych polimerów anionowych na powierzchni kationowych liposomów. Strategia ta skutecznie zmniejszyła toksyczność liposomów kationowych i pozwoliła na skuteczne dostarczanie mRNA. Alginian sodu, kwas hialuronowy, Dex-Aco i inne polimery anionowe zostały wykorzystane do modyfikacji liposomów kationowych, a ta strategia powlekania anionowego może mieć wyjątkowe zalety w rozwoju liposomów kationowych (Rysunek 2).5


Rysunek 1.Selektywne ukierunkowanie na narządy (SORT) umożliwia systematyczne i przewidywalne projektowanie nanocząstek lipidowych (LNP) w celu dokładnego dostarczania mRNA do określonych narządów. A) 5A2-SC8 SORT LNP zostały sformułowane zgodnie ze wskazówkami, aby utworzyć serię LNP z 0% do 100% lipidem SORT (ułamek całkowitych lipidów). Tutaj włączenie trwale kationowego lipidu (DOTAP) systematycznie przesuwało ekspresję białka lucyferazy z wątroby do śledziony do płuc w funkcji procentowej zawartości DOTAP. B) Dane ilościowe wykazały, że procent cząsteczek SORT jest najważniejszym czynnikiem dla dostarczania specyficznego dla tkanki. Dane zostały przedstawione jako średnia±s.e.m. (n=4 biologicznie niezależne zwierzęta). C) Względna ekspresja lucyferazy w każdym narządzie wykazała, że ekspresję frakcyjną można przewidywalnie dostroić (0,1 mg/kg Luc mRNA, IV, 6h). Dane są przedstawione jako średnia±s.e.m. (n=4 biologicznie niezależne zwierzęta). Przedrukowano za zgodą z odniesienia 4, prawa autorskie 2020 Springer Nature.
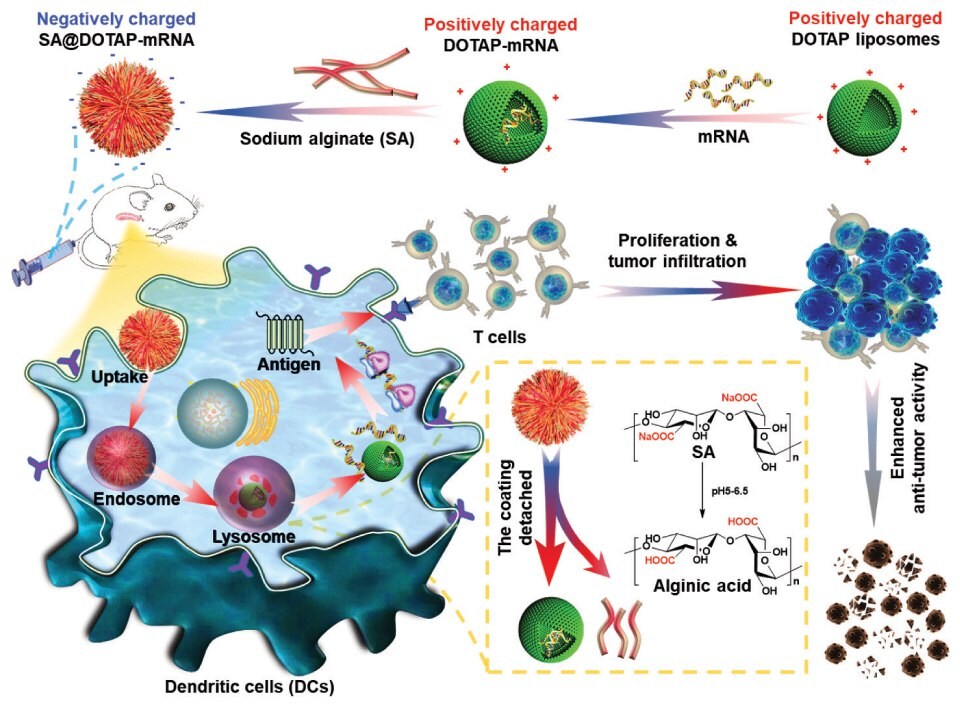
Rysunek 2.Ujemnie naładowany SA@DOTAP-mRNA został przygotowany przez powlekanie liposomów DOTAP-mRNA SA, co przyczyniło się do ucieczki kompleksu liposom/mRNA z lizosomu i wywołało silniejszą odpowiedź immunologiczną. Przedrukowano za zgodą z referencji 5, prawa autorskie 2022 Elsevier.
Jonizowalne lipidy do dostarczania mRNA
.LNP oparte na jonizowalnych lipidach osiągnęły obiecujące efekty terapeutyczne w praktyce klinicznej, a jonizowalne lipidy, podstawowy składnik LNP, odgrywają decydującą rolę w ładowaniu mRNA, ochronie mRNA przed degradacją RNazy i kontrolowaniu uwalniania mRNA. Klinicznie, najwcześniejszym jonizowalnym lipidem stosowanym do dostarczania kwasów nukleinowych był Dlin- MC3-DMA (MC3), który był stosowany do klinicznego dostarczania siRNA w leczeniu amyloidozy, w której pośredniczy transtyretyna. W 2022 r. jonizowalne lipidy ALC-0315 (Pfizer) i SM-102 (Moderna) zostały wykorzystane w nanocząsteczkach szczepionki przeciwko COVID-19, stając się jedynymi dwiema szczepionkami mRNA na świecie, które zostały zatwierdzone przez FDA do stosowania przeciwko SARS-CoV-2. Obecnie różne leki mRNA oparte na jonizowalnych lipidach są w trakcie badań klinicznych.
Struktura chemiczna jonizowalnych lipidów odgrywa kluczową rolę w dostarczaniu kwasów nukleinowych, dlatego przeprowadzono wiele badań przedklinicznych w celu ujawnienia wpływu ich struktury chemicznej na dostarczanie kwasów nukleinowych. Lipidy jonizowalne są amfifilowymi cząsteczkami, które zawierają trzy domeny: polarną grupę głowy, hydrofobowy region ogona i łącznik między dwiema domenami.
Polarna grupa głowy lipidów jonizowalnych
Głowa składa się z jednego lub więcej protonowalnych atomów N. Chociaż wszystkie trzy lipidy dostępne obecnie na rynku zawierają tylko jeden protonowany atom N, nie jest jasne, czy jonizowalne lipidy, których głowy zawierają określoną liczbę protonowanych atomów N, są bardziej odpowiednie do dostarczania kwasów nukleinowych. Song i wsp. zaprojektowali bibliotekę jonizowalnych związków lipidowych o strukturze 4N4T. Jonizowalne lipidy 4N4T można podzielić na hydrofilowe centra i hydrofobowe ogony. Centrum hydrofilowe składa się z czterech amin trzeciorzędowych (N) i czterech nasyconych łańcuchów hydrofobowych (T). Te 4N4T LNP wykazują znacznie wyższą wydajność translacji mRNA niż zatwierdzone SM 102 LNP, a te oparte na 4N4T szczepionki COVID-19 mRNA z powodzeniem wywołują silne i trwałe humoralne odpowiedzi immunologiczne przeciwko SARS-CoV-2 i jego wariantom, w tym Delta i Omicron. Co ważne, szczepionki mRNA przeciwko COVID-19 oparte na 4N4T mają wyższe miana IgG specyficzne dla RBD i miana przeciwciał neutralizujących niż szczepionki mRNA oparte na SM 102.6 Inne lipidy jonizujące oparte na atomach multi-N obejmują C12-200, 5A2-SC8, 306Oi10, TT3 i C14-4.7 Chociaż, zgodnie z danymi literaturowymi, nośniki te nie zostały porównane z SM102 lub ALC-0315, mogą mieć taką samą zdolność dostarczania mRNA jak SM102 i ALC0315.
Hydrofobowy region ogona jonizowalnych lipidów
Dan Peer i in. opracowali serię jonizowalnych lipidów o różnych strukturach ogona opartych na tej samej głowie. Stwierdzili oni, że lipidy z rozgałęzionym łańcuchem i wiązaniami estrowymi były mniej skuteczne niż te z linolowymi łańcuchami kwasów tłuszczowych. Można to przypisać lepszej ucieczce endosomalnej ze względu na zmianę strukturalną lipidów linolowych.8 W innym badaniu zaprojektowano małą bibliotekę lipoidów wykorzystujących 3,3′-diamino-N-metylodipropyloaminę do reakcji z 11 nasyconymi ogonami akrylanów alkilowych o długości od 6 do 18. Wyniki wykazały, że lipoid 306Oi10 z odgałęzieniem jednowęglowym w ogonie zapewniał dziesięciokrotną poprawę w stosunku do lipoidu 306O10 z prostym ogonem. Nanocząsteczki zawierające 306Oi10 jonizują przy endosomalnym pH 5.0, poprawiając w ten sposób dostarczanie mRNA.9
Ligand między polarną grupą głowy i hydrofobowym ogonem
Struktura głowy i ogona zjonizowanych lipidów odgrywa istotną rolę w kontrolowaniu stabilności LNP, ukierunkowaniu narządów podczas transportu in vivo oraz szybkości uwalniania cząsteczek kwasu nukleinowego. Virgil Percec i wsp. stwierdzili, że LNP mają bardziej oczywiste ukierunkowanie w wątrobie i śledzionie, gdy struktura liganda jest wiązaniem estrowym i bardziej specyficzne ukierunkowanie w płucach, gdy struktura liganda jest wiązaniem amidowym.10 Zostało to również potwierdzone przez prace badawcze Qiaobing Xu i wsp. Porównując lipidy jonizowalne serii 306Oi10 z lipidami jonizowalnymi 306N12B, możemy być bardziej przekonani, że grupy łączące odgrywają istotną rolę w regulacji selektywności narządowej LNP.11 Ponadto biodegradowalne lipidy mogą być również wykonane zarówno z motywów estrowych, jak i disulfidowych. Rozszczepienie wiązań dwusiarczkowych prowadzi do wewnątrzcząsteczkowego ataku nukleofilowego na łącznik estrowy, przyspieszając ich degradację.12
Chociaż trzy składniki jonizowalnych lipidów mają swoje role, całość jest większa niż lokalny dodatek. Opracowując skuteczne jonizowalne lipidy, powinniśmy projektować z perspektywy całej cząsteczki i wybrać odpowiednią kombinację.
Research and Development of Highly Efficient Ionizable Lipids
Ionizowalne lipidy są podstawowymi składnikami LNP, więc ich rozwój przyciągnął wiele uwagi. Według przeglądu opublikowanego w Nature Communications, jonizowalne lipidy dzielą się na pięć kategorii. Nienasycone lipidy jonizowalne (DLin-MC3-DMA, A6, OF-O2, A18-Iso5-2DC18), lipidy jonizowalne o wielu ogonach (98N12-5, C12-200, 9A1P9 i cKK-E12), jonizowalne polimery-lipidy (7C1 i G0-C14), biodegradowalne lipidy jonizowalne (L319, 304O13, OF-Deg-Lin, 306-O12B) i lipidy jonizowalne o rozgałęzionych ogonach (306Oi10, FTT). W oparciu o obecne postępy w badaniach i stan kliniczny, degradowalne szkielety i zwiększone rozgałęzienia/ogony są dwiema najkorzystniejszymi właściwościami strukturalnymi dla przyszłego rozwoju lipidów jonizowalnych. SM-102 i ALC-0315 mają wspólne cechy, w tym trzeciorzędową aminę, rozgałęzione ogony i łączniki estrowe. Co więcej, oba wykazują wydłużone gałęzie alifatyczne, dzięki czemu przypominają struktury wieloogonowe. Oprócz bezpieczeństwa i siły działania, jonizowalne lipidy nowej generacji z dodatkowymi funkcjami, takimi jak celowanie i regulacja immunologiczna, będą odgrywać ważną rolę w określonych zastosowaniach. Obecnie ponad połowa LNP to jonizowalne lipidy ukierunkowane na wątrobę, śledzionę, płuca, serce, nerki, trzustkę i inne narządy. Wciąż istnieją ogromne możliwości innowacji, aby zrealizować szersze perspektywy zastosowania terapii RNA.13
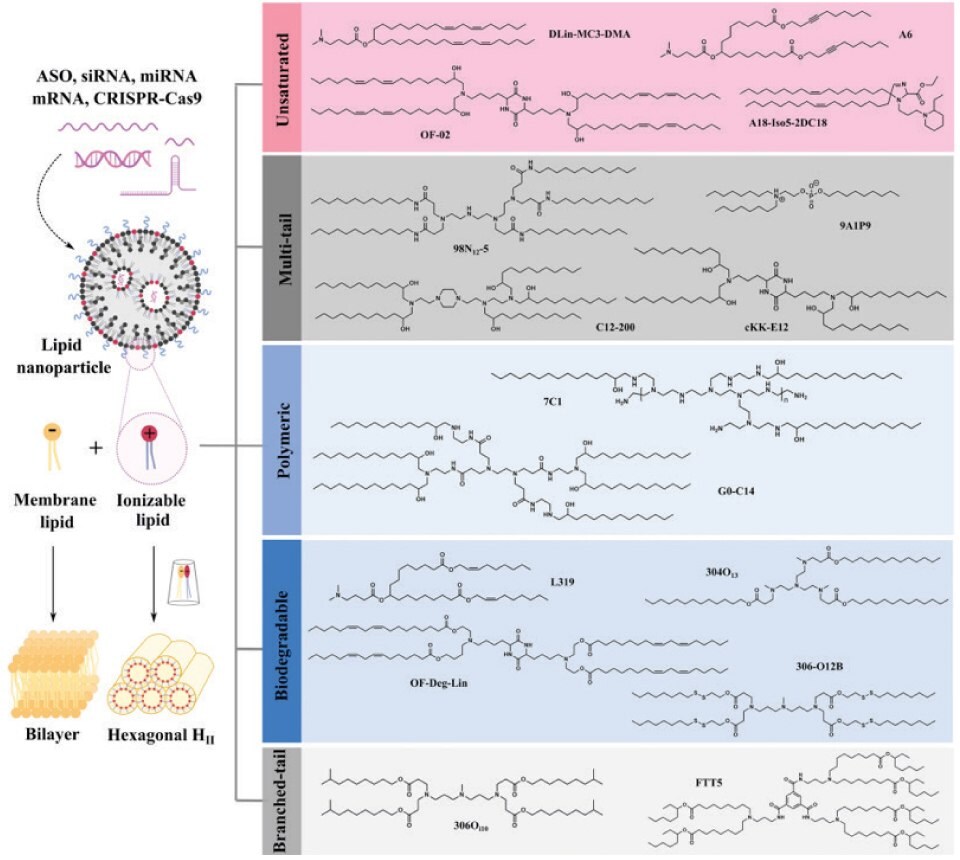
Rysunek 3.Pary jonów w kształcie stożka utworzone przez anionowe fosfolipidy endosomalne i protonowane jonizowalne lipidy mogą zaburzać strukturę dwuwarstwy, promując ucieczkę endosomalną. W oparciu o ich właściwości strukturalne, jonizowalne lipidy dostarczające RNA można podzielić na nienasycone (zawierające nienasycone wiązania), wieloogonowe (zawierające więcej niż dwa ogony), polimerowe (zawierające polimer lub dendrymer), biodegradowalne (zawierające biodegradowalne wiązania) i rozgałęzione (zawierające rozgałęziony ogon). Przedrukowano za zgodą z referencji 13, prawa autorskie 2021 Springer Nature.
Projekt receptury LNPs
Formuły dostępnych na rynku LNP są bardzo podobne. Formuły LNPS składają się z 35%-50% jonizowalnych lipidów, a pozostałe 10%-20% to neutralne lipidy, 35-40% cholesterolu i 0,5%-2,5% PEG. Oprócz jonizowalnych lipidów możliwe są inne innowacje, takie jak zastąpienie cholesterolu ß-sitosterolem. ß-sitosterol nadaje LNP wielościenny kształt, który sprzyja ucieczce z endosomu. Zoptymalizowane LNP wykazały równomierny rozkład cząstek, wielościenną morfologię i szybką dyfuzję, co zwiększyło transfekcję genów.14 Ponadto neutralne fosfolipidy są zastępowane kationowymi lub anionowymi fosfolipidami w celu regulacji potencjału zeta LNP i osiągnięcia selektywnego dostarczania LNP do narządów.15 Inne rodzaje fosfolipidów i PGE są również opracowywane w celu poprawy zdolności dostarczania LNP. Rysunek 4 przedstawia reprezentatywne struktury składników LPN.
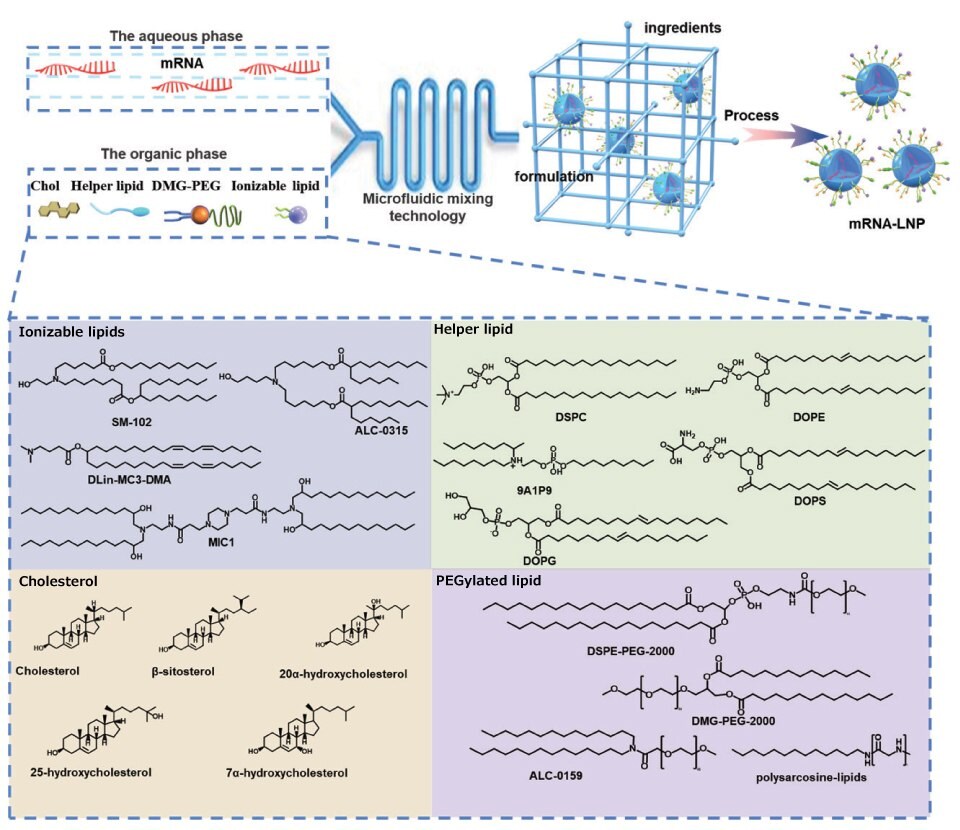
Rysunek 4.Reprezentatywne struktury składników LNP. Skład LNP, proporcje i technologia przygotowania mają kluczowy wpływ na działanie LNP. LNP zazwyczaj zawierają cztery składniki, a mianowicie jonizowalne lipidy kationowe, fosfolipidy, cholesterol i lipidy PEGylowane. Mogą one samoorganizować się w nanocząsteczki LNP za pomocą metody rozcieńczania etanolem. Poniżej wymieniono reprezentatywne związki dla każdego składnika.
Sposób podawania LNP
Różne sposoby podawania LNP będą miały znaczący wpływ na ich dystrybucję w narządach, czas trwania ekspresji mRNA i rodzaje komórek, które przyjmują LNP, prowadząc w ten sposób do różnych efektów terapeutycznych. Dożylne i domięśniowe wstrzyknięcia LNP zostały zastosowane klinicznie, podczas gdy inne sposoby podawania są nadal przedmiotem badań klinicznych i przedklinicznych. Yuhong Xu i wsp. wstrzyknęli LNP domięśniowo, podskórnie i dożylnie, a wyniki wykazały, że LNP we wstrzyknięciu dożylnym gromadziły się głównie w wątrobie, a ekspresja lucyferazy w wątrobie osiągnęła szczyt po 4 godzinach i gwałtownie spadła w ciągu 48 godzin. LNP wstrzyknięte domięśniowo mogą znajdować się w miejscu wstrzyknięcia, ale ekspresja genów jest również widoczna w wątrobie. LNP wstrzyknięte podskórnie rezydowały w miejscu wstrzyknięcia i powodowały słabszą ekspresję mRNA.16 Kathryn A. Whitehead i wsp. wybrali 396Oi10, 200Oi10 i 514Oi10 do przygotowania trzech LNP. W porównaniu z wstrzyknięciem dożylnym (IV), wstrzyknięcie do jamy brzusznej (IP) znacznie zwiększyło skuteczność i specyficzność dostarczania mRNA ukierunkowanego na trzustkę oraz pomogło poprawić dostarczanie i specyficzność.17 Ponadto, w oparciu o skomplikowany projekt recept, James E. Dahlman i wsp. skonstruowali LNP o nazwie Nebulized Lung Delivery 1 (NLD1) do dalszej analizy. Porównując względne rozmiary różnych pików DLS, naukowcy odkryli, że NLD1 był bardziej stabilny niż 7C3, cKK-E12 i MC3 po nebulizacji. Wreszcie, NLD1 był stabilny i dobrze tolerowany po nebulizacji, a skuteczność transfekcji płuc była wyższa.18 Inne drogi dostarczania leków zostały również wykorzystane do dostarczania LNP. Niren Murthy i wsp. dostarczyli LNP do płodowych myszy poprzez iniekcję wewnątrzmaciczną i osiągnęli skuteczną transfekcję w wątrobie, sercu, nerkach, płucach, przewodzie pokarmowym i mózgu, z poziomem transfekcji przekraczającym 5%. Strategia ta jest obiecująca dla zapobiegania i leczenia różnych chorób płodu.19

Rysunek 5.Drogi podawania preparatów LNP-mRNA. LNP mogą być podawane we wstrzyknięciu dożylnym, domięśniowym, podskórnym, śródskórnym i aspiracyjnym. Copyright Springer Nature Limited.
Perspektywy
W ciągu ostatniej dekady rozwój LNP znacznie się rozwinął. Obecnie istnieją trzy komercyjnie dostępne LNP oraz kilka badań klinicznych i przedklinicznych związanych z LNP. Oczekuje się, że coraz większa liczba LNP wejdzie na rynek w ciągu najbliższych kilku lat. Niniejszy artykuł podsumowuje status quo LNP w ostatnich latach i kilka istotnych kluczowych punktów, które mogą ukierunkować przyszłe badania i rozwój LNP.
Po pierwsze, skuteczne wektory dostarczania są kluczem do sukcesu LNP. Chociaż lipidy kationowe mogą nie być tak dobre jak lipidy jonizowalne do dostarczania mRNA, nie należy ich porzucać. Modyfikacja powierzchni, optymalizacja receptury i strategie mieszania z jonizowalnymi lipidami mogą przyczynić się do rozwoju lipidów kationowych. Po drugie, podczas opracowywania nowych cząsteczek lipidów należy w pełni uwzględnić trzy składniki lipidów, a strukturę chemiczną nośnika należy dostosować do badań i rozwoju w celu zaprojektowania wydajnego, bezpiecznego i selektywnego nośnika. Po trzecie, projektowanie recept i wybór drogi podania są również istotne w badaniach i rozwoju LNP. Wiele związków pomocniczych może poprawić stabilność LNP i skuteczność dostarczania LNP do mRNA. Jednocześnie droga podania LNP ma również kluczowy wpływ na ich skuteczność. Należy dostosować receptę LNP, ponieważ LNP napotykają różne bariery w różnych drogach dostarczania.
Wreszcie, każda część badań i rozwoju LNP jest niezbędna, a całość jest większa niż suma części. Naukowcy powinni odpowiednio zaprojektować strukturę chemiczną wektora dostarczania, dopracować skład recepturowy LNP i wybrać odpowiednią drogę podania zgodnie z własnymi celami badawczo-rozwojowymi.
Podziękowania
Badanie to było wspierane przez National Key Research and Development Program of China (2021YFE0206600), Sichuan Province Science and Technology Support Program (2021YFSY0008 i 2020YJ0238), Translational Medicine Fund of West China Hospital (CGZH19002) oraz 1.3.5 Project for Disciplines of excellence, Szpital Zachodniochiński, Uniwersytet Syczuański (ZYGD18020/ZYJC18006).
REFERENCJE
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?