Synteza oligonukleotydów DNA
Chemia fosforoamidytów, opracowana w latach 80-tych XX wieku, a następnie ulepszona o nośniki w fazie stałej i automatyzację, jest metodą z wyboru do produkcji oligonukleotydów DNA. W przeciwieństwie do biosyntezy, synteza chemiczna przebiega w kierunku 3' → 5' zgodnie z krokami opisanymi na Rysunku 1. Uwaga: niniejszy artykuł koncentruje się wyłącznie na syntezie DNA (choć podobna, istnieją różnice w stosunku do chemicznej syntezy RNA).
Czytaj więcej o
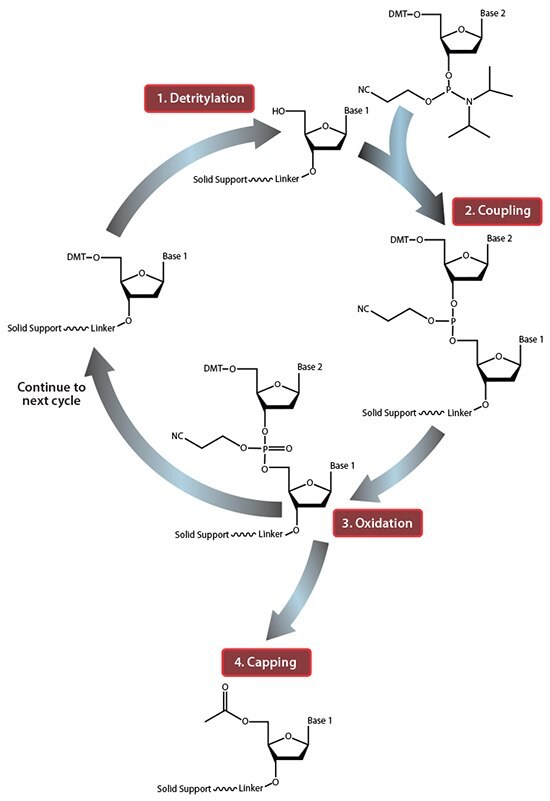
Rysunek 1.Podsumowanie cyklu syntezy oligonukleotydów w fazie stałej. W kroku 1, Detrytylacja, grupa ochronna 5'-DMT jest usuwana z pierwszego nukleozydu związanego ze stałym podłożem. W etapie 2, sprzęganie, wolny 5'-OH pierwszego nukleozydu związanego ze stałym nośnikiem atakuje fosfor przychodzącego drugiego nukleozydu, wypierając jego grupę diizopropyloaminową. W etapie 3, Utlenianie, niestabilny triester fosforynowy jest przekształcany w stabilny triester fosforanowy, co pozwala na przejście do etapu 1, Detrytylacja drugiego nukleotydu. Jednak przed przejściem do następnego cyklu, w kroku 4, Capping, nukleozydy związane ze stałym nośnikiem z nieprzereagowanym 5'-OH są acetylowane, zapobiegając w ten sposób wydłużaniu sekwencji z mutacjami delecyjnymi (Capping jest wykonywany po utlenianiu, aby wypędzić całą wodę, która w przeciwnym razie hamowałaby następny cykl reakcji).
Synteza oligonukleotydów metodą fosforamidytową
.Ta sekcja bada szczegółową chemię każdego z czterech etapów [etap 1 (detrytylacja), etap 2 (sprzęganie), etap 3 (zamykanie) i etap 4 (utlenianie)] w metodzie fosforoamidytowej.
Krok 1 (detrytylacja)
.Cykl jest inicjowany przez usunięcie grupy ochronnej 5'-DMT (4,4'-dimetoksytrytylu) z nukleozydu związanego ze stałym nośnikiem (zawiera końcową zasadę 3' oligonukleotydu). 5'-DMT zapobiega polimeryzacji nukleozydu podczas funkcjonalizacji stałej żywicy nośnej. Mechanizm jest przedstawiony na Rysunku 2.

Rysunek 2.Mechanizm detrytylacji. Grupa ochronna 5'-DMT jest usuwana przez TCA (kwas trichlorooctowy) w rozpuszczalniku dichlorometanie (zbyt stężony roztwór TCA lub zbyt długi czas detrytylacji prowadzi do depurynacji, a tym samym obniża ogólną wydajność końcowego oligonukleotydu). Produkty obejmują 3' końcowy nukleozyd z wolnym 5'-OH i karbokationem DMT (struktura rezonansowa utworzona przez delokalizację elektronów nie została pokazana). Nukleozyd przechodzi do etapu 2 w syntezie, podczas gdy karbokation DMT absorbuje przy 495 nm, tworząc pomarańczowy kolor, który można wykorzystać do monitorowania wydajności sprzęgania.
Krok 2 (sprzęganie)
Po usunięciu DMT, wolny 5'-OH nukleozydu związanego ze stałym nośnikiem jest w stanie reagować z następnym nukleozydem, który jest dodawany jako monomer fosforoamidynowy. Mechanizm ten przedstawiono na Rysunku 3.
![Mechanizm sprzęgania. Grupa diizopropyloaminowa wchodzącego monomeru fosforoamidytu w rozpuszczalniku acetonitrylu jest "aktywowana" (protonowana) przez kwaśny katalizator ETT [5-(etylo-tio)-1H-tetrazol]. Mieszanie jest przeprowadzane w liniach płynów aparatu do syntezy, gdy odczynniki są dostarczane do stałego nośnika. Aktywowany fosforoamidyt jest dostarczany z wielokrotnym nadmiarem w stosunku do nukleozydu związanego ze stałym nośnikiem, aby doprowadzić reakcję do jak najbliższego zakończenia. Produkty obejmują dinukleozyd z triestrowym wiązaniem fosforynowym i wolną grupą diizopropyloaminową. Mechanizm sprzęgający](/deepweb/assets/sigmaaldrich/marketing/global/images/technical-documents/articles/genomics/pcr/dna-figure-3/dna-figure-3.jpg)
Rysunek 3.Mechanizm sprzęgania. Grupa diizopropyloaminowa wchodzącego monomeru fosforoamidytu w rozpuszczalniku acetonitrylu jest "aktywowana" (protonowana) przez kwaśny katalizator ETT [5-(etylo-tio)-1H-tetrazol]. Mieszanie jest przeprowadzane w liniach płynów aparatu do syntezy, gdy odczynniki są dostarczane do stałego nośnika. Aktywowany fosforoamidyt jest dostarczany z wielokrotnym nadmiarem w stosunku do nukleozydu związanego ze stałym nośnikiem, aby doprowadzić reakcję do jak najbliższego zakończenia. Produkty obejmują dinukleozyd z triestrowym wiązaniem fosforynowym i wolną grupą diizopropyloaminową.
Krok 3 (Utlenianie)
Triester fosforynowy powstały podczas reakcji sprzęgania jest nienaturalny i niestabilny, dlatego przed rozpoczęciem kolejnego cyklu musi zostać przekształcony w bardziej stabilną formę fosforu. Utlenianie przekształca triester fosforynowy w stabilny triester fosforanowy. Mechanizm ten przedstawiono na Rysunku 4.

Rysunek 4.Mechanizm utleniania. Utlenianie triestru fosforynowego odbywa się za pomocą jodu w obecności wody i pirydyny. Produktem jest triester fosforanowy, który jest zasadniczo standardowym szkieletem DNA z β-cyjanoetylową grupą ochronną na wolnym tlenie.
Krok 4 (Capping)
Ponieważ 100% wydajność sprzęgania jest niemożliwa, zawsze istnieją pewne nukleozydy związane ze stałym nośnikiem z nieprzereagowanym 5'-OH. Jeśli nie zostaną zablokowane, te grupy hydroksylowe będą reagować podczas następnego cyklu, a tym samym prowadzić do brakującej zasady. Nagromadzenie tych mutacji delecyjnych w kolejnych cyklach stworzyłoby złożoną mieszaninę "shortmerów", które są trudne do oczyszczenia, a zatem mogłyby uczynić oligonukleotyd bezużytecznym w kolejnym zastosowaniu. Capping jest wymagany, aby zapobiec akumulacji shortmerów. Mechanizm ten został przedstawiony na Rysunku 5.

Rysunek 5.Mechanizm kapslowania. Bezwodnik octowy i N-metyloimidazol reagują tworząc związek pośredni w rozpuszczalniku tetrahydrofuranie, który zawiera niewielką ilość pirydyny. Mieszanie jest przeprowadzane w przewodach cieczy przyrządu do syntezy, gdy odczynniki są dostarczane do stałego nośnika. Produktem jest nukleozyd związany ze stałym nośnikiem z acetylowanym 5'-OH (pirydyna utrzymuje zasadowe pH, zapobiegając w ten sposób detrytylacji monomeru fosforoamidytu przez wolny octan / kwas octowy).
Kolejne cykle
Drugi cykl rozpoczyna się od kroku 1, detrytylacji, a następnie każdego z pozostałych trzech kroków. Liczba powtórzonych cykli jest równa żądanej liczbie zasad. Syntetyzujemy oligonukleotydy od 2 do 120 zasad.
Cleavage
Nasz opatentowany stały nośnik / łącznik jest stabilny dla wszystkich odczynników fosforoamidowych, ale można go odszczepić od oligonukleotydu pod koniec syntezy. Rozszczepienie jest konieczne, aby wolny 3'-OH mógł brać udział w reakcjach biochemicznych, takich jak wydłużanie przez polimerazę DNA podczas PCR, gdy oligonukleotyd służy jako starter. Reagent i produkt przedstawiono na Rysunku 6.

Rysunek 6.Reagent i produkt rozszczepienia. Hydroliza estru łącznika (i jednoczesne usunięcie stałego nośnika) jest przeprowadzana przez traktowanie stężonym wodnym amoniakiem. Produktem jest oligonukleotyd z końcowym, wolnym 3'-OH.
Deprotection
Po rozszczepieniu, roztwór oligonukleotydu w stężonym wodnym amoniaku jest podgrzewany w celu usunięcia grup zabezpieczających z zasad i fosforanów.
Zasady
O ile tymina nie wymaga grupy ochronnej, o tyle adenina, cytozyna i guanina już tak, gdyż zawierają egzocykliczne pierwszorzędowe grupy aminowe. Grupy ochronne muszą zostać usunięte, aby mogły powstać odpowiednie wiązania wodorowe między oligonukleotydem a docelowym kwasem nukleinowym. Reagent i produkt przedstawiono na Rysunku 7.

Rysunek 7. Reagent i produkt deprotekcji zasad. Oligonukleotyd w stężonym wodnym amoniaku jest ogrzewany. Grupy zabezpieczające obejmują: N(6)-benzoil A, N(4)-benzoil C i N(2)-izobutyryl G. Produktem reakcji są w pełni zdeprotonowane zasady A, C i G.
Oprócz standardowych grup zabezpieczających, w przypadku zmodyfikowanych oligonukleotydów, które są wrażliwe na amoniak, można stosować labilne grupy zabezpieczające dimetyloformamidyl G i "ultramild". Te grupy zabezpieczające na odpowiednich zasadach są pokazane na Rysunku 8.

Rysunek 8.Nietrwałe i ultradelikatne grupy zabezpieczające. Grupa zabezpieczająca dimetyloformamidylowa jest zwykle usuwana w stężonym wodnym amoniaku poprzez ogrzewanie, ale w znacznie krótszym czasie niż grupa izbutyrylowa. Ultradelikatne grupy zabezpieczające obejmują: N(6)-fenoksyacetyl A, N(2)-acetyl C i N(2)-izopropylofenoksyacetyl G. Są one zazwyczaj usuwane w temperaturze pokojowej w stężonym wodnym roztworze amoniaku / metyloaminy.
Formowanie fosfodiestera
Grupa β-cyjanoetylowa na wolnym tlenie fosforanu musi zostać usunięta, aby przekształcić go z triestru fosforanowego w diester fosforanowy (fosfodiester). Mechanizm ten został przedstawiony na Rysunku 9.

Rysunek 9.Mechanizm tworzenia fosfodiestrów poprzez deprotekcję. Grupy cyjanoetylowe są usuwane w stężonym wodnym amoniaku poprzez β-eliminację. Reakcja przebiega szybko, ponieważ atomy wodoru na węglu sąsiadującym z odbierającą elektron grupą cyjanową są silnie kwaśne. Produktami są oligonukleotyd z natywnym szkieletem fosfodiestrowym i akrylonitryl.
Należy pamiętać, że wydajność sprzęgania to nie wszystko, co decyduje o wydajności. Deprotekcja, rozszczepianie i oczyszczanie (nawet proste odsalanie) dodatkowo zmniejszają wydajność. Nasze gwarantowane wydajności oparte na skali produkcji i oczyszczania można znaleźć tutaj.
.Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?