L-glutamina w hodowli komórkowej
L-glutamina jest powszechnie stosowanym, niezawierającym surowicy suplement medyczny wykorzystywany w zastosowaniach związanych z produkcją biomasy, inżynierią tkankową, specjalistycznymi kulturami komórkowymi, takimi jak hodowla hybrydoma, i innymi powszechnymi zastosowaniami związanymi z hodowlą komórek ssaków. Jednakże, ponieważ l-glutamina jest niestabilnym niezbędnym aminokwasem, większość dostępnych na rynku pożywek zawiera wolną L-glutaminę zawartą w formule podstawowej lub dodawaną do płynnych preparatów w momencie użycia.
Oferujemy glutaminę do hodowli komórkowych w postaci dipeptydu lub hydrolizatu białkowego. Niektóre opatentowane pożywki stosowane w biomanufakturowaniu są uzupełniane L-glutaminą w postaci dipeptydów, takich jak alanylo-l-glutamina i glicylo-l-glutamina. Mniej dobrze zdefiniowane źródło L-glutaminy pochodzi ze stosowania hydrolizatów białkowych, zwłaszcza hydrolizatów glutenu. Dla potrzeb pożywek bez surowicy lub białek zwierzęcych, takich jak hodowla rekombinowanych komórek jajnika chomika chińskiego (rCHO), gluten pszenny jest bogatym źródłem glutaminy peptydylowej.
Czytaj więcej
Jako dodatek w klasycznych pożywkach do hodowli komórkowych, stężenie L-glutaminy waha się od 0,5 mM w Ames' Medium do 10 mM w MCDB Media 131. Optymalne stężenie L-glutaminy w DMEM/F12 Nutrient Mixture wynosi 2,5 mM.5 mM, podczas gdy w bezsurowiczym/bezbiałkowym podłożu Hybridoma wynosi ono 2,7 mM. Dla DMEM, GMEM, IMDM i pożywki H-Y, optymalne stężenie wynosi 4 mM. IMDM jest często stosowany jako preparat wyjściowy dla zastrzeżonych pożywek do hodowli komórek hybrydoma; komórki hybrydoma rosną lepiej w stężeniach L-glutaminy, które są powyżej średnich poziomów występujących w pożywkach.
L-glutamina w systemach hodowli komórkowych
Ze względu na jej niestabilność chemiczną i znaczenie dla wzrostu i funkcjonowania komórek, niezwykle ważne jest, aby dostarczanie L-glutaminy było zoptymalizowane pod kątem każdego unikalnego procesu hodowli komórkowej. Glutamina ma wzór cząsteczkowy C5H10N2O3 i masę cząsteczkową 146,15 g/mol, z punktem izoelektrycznym 5,65 i pka 2,17 i 9,13. Zrozumienie tej chemii i wielu form dostarczania L-glutaminy i jej alternatyw jest wymagane do skutecznego stosowania suplementu w hodowlach komórkowych.
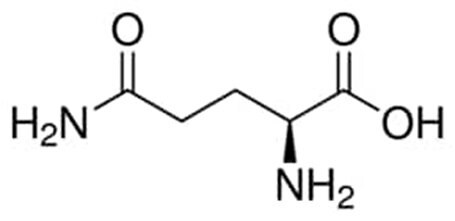
Rysunek 1.Struktura chemiczna L-glutaminy.
Glutamina wspomaga wzrost komórek, które mają wysokie zapotrzebowanie na energię i syntetyzują duże ilości białek i kwasów nukleinowych. Jest również alternatywnym źródłem energii dla szybko dzielących się komórek i komórek, które nieefektywnie wykorzystują glukozę. Komórki potrzebują atomów azotu w glutaminie do budowy cząsteczek takich jak nukleotydy, aminokwasy, aminocukry i witaminy.
Glutamina jest prekursorem glutaminianu, kluczowego aminokwasu używanego do transaminacji alfa ketokwasów w celu utworzenia innych alfa aminokwasów. Zawiera jeden atom azotu jako amid i drugi atom azotu jako aminę; transportuje i dostarcza azot do komórek w ilościach, które nie są tak toksyczne jak wolny amon.
Gdy poziom glukozy jest niski, a zapotrzebowanie na energię wysokie, komórki mogą metabolizować aminokwasy w celu uzyskania energii. Azot amidu glutaminy jest wykorzystywany w syntezie witamin NAD i NADP, nukleotydów purynowych, CTP z UTP i asparaginy. Azot początkowo przechowywany w glutaminie może być również wykorzystywany do produkcji fosforanu karbamylu do syntezy pirymidyn. Glutamina jest jednym z najłatwiej dostępnych aminokwasów do wykorzystania jako źródło energii i jest głównym źródłem energii dla wielu szybko dzielących się typów komórek in vitro.
Stabilność glutaminy w pożywkach do hodowli komórkowych
Glutamina obecna jako reszta aminokwasowa w białkach lub peptydach jest stabilna. Warunkowo niezbędny aminokwas jest swobodnie rozpuszczalnym neutralnym aminokwasem zawierającym amid grupy R. Ponieważ jest niestabilny, może rozkładać się nieenzymatycznie na amoniak i piroglutaminian (kwas pirolidonokarboksylowy) w ciekłych mediach. Rozpad L-glutaminy w czasie zależy od pH, temperatury i obecności różnych anionów.
Deaminacja glutaminy, która jest reakcją usuwającą grupę aminową, zachodzi zarówno w warunkach kwaśnych, jak i zasadowych. Reakcja zachodzi znacznie szybciej w obecności fosforanu lub wodorowęglanu w pożywce. Przy stałym stężeniu fosforanów w ciekłym podłożu, szybkość deaminacji wzrasta wraz ze wzrostem pH z 4,3 do 10.
Biochemia L-glutaminy
Reakcje wiążące azot w glutaminian i glutaminę zużywają równoważniki energii, takie jak NADH, NADPH lub ATP. Glutaminian jest syntetyzowany z amonu i kwasu alfa ketoglutarowego, półproduktu cyklu kwasu trikarboksylowego (TCA). Synteza ta wymaga utlenienia NADH lub NADPH. Enzymy zaangażowane w syntezę glutaminianu, dehydrogenaza glutaminianowa (EC 1.4.1.4) i syntaza glutaminianowa (EC 1.4.1.13), są odwracalne.
Ammon, nieorganiczne źródło azotu wykorzystywane przez komórki, jest początkowo włączany do azotu organicznego jako amina glutaminianu lub amid glutaminy. Te dwa aminokwasy stanowią główne rezerwuary azotu do syntezy białek, kwasów nukleinowych i innych związków azotowych. Amoniak wytwarzany in vivo, ale nie in vitro, może być metabolizowany do mocznika. W niektórych warunkach in vitro amoniak gromadzi się w środowisku pozakomórkowym jako jon amonowy.
Glutamina jest syntetyzowana z cząsteczek amonu i glutaminianu. Synteza ta zużywa energię w postaci ATP. Enzym odpowiedzialny za tę syntezę, syntetaza glutaminy (EC 6.3.1.2), jest wysoce regulowany w celu ograniczenia produkcji glutaminy do wymagań komórki. W katabolizmie glutaminy do glutaminianu i amonu pośredniczą enzymy mitochondrialne zwane glutaminazami (EC 3.5.1.2).
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?