Specyficzne dla tkanek hydrożele ze zdekellularyzowanej macierzy zewnątrzkomórkowej (dECM) do ulepszonych hodowli komórkowych 3D
- Modele hodowli komórek 3D
- Rusztowania ze zdekellularyzowaną macierzą zewnątrzkomórkową (dECM)
- Hydrożele dECM dla płuc
- Hydrożele dECM dla wątroby
- Hydrożele dECM do kości
- Zestawy hydrożeli dECM
Modele hodowli komórkowych 3D
Mikrośrodowisko komórkowe bezpośrednio i pośrednio wpływa na zachowanie komórek zarówno na drodze biofizycznej, jak i biochemicznej. Mikrośrodowisko składa się z białek macierzy zewnątrzkomórkowej (ECM), otaczających komórek, cytokin, czynników wzrostu, hormonów i innych czynników bioaktywnych, posiadających właściwości mechaniczne w skali nano/mikro, takie jak napięcie i sztywność. Tradycyjne hodowle komórkowe 3D polegają na zamykaniu komórek w nieokreślonych ekstraktach błony podstawnej (BME) pochodzących z mięsaka Engelbreth-Holm-Swarm (EHS), takich jak Matrigel® matrix (E1270). Hydrożele te zawierają heterogeniczną mieszaninę zarówno czynników wzrostu (TGFβ, EGF, IGF itp.), jak i białek ECM (lamininy, kolageny, entaktyna itp.) w podwyższonych stężeniach. Dodatkowo, te hydrożele pochodzące z guza nie w pełni odwzorowują natywne mikrośrodowisko tkankowe i mogą prowadzić do zmiennych i mylących wyników eksperymentalnych. Niedawno syntetyczne hydrożele zostały wykorzystane do hodowli komórek w trzech wymiarach. Jednakże, hydrożele te często nie posiadają biologicznej złożoności i funkcjonalności potrzebnej do pełnego naśladowania natywnego mikrośrodowiska tkankowego dla hodowli 3D.
Decellularized Extracellular Matrix (dECM)
Aby odizolować natywną macierz zewnątrzkomórkową tkanki od zamieszkujących ją komórek, stosuje się proces dekellularyzacji. Powstałe w ten sposób rusztowania ze zdekellularyzowanej macierzy pozakomórkowej (dECM) mogą być wykorzystywane w hodowli komórkowej i inżynierii tkankowej. W porównaniu z innymi ekstraktami błony podstawnej pochodzącymi z nowotworów (np. Matrigel® matrix), te hydrożelowe rusztowania dECM mogą zapewnić bardziej fizjologiczne środowisko o zwiększonym tempie wzrostu komórek bez użycia jakichkolwiek egzogennych czynników wzrostu.
.

Rysunek 1. Przegląd dekellularyzacji tkanek. Pochodzące od świń organy (wątroba, płuca, serce itp.) zostały zdekellularyzowane, a natywne składniki ECM specyficzne dla tkanki zostały rozpuszczone i zamrożone do wykorzystania w przyszłości. Te hydrożele dECM mogą być stosowane do tradycyjnych powłok 2D ECM lub do enkapsulacji komórek w hodowlach komórkowych 3D.
Nasze specyficzne dla tkanek zestawy hydrożeli dECM to seria natywnych zdekellularyzowanych macierzy pozakomórkowych (dECM) pochodzących z różnych nieuszkodzonych narządów świń (kości, serca, wątroby, nerek, jelit, skóry i płuc). Hydrożele te mogą być stosowane jako tradycyjne powłoki 2D ECM lub do enkapsulacji komórek do zastosowań w hodowli komórkowej 3D, z lepszą wydajnością w porównaniu do innych hydrożeli.
Lung dECM Hydrogels for 3D Cell Culture
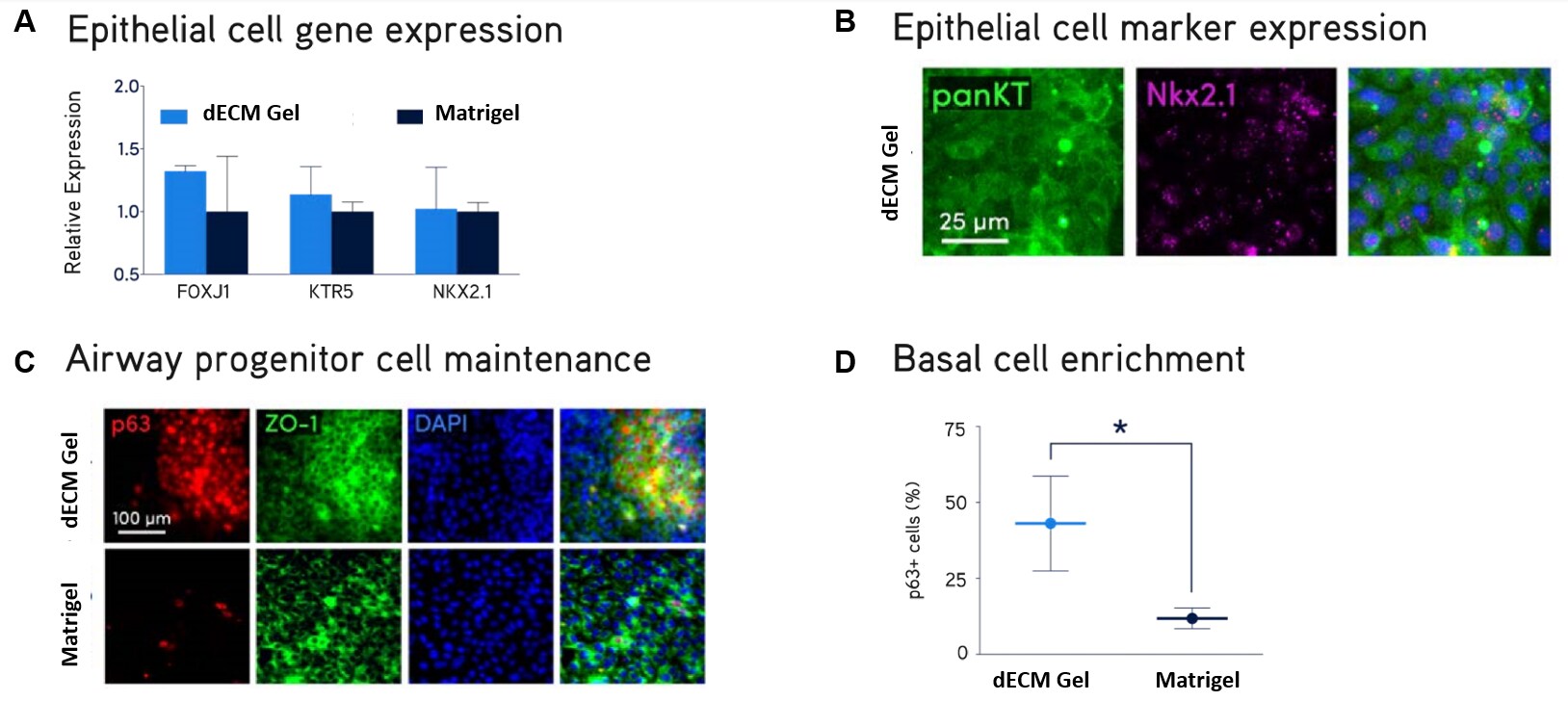
Rysunek 2. Pierwotna hodowla komórek NHBE.Pierwotne prawidłowe ludzkie komórki nabłonka oskrzeli (NHBE) hodowano na hydrożelach Lung dECM lub matrycy Matrigel® przez 10 dni. Komórki NHBE hodowane na hydrożele dECM wykazywały silną ekspresję markerów prawidłowych komórek nabłonka płuc FOXJ1, KTR5, NKX2.1, panKT, p63 i ZO-1 (A, B, C) i wytworzyły większą subpopulację p63+ komórek podstawowych dróg oddechowych (D) w porównaniu z matrycą Matrigel®.
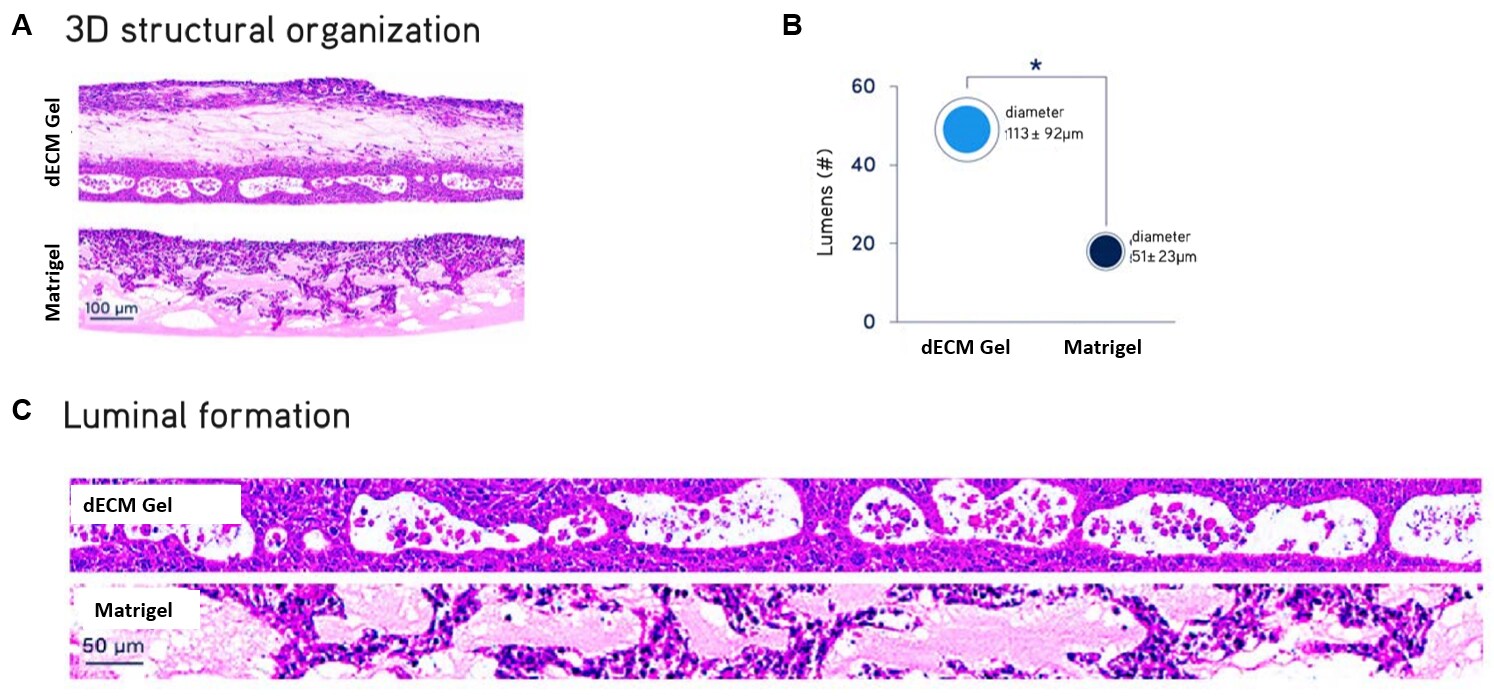
Rysunek 3. Hodowle ALI pierwotnych komórek NHBE.Hodowle pierwotnych normalnych ludzkich komórek nabłonka oskrzeli (NHBE) na granicy faz powietrze-ciecz (ALI) po 21 dniach. Komórki NHBE hodowane w hydrożelach Lung dECM tworzyły bardziej zorganizowane i złożone warstwowe struktury luminalne odzwierciedlające architekturę komórkową ludzkich dróg oddechowych, o znacznie większej średniej średnicy w porównaniu z matrycą Matrigel®.
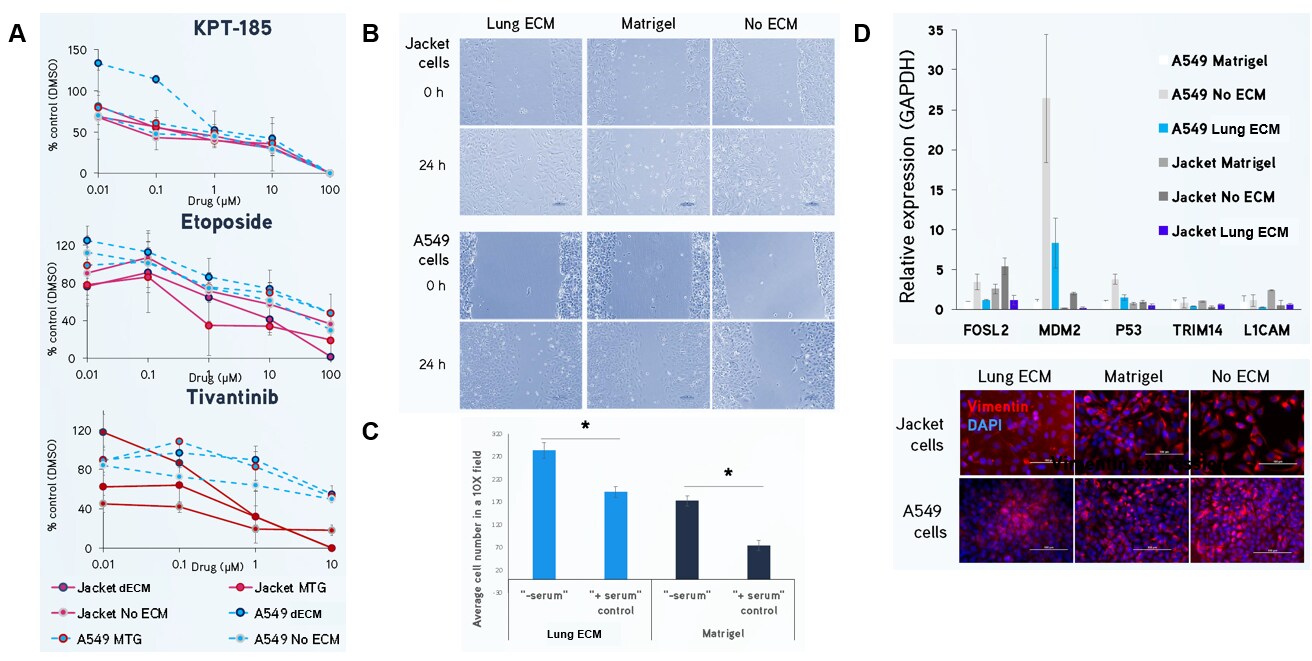
Rysunek 4. Hydrożele dECM płuc mogą być wykorzystywane do modelowania ludzkiego raka płuc.(A) Komórki gruczolakoraka płuc Jacket i A549 poddano działaniu KPT-185, etopozydu i tiwantynibu przez 72 godziny, a liczbę komórek analizowano za pomocą testu MTT. Komórki hodowane w hydrożelu Lung dECM wykazywały odmienne profile oporności na leki z wyższymi wartościami IC50 w porównaniu do matrycy Matrigel®, co może wskazywać na bardziej przewidywalną odpowiedź fizjologiczną. (B, C) Komórki gruczolakoraka płuc Jacket i A549 wykazują zwiększoną migrację i inwazję po 24 godzinach przy użyciu testów zarysowania i komory Boydena, gdy są hodowane na hydrożelach Lung dECM. (D) Ekspresja genów komórek Jacket i A549 hodowanych w hydrożelach Lung dECM. Komórki hodowane w hydrożele Lung dECM wykazywały niższą ekspresję genów związanych z rakiem niż komórki hodowane w matrycy Matrigel®, w tym niższą ekspresję wimentyny.
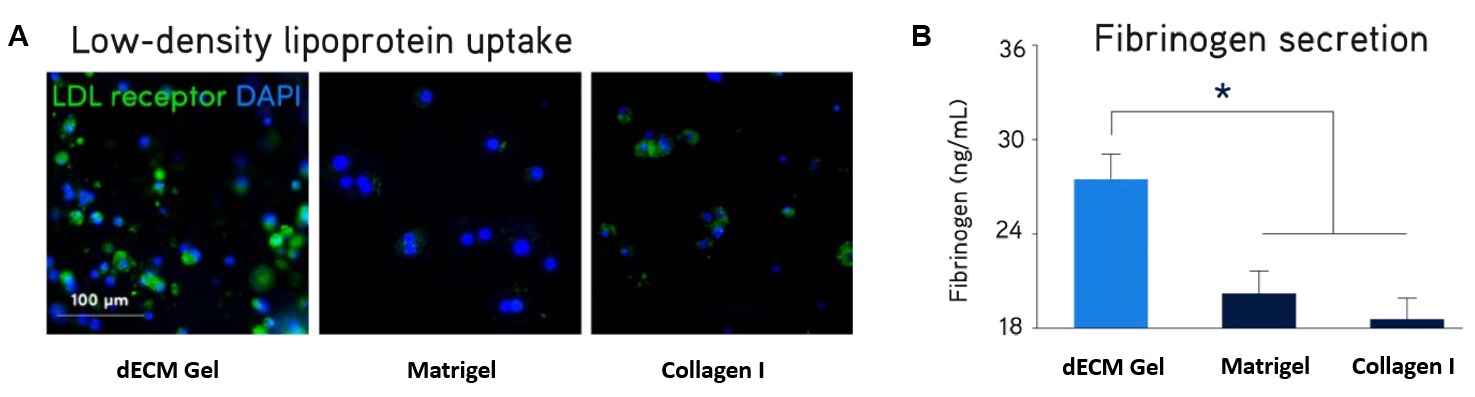
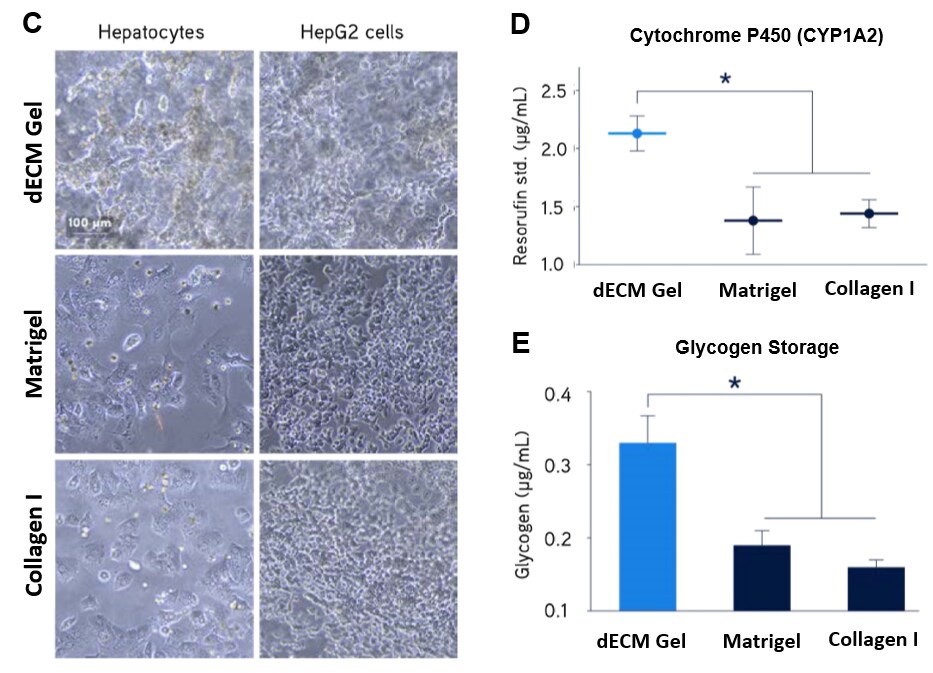
Rysunek 5. Pierwotna hodowla ludzkich hepatocytów.Pierwotne ludzkie hepatocyty wykazywały znacznie wyższą ekspresję receptora LDL (A) i wydzielanie fibrynogenu (B) podczas hodowli w hydrożelach Liver dECM w porównaniu z matrycą Matrigel® lub kolagenem I. Pierwotne ludzkie hepatocyty i komórki raka wątroby HepG2 wykazywały znacznie wyższe tworzenie struktury 3D (C), zwiększoną aktywność cytochromu P450 (D) i zwiększone magazynowanie glikogenu (E) podczas hodowli w hydrożelach Liver dECM w porównaniu z matrycą Matrigel® lub kolagenem I.
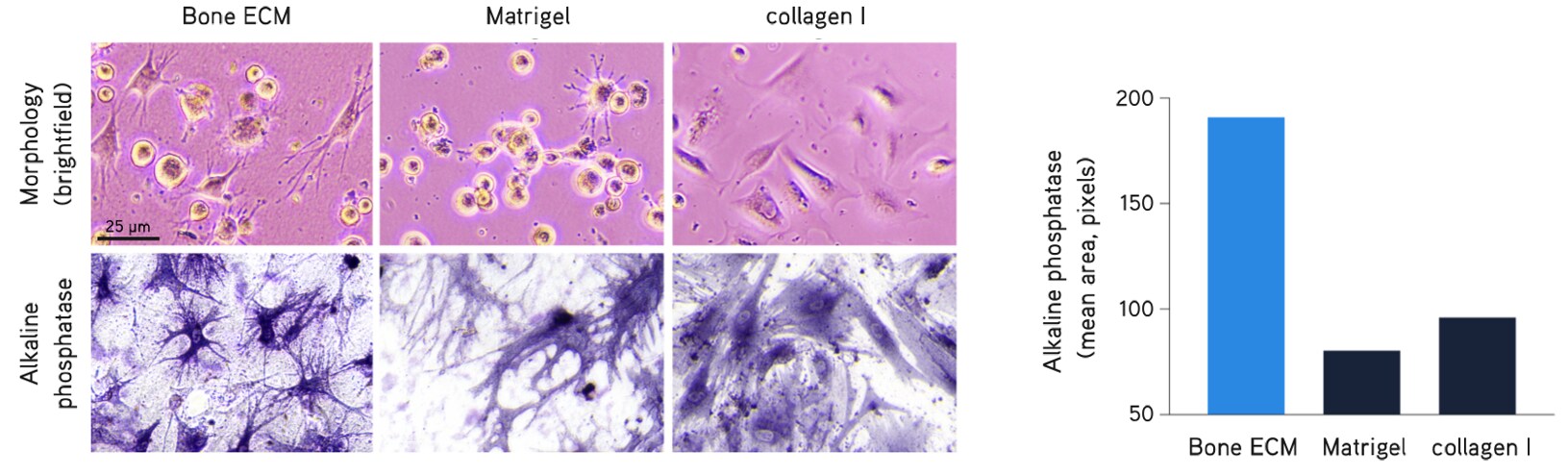
Rysunek 6. Hodowla pierwotnych ludzkich osteoblastów.Pierwotne ludzkie osteoblasty hodowane w hydrożelu Bone dECM (6 mg/ml) wykazują charakterystyczną morfologię dendrytyczną po 1 godzinie hodowli. Osteoblasty wykazywały wyższą aktywność fosfatazy alkalicznej w hydrożelu Bone dECM niż w matrycy Matrigel® lub kolagenie I po 7 dniach hodowli.
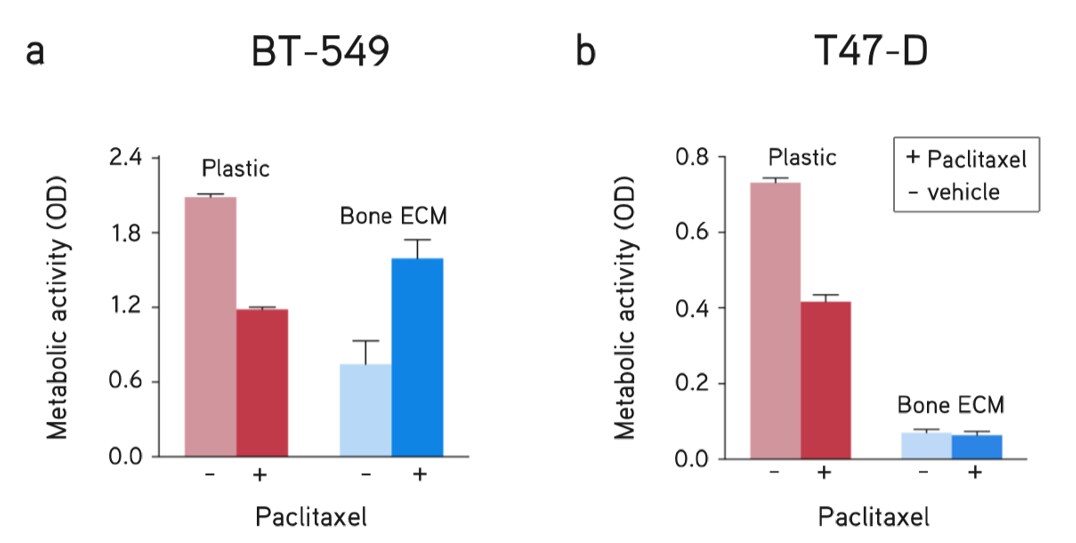
Rysunek 7. Test przerzutów raka piersi. Hydrożele dECM wykorzystane jako model przerzutów raka piersi do kości wykazały zróżnicowaną odpowiedź na leki podtypów raka piersi w porównaniu z hodowlą na plastiku (bez ECM). Odpowiedź na leczenie farmakologiczne (paklitaksel, 5 µM) i nośnik (DMSO) komórek (A) BT-549 i (B) T47-D przez 48 godzin.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?