Oczyszczanie lub usuwanie albuminy
Blue Sepharose High Performance, Blue Sepharose 6 Fast Flow, Capto Blue, Capto Blue (high sub)
Albumina wiąże się z Cibacron Blue F3G-A, syntetycznym barwnikiem policyklicznym, który działa jako aromatyczny ligand anionowy wiążący albuminę poprzez oddziaływania elektrostatyczne i/lub hydrofobowe. Podobne interakcje obserwuje się z czynnikami krzepnięcia, lipoproteinami i interferonem. Cibacron Blue
F3G-A jest połączony z sefarozą, tworząc nośnik Blue Sepharose AC (Rysunek 3.1).
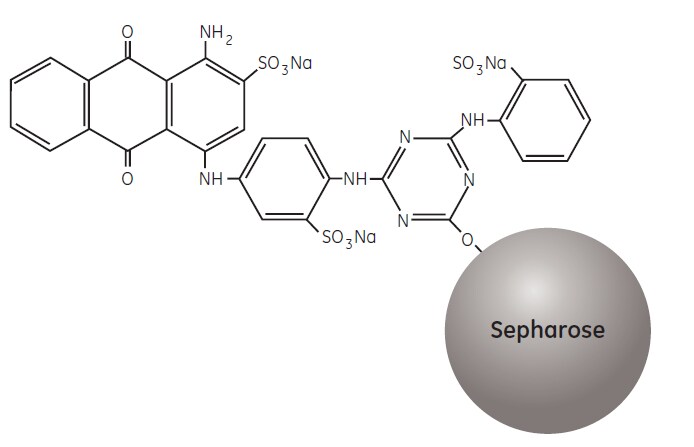
Rysunek 3.1. Częściowa struktura Blue Sepharose Fast Flow i Blue Sepharose High Performance.
Capto Blue i Capto Blue (high sub) mają sztywniejszą matrycę na bazie agarozy w porównaniu z Blue Sepharose 6 Fast Flow, co skutkuje lepszymi właściwościami ciśnienia / przepływu, zoptymalizowaną strukturą porów i wysoką stabilnością chemiczną w celu wsparcia procedur czyszczenia na miejscu (CIP).
Użyć Blue Sepharose lub Capto Blue do usunięcia albuminy gospodarza z systemów ekspresji ssaków lub gdy wiadomo, że próbka zawiera wysokie poziomy albuminy, które mogą maskować wizualizację innych pików białkowych widocznych przez absorpcję UV.
Porady dotyczące wyboru technik usuwania albuminy podczas oczyszczania przeciwciał podano w podręczniku Affinity Chromatography, Vol. 1: Antibodies, 18103746 od Cytiva.
Cibacron Blue F3G-A wykazuje również pewne podobieństwa strukturalne do naturalnie występujących cząsteczek, takich jak kofaktor NAD+, które umożliwiają mu silne i specyficzne wiązanie się z szerokąz szeroką gamą białek, w tym kinazami, dehydrogenazami i większością innych enzymów wymagających kofaktorów zawierających adenylan.
Charakterystyka nośników chromatograficznych
Charakterystykę nośników chromatograficznych Blue Sepharose i Capto Blue podsumowano w tabeli 3.1.
.
Charakterystyka nośników chromatograficznych Blue Sepharose i Capto Blue |
|---|
1 Krótkoterminowy odnosi się do przedziału pH dla procedur regeneracji, czyszczenia na miejscu i odkażania. Długoterminowy odnosi się do przedziału pH, w którym medium jest stabilne przez długi okres czasu bez negatywnego wpływu na jego późniejszą wydajność chromatograficzną.
Opcje pakowania
Blue Sepharose i Capto Blue są dostępne w zestawach nośników chromatograficznych do pakowania w puste kolumny. Dla wygody nośniki są również dostępne w gotowych kolumnach. Opcje oczyszczania dla pożywek i gotowych kolumn przedstawiono w Tabeli 3.2.
Opcje oczyszczania dla nośników chromatograficznych Blue Sepharose i Capto Blue oraz kolumn w opakowaniach jednostkowych |
|---|
1 W kolumnie o długości 1 m i wysokości złoża 20 cm w temperaturze 20 °C przy użyciu buforów procesowych o takiej samej lepkości jak woda.
2 Załącznik 4 do konwersji prędkości przepływu (cm/h) na objętościową szybkość przepływu (ml/min) i odwrotnie. Maksymalny przepływ roboczy jest obliczany na podstawie pomiaru w kolumnie z wypełnieniem o wysokości złoża 10 cm i średnicy wewnętrznej 5 cm.
Przykłady oczyszczania
Rysunek 3.2 przedstawia zastosowanie HiTrap® Blue HP do oczyszczania coraz większych ilości albuminy surowicy ludzkiej. Proces można łatwo skalować, łącząc szeregowo kilka kolumn HiTrap® o pojemności 1 ml lub 5 ml.
Rysunek 3.3 przedstawia zastosowanie Blue Sepharose 6 Fast Flow do oddzielania HSA od interferonu β.
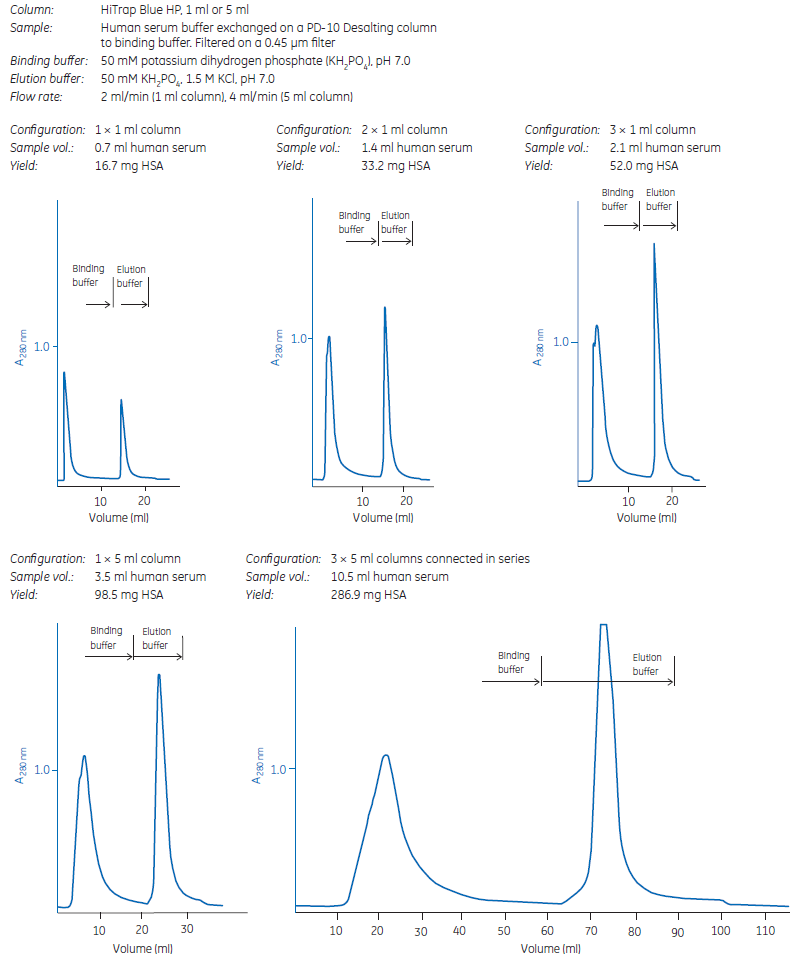
Rysunek 3.2. Skalowanie na HiTrap® Blue HP zapewnia przewidywalne separacje i ilościowo powtarzalne wydajności.
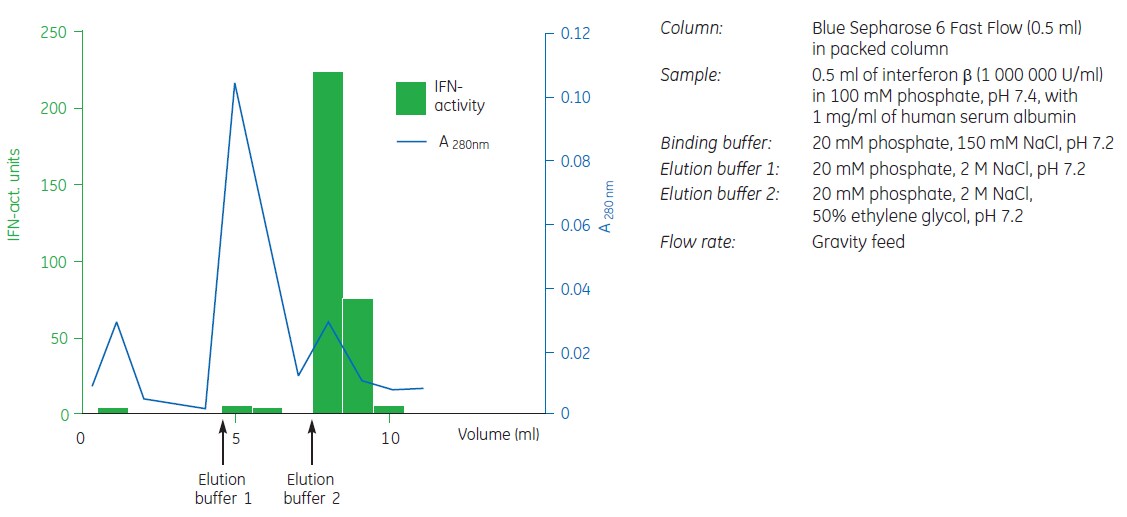
Rysunek 3.3. Oczyszczanie albuminy surowicy ludzkiej i interferonu b na niebieskiej sefarozie 6 Fast Flow
W tych przykładach elucję uzyskuje się poprzez zwiększenie siły jonowej buforu lub zmianę biegunowości buforu. Zmiana pH buforu może również działać, ale odpowiedni kofaktor jest preferowany do elucji specyficznie związanych białek.
Wykonywanie separacji
Bufor wiążący: 50 mM diwodorofosforan potasu (KH2PO4), pH 7,0 lub 20 mM fosforan sodu, pH 7,0
Bufor elucyjny: 50 mM KH2PO4, 1,5 M KCl, pH 7,0 lub 20 mM fosforan sodu, 2 M NaCl, pH 7.0
- Wyrównać kolumnę za pomocą 5 CV buforu wiążącego.
- Dostosować próbkę do warunków początkowych i nanieść na kolumnę, używając strzykawki lub pompy.
- Przemywać 10 CV buforu wiążącego lub do momentu, gdy w eluencie nie pojawi się żaden materiał (monitorowany przez absorpcję przy A280 nm).
- Elucja 5 CV buforu elucyjnego (elucja stopniowa) lub buforem elucyjnym od 0% do 100% w buforze wiążącym (elucja gradientowa).
Czyszczenie
Przepłukać 5 CV o wysokim pH (100 mM Tris-HCl, 500 mM NaCl, pH 8,5), a następnie o niskim pH (100 mM octan sodu, 500 mM NaCl, pH 4,5). Powtórzyć cztery do pięciu razy.
Usuń wytrącone białka za pomocą 4 CV 100 mM NaOH przy niskiej szybkości przepływu, a następnie przemyj 3 do 4 CV 70% etanolu lub 2 M tiocyjanianu potasu. Alternatywnie, przemyć 2 CV 6 M chlorowodorkiem guanidyny.
Usuń silnie hydrofobowe białka, lipoproteiny i lipidy poprzez przemywanie 3 do 4 CV do 70% etanolu lub 30% izopropanolu. Alternatywnie, przemyć 2 CV detergentu w roztworze zasadowym lub kwaśnym, np. 0,1% niejonowego detergentu w 1 M kwasie octowym przy niskiej szybkości przepływu, a następnie 5 CV 70% etanolu w celu usunięcia pozostałości detergentu. Ponownie skalibrować natychmiast w buforze wiążącym.
Stabilność chemiczna
Stabilny we wszystkich powszechnie stosowanych buforach wodnych, 70% etanolu, 8 M moczniku i 6 M chlorowodorku guanidyny.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?