Immunoprecypitacja białek fuzyjnych FLAG przy użyciu żeli powinowactwa przeciwciał monoklonalnych
- Czym jest znacznik peptydowy FLAG i jak jest on używany do izolowania i oczyszczania białek?
- Przegląd techniczny immunoprecypitacji
- Protokół immunoprecypitacji (IP) białek fuzyjnych FLAG przy użyciu żeli powinowactwa M2
- Purification of Small Amounts of FLAG Fusion Proteins
Immunoprecypitacja (IP) może być stosowana do wydajnej, wysokowydajnej izolacji i oczyszczania białek połączonych ze znacznikiem peptydowym FLAG®. IP przeprowadza się za pomocą żelu powinowactwa ANTI-FLAG® M2, który jest wysoce specyficznym przeciwciałem monoklonalnym związanym kowalencyjnie z żywicą agarozową. Żywica powinowactwa pozwala na skuteczne wiązanie białek znakowanych FLAG® bez potrzeby wstępnych etapów i kalibracji. Immunoprecypitowane białka fuzyjne znakowane FLAG® mogą być skutecznie wymywane z żywicy w warunkach kwaśnych lub poprzez konkurencję z peptydem FLAG®. Immunoprecypitowane białka można następnie analizować pod kątem ich wielkości, modyfikacji potranslacyjnych i interakcji w żelu podczas elektroforezy, a także za pomocą testów aktywności.
Co to jest znacznik peptydowy FLAG i jak jest używany do izolowania i oczyszczania białek?
Peptydy FLAG® są peptydami znacznikowymi stosowanymi do wykrywania i oczyszczania białek. Peptyd znacznikowy FLAG® składa się z ośmiu aminokwasów (DYKDDDDK), które maksymalizują immunogenność, dzięki czemu przeciwciała monoklonalne o wysokim powinowactwie hodowane przeciwko sekwencji FLAG® mogą być stosowane do wykrywania i izolowania białek zawierających peptyd FLAG®. Stosując technikę rekombinacji, peptydy znacznikowe FLAG® mogą być dodawane na N-końcu białka, C-końcu lub N-końcu poprzedzonym resztą metioniny (Met-FLAG®), a także w pozycjach wewnętrznych.br />
Przegląd techniczny immunoprecypitacji
Immunoprecypitacja składa się z następujących etapów i produktów pośrednich: liza komórek, wiązanie specyficznego antygenu z przeciwciałem, kompleks przeciwciało-antygen, precypitacja, płukanie precypitantem i dysocjacja antygenu z kompleksu immunologicznego.
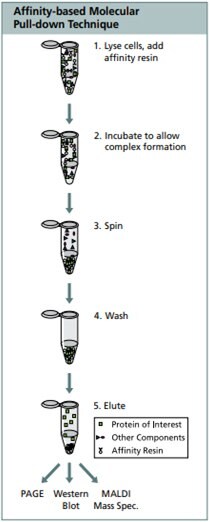
Protokół immunoprecypitacji (IP) białek fuzyjnych FLAG przy użyciu żeli powinowactwa M2, które zawierają przeciwciało monoklonalne M2 związane kowalencyjnie z usieciowanymi 4% kulkami agarozowymi<
Użyj EZ view red anti-FLAG M2 affinity gel F2426 lub Anti-FLAG M2 affinity gel A2220.
Purification of Small Amounts of FLAG Fusion Proteins
Uwaga: Do procedury immunoprecypitacji zalecane są dwie reakcje kontrolne
- Kontrola pozytywna (białko fuzyjne FLAG-BAP, podobnie jak amino-końcowa P7582, karboksykońcowy P7457 lub białko fuzyjne Met-FLAG-BAP P5975)
- Kontrola negatywna (odczynnik ślepy bez białka)
a) Ostrożnie wymieszaj kulki żelu powinowactwa aż do całkowitego zawieszenia. Natychmiast pobrać 40 µL 50% zawiesiny (20 µL objętości upakowanego żelu) do probówki mikrowirówkowej o pojemności 1,5 ml za pomocą końcówki pipety z szerokim otworem lub odciąć 1 mm od końca zwykłej końcówki pipety.
b) Wash/equilibrate beads: Dodaj 500 µl TBS (50 mM Tris HCL, 150 mM NaCl, pH 7,4), wymieszaj i wiruj przez 30-60 sekund przy 5000-8 200 x g. Usuń supernatant, uważając, aby nie uszkodzić kulek.
c) Wash ponownie jak powyżej i umieść probówkę na lodzie, aż próbka będzie gotowa do dodania. Uwaga: Gdy wiele próbek immunoprecypitacji jest przetwarzanych jednocześnie, połączoną ilość potrzebnej żywicy można przemyć razem. Każde płukanie należy wykonać za pomocą TBS o objętości co najmniej 20 razy większej niż całkowita objętość upakowanego żelu. Po przemyciu żywicę można podzielić na żądaną liczbę próbek.
d) Przygotowanie próbek:
- Odwiruj lizat komórkowy (14 000 x g przez 10-15 min w temperaturze 2-4°C)
- Oblicz potrzebną ilość lizatu. Objętość będzie zależeć od poziomu ekspresji białka fuzyjnego FLAG w transfekowanych komórkach.
e) Bind: Dodać 200-1000 µl lizatu komórkowego (w razie potrzeby doprowadzić końcową objętość do 1 ml przez dodanie buforu lizującego [50 mM Tris HCl, pH 7,4, 150 mM NaCl, 1 mM EDTA, 1% Triton X-100]). Uwaga: objętość lizatu będzie zależeć od poziomu ekspresji białka fuzyjnego FLAG w transfekowanych komórkach. Dla kontroli pozytywnej dodać 1 ml TBS i 4 µl 50 ng/µl białka fuzyjnego FLAG-BAP (około 200 ng). Dla kontroli negatywnej dodać 1 mL tylko buforu do lizy. Inkubować wszystkie próbki i kontrole z wytrząsaniem za pomocą wytrząsarki rolkowej lub wytrząsarki typu end-over-end przez około 1-2 godziny w temperaturze 2-8°C (etap wiązania można przedłużyć na noc, aby zapewnić maksymalne wiązanie).
f) Wirować probówkę przez 30 s-1 min przy 5000-8 200 x g. i odessać supernatant (przepływ). Przepływ można zachować, jeśli jest to pożądane.
g) Wash the beads: Dodać 500 µL TBS, worteksować i wirować przez 30 s-1 min przy 5000-8 200 x g. Usunąć supernatant
h) Powtórzyć płukanie jeszcze dwa razy.
i) Elucja próbki: Można wykonać trzy metody elucji, a wybór będzie zależał od charakterystyki znakowanego białka, a także dalszego zastosowania.
- Elucję białka fuzyjnego FLAG można osiągnąć w warunkach natywnych poprzez konkurencję z użyciem peptydu 3X FLAG (F4799). Ta metoda elucji jest najbardziej wydajna.
- Elucję można przeprowadzić w warunkach kwaśnych przy użyciu 0,1 M glicyny HCl, pH 3,5. Ta metoda elucji jest szybka i wydajna, ale wymaga natychmiastowej neutralizacji próbki.
- Elucję można osiągnąć za pomocą elektroforezy przy użyciu buforu do próbek SDS-PAGE. Jeśli ta metoda jest stosowana, kulki nie mogą być użyte ponownie, ponieważ SDS denaturuje przeciwciało M2.
Elucja z 3X peptydem FLAG (F4799)
i. Przygotowanie peptydu 3X FLAG:
- Rozpuścić peptyd 3X FLAG w 0,5 M Tris HCL, pH 7.5 1 M NaCl at final concentration of 25 µg/µL
- Dilute the stock solution 5-fold with diH20 to a final concentration of 5 µg/µL
- Przygotować roztwór roboczy elucji o stężeniu 150 ng/µL, dodając 3 µL roztworu podstawowego o stężeniu 5 µg/µL do 100 µL TBS.
ii. Dodać 100 μL 3X roztworu roboczego do elucji FLAG do każdej próbki i inkubować przez 30 minut w temperaturze 2-8°C z delikatnym wytrząsaniem.
iii. Wirować przez 30 s-1 min przy 5000-8 200 x g. Przenieść supernatant do świeżej probówki. Należy uważać, aby nie przenieść żywicy.
1. Elucja w warunkach kwaśnych (0,1 M glicyna HCl pH -3,5) Procedura wykonywana w temperaturze pokojowej.
i. Dodać 100 µl 0,1 M glicyny HCl, pH 3,5, do każdej próbki
ii. Inkubować przez 5-10 minut z delikatnym wstrząsaniem
iii. Wirować żywicę przez 30 s-1 min z prędkością 5000-8200 x g
iv. Zneutralizować próbkę poprzez przeniesienie supernatantu do świeżych probówek zawierających 10 µL 0,5 M Tris HCl, pH 7,4, z 1,5 M NaCl
v.
2. Elucja buforem do próbek SDS-PAGE (62,5 mM Tris HCl, pH 6,8 z 2% SDS, 10% (v/v) glicerolem i 0.002% błękitu bromofenolowego. Procedura wykonywana w temperaturze pokojowej.
Uwaga: Aby zminimalizować denaturację przeciwciała, nie należy dodawać środka redukującego (DTT lub 2-merkaptoetanolu). Dodanie środków redukujących spowoduje dysocjację ciężkich i lekkich łańcuchów unieruchomionego przeciwciała M2 (pasma 25-50 kDa)
i. Dodać 20 µl 2-krotnego buforu do próbek do każdej próbki
ii. Gotować próbki przez 3 minuty
iii. Wirować przez 30 s - 1 min przy 5000-8200 x g
iv. Przenieść supernatant do świeżej probówki. Próbki są gotowe do załadowania na SDS-PAGE.
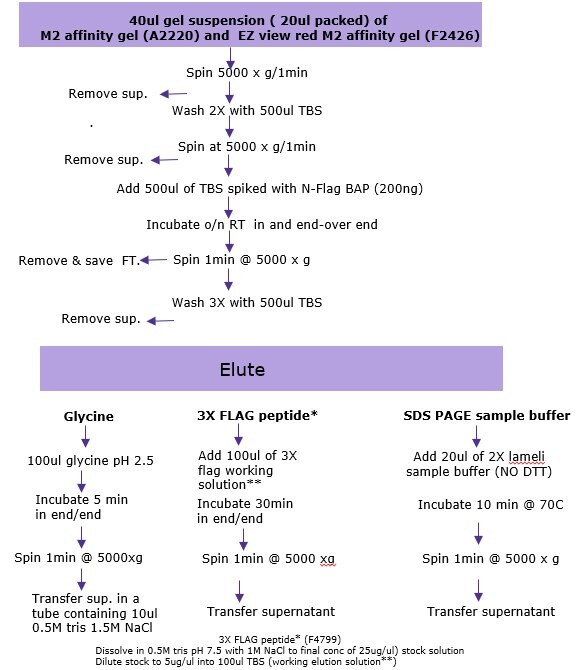
Rysunek 1.Podsumowanie opcji używanych do immunoprecypitacji w trybie wsadowym dla białek o niskiej liczebności
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?