Przewodnik po cytometrii przepływowej
Cytometria przepływowa to technika laboratoryjna wykorzystywana do analizy komórek. Zapoznanie się z podstawami cytometrii przepływowej, metodami immunodetekcji, kluczowymi etapami protokołu cytometrii przepływowej i odpowiednimi kontrolami pomaga zapewnić dokładną analizę cytometryczną. Czytaj dalej, aby odkryć wskazówki, które sprawią, że następny eksperyment cytometrii przepływowej zakończy się sukcesem.
Co to jest cytometria przepływowa?
Cytometria przepływowa jest skuteczną techniką charakteryzowania i/lub sortowania heterogenicznych populacji zawieszonych komórek w oparciu o ich właściwości fizyczne i fluorescencyjne. Można ją uznać za formę analizy pojedynczych komórek, ponieważ cytometria przepływowa dobrze nadaje się do eksperymentów, w których pożądane są informacje ilościowe na poziomie pojedynczej komórki dla dużych ilości komórek jednocześnie. Może to dostarczyć informacji na temat liczby komórek danego typu i ilości określonego białka w komórce.
Niektóre zalety cytometrii przepływowej obejmują szybką analizę, zwracanie uwagi na różnice w subpopulacjach komórek podczas patrzenia na heterogeniczne populacje komórek oraz analizowanie subpopulacji heterogenicznych populacji komórek. Cytometria przepływowa jest powszechnie stosowana w badaniach immunofenotypowych i immunoonkologicznych do analizy różnic hematologicznych we krwi, szpiku kostnym i innych rodzajach próbek.
Jak to działa
Proces cytometrii przepływowej polega na hydrodynamicznym ogniskowaniu próbki zawiesiny komórek w celu utworzenia strumienia pojedynczych komórek, który przechodzi przed laserem. Sposób, w jaki komórka rozprasza padające światło, jest wykorzystywany do określenia wielkości i złożoności wewnątrzkomórkowej komórek z szybkością tysięcy cząstek na sekundę. Wygenerowane dane analogowe są następnie konwertowane na dane cyfrowe, które można określić ilościowo i wykreślić.
Na podstawie pomiarów cytometrii przepływowej można zdefiniować i fizycznie wyizolować określone populacje komórek i podzbiorów w tych komórkach poprzez sortowanie komórek, w którym ładunek komórki jest manipulowany w oparciu o charakterystykę fluorescencji, aby umożliwić elektrostatyczne odchylenie cząstek. Bardziej precyzyjna identyfikacja subpopulacji wymaga użycia sond. Komórki adherentne i tkanki stałe mogą być również analizowane za pomocą tej techniki, jeśli można je skutecznie zdysocjować w celu utworzenia zawiesiny pojedynczych komórek.
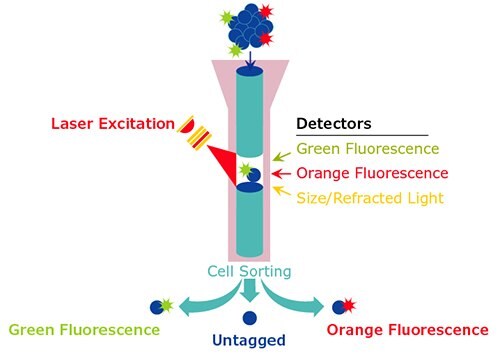
Rysunek 1.Schemat typowej analizy cytometrii przepływowej.
Komponenty tradycyjnego cytometru przepływowego
W przypadku analizy cytometrycznej, nawet podstawowe cytometry przepływowe z pojedynczym laserem są zazwyczaj wyposażone w wystarczającą liczbę filtrów, aby umożliwić jednoczesne wykrywanie czterech fluoroforów. Obecnie możliwe jest rozróżnienie aż 18 długości fal świetlnych w jednym eksperymencie. Składniki tradycyjnego cytometru przepływowego obejmują:
Komory przepływowe do przetwarzania próbek i sortowania komórek
- Komora przepływowa: Komórki w próbce są hydrodynamicznie skupiane i prezentowane laserowi.
Optyka do detekcji fluorescencji
- Światło przechodzi przez system luster i filtrów.
- Komórki mogą być mierzone w oparciu o ich rozmiar, wewnętrzną złożoność i intensywność sygnału.
Elektronika do przetwarzania sygnałów, wyświetlania komputerowego i analizy
- Lampa fotopowielacza przekształca światło w sygnały elektryczne.
- Sygnał jest wzmacniany i digitalizowany.
Immunodetection by Flow Cytometry
Podobnie jak w przypadku innych zastosowań immunodetekcji, istnieje kilka podejść do stosowania przeciwciał do sondowania określonych cząsteczek komórek za pomocą cytometrii przepływowej. Powszechnie stosowane są dwie główne metody: detekcja bezpośrednia i detekcja pośrednia.
Detekcja bezpośrednia
Detekcja bezpośrednia odnosi się do jednoetapowego procesu barwienia, który wykorzystuje pierwotne przeciwciało, które specyficznie wiąże się z epitopem będącym przedmiotem zainteresowania i które jest bezpośrednio sprzężone z cząsteczką, która umożliwia wizualizację lub inne wykrywanie zdarzenia wiązania. W przypadku sondowania antygenów zlokalizowanych na powierzchni komórek, utrwalanie komórek nie jest zalecane, ponieważ proces ten sprawia, że interesujące antygeny są niedostępne dla sond przeciwciał. Dlatego ważne jest, aby nieutrwalone komórki były żywe do czasu zakończenia pozyskiwania danych.Aby znaleźć przeciwciała do bezpośredniego wykrywania, wyszukaj nasze narzędzie Antibody Explorer, ustawiając wyszukiwanie w obrębie na "Primary Antibodies Only" i wybierając aplikację "flow cytometry".
Wykrywanie pośrednie
W metodzie wykrywania pośredniego, po inkubacji z oczyszczonym przeciwciałem w celu umożliwienia wiązania się z antygenem będącym przedmiotem zainteresowania, następuje sprzężone z fluorem przeciwciało drugorzędowe specyficzne dla izotypu gospodarza przeciwciała pierwotnego, tworząc rusztowanie pierwotnego fluorescencyjnego przeciwciała drugorzędowego. Zwiększoną modułowość biblioteki przeciwciał można osiągnąć poprzez zastosowanie oczyszczonych przeciwciał pierwszorzędowych i przeciwciał drugorzędowych sprzężonych z fluoroforem o różnych długościach fali (lub kolorach) i specyficznych dla izotypów gospodarza, w których hodowane są przeciwciała pierwszorzędowe.Aby znaleźć przeciwciała do wykrywania pośredniego, przeszukaj tabelę produktów na naszej stronie przeciwciał drugorzędowych i przefiltruj technikę do "cytometrii przepływowej".
Dowiedz się więcej o wykrywaniu fluorochromów w cytometrii przepływowej z naszych przewodników na .wybór odpowiedniego fluorochromu do eksperymentu cytometrii przepływowej oraz budowanie optymalnego panelu do analizy wielokolorowej.
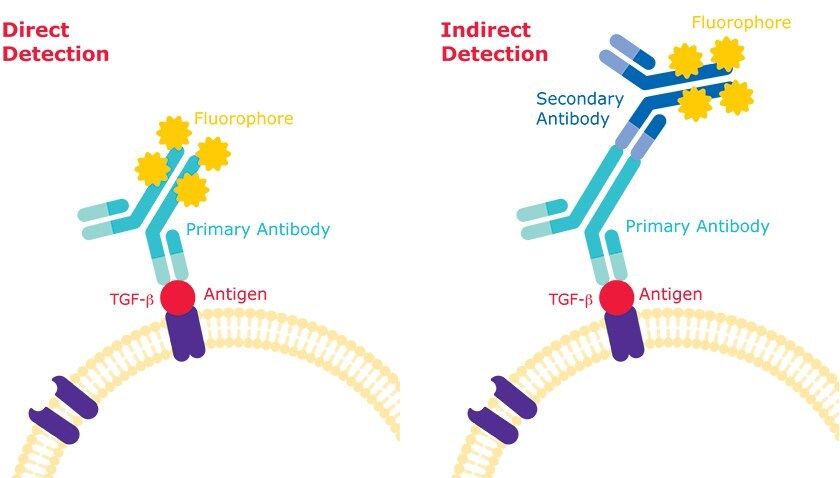
Rysunek 2.Wykrywanie bezpośrednie a metody wykrywania pośredniego w cytometrii przepływowej.
Kluczowe etapy protokołu cytometrii przepływowej
Cztery główne etapy protokołów cytometrii przepływowej to:
- Przygotowanie próbki: Zawiesiny jednokomórkowe powinny być przygotowane poprzez zastosowanie mechanicznych metod dysocjacji i technik odłączania, takich jak stosowanie roztworów enzymatycznych lub odczynników chelatujących wapń.
- Blokowanie: Rozcieńczenie przeciwciał anty-Fc jest zwykle stosowane do zawieszonych komórek, aby zapobiec niespecyficznemu wiązaniu pierwotnego przeciwciała.
- Inubacja przeciwciał: Inkubacja cytometrii przepływowej może obejmować różne składniki, takie jak przeciwciała pierwotne, przeciwciała wtórne, streptawidyna i fluorochromy.
- Akwizycja danych: Większości cytometrów przepływowych towarzyszy niezbędne oprogramowanie do uzyskiwania i przekształcania sygnałów z charakterystyki komórek. Następnie użytkownik ustawia określone parametry oprogramowania dla swojego eksperymentu.
Odkryj więcej szczegółów na temat tych kroków w naszym artykule Key Steps in Flow Cytometry Protocol, lub zapoznaj się ze wskazówkami dotyczącymi rozwiązywania problemów w naszym
Przewodniku rozwiązywania problemów w cytometrii przepływowej.
Właściwe kontrole
Oprócz komórek będących przedmiotem zainteresowania, każdy eksperyment cytometrii przepływowej powinien zawierać następujące kontrole:
- Co najmniej jedna niebarwiona próbka, która była inkubowana z buforem na każdym etapie w tym samym czasie co próbki testowe w celu optymalizacji szybkości przepływu i napięcia w eksperymencie.
- Odpowiednia negatywna próbka kontrolna, która będzie identyczna z próbkami testowymi, z wyjątkiem zastąpienia pierwotnego przeciwciała kontrolą izotypu, która jest hodowana w tym samym gatunku gospodarza co pierwotne przeciwciało. Kontroluje to niespecyficzne wiązanie przeciwciała drugorzędowego. Aby znaleźć kontrole izotypowe, przejrzyj tabelę na naszej stronie Przeciwciała do cytometrii przepływowej. Tabelę można przeszukiwać według słów kluczowych, takich jak "kontrola".
- W miarę możliwości, kontrola pozytywna, która składa się z komórek, o których wiadomo, że wyrażają każdy antygen będący przedmiotem zainteresowania, współinkubowanych z próbkami testowymi i testowanych tylko jednym kolorem.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?