Jak tworzyć i stosować gradienty Percoll
Przygotowanie i rozcieńczenie roztworu podstawowego Percollu
Aby użyć Percollu do przygotowania gradientu, osmolalność Percollu (nierozcieńczonego) musi być najpierw dostosowana za pomocą soli fizjologicznej lub pożywki do hodowli komórkowych, aby Percoll był izotoniczny z fizjologicznymi roztworami soli. Prostym sposobem przygotowania podstawowego izotonicznego roztworu Percollu (SIP) jest dodanie 9 części (v/v) Percollu do 1 części (v/v) 1,5 M NaCl lub 10-krotnie stężonego podłoża do hodowli komórkowych. Ostateczne dostosowanie do wymaganej osmolalności można osiągnąć poprzez dodanie soli lub wody destylowanej. Ponieważ gęstość komórek zależy od osmolalności (rysunek 6), osmolalność roztworu podstawowego powinna być rutynowo sprawdzana za pomocą osmometru, aby zapewnić powtarzalność między eksperymentami. W przypadku cząstek subkomórkowych, które agregują w obecności soli, roztwór podstawowy izotonicznego roztworu Percoll (SIP) można przygotować przez dodanie 9 części (v/v) roztworu Percoll do 1 części (v/v) 2,5 M sacharozy.
Gęstość roztworu SIP można obliczyć z następującego wzoru:

Gdzie:
Vx = objętość medium rozcieńczającego (mL)
Vo = objętość nierozcieńczonego Percollu (mL)
ρo = gęstość Percollu (1.130 + 0,005 g/mL*)
ρ10 = gęstość 1.5 M NaCl = 1,058 g/mL (niewielkie różnice dla innych soli)
gęstość 2,5 M sacharozy = 1,316 g/mL (niewielkie różnice dla innych dodatków)
ρi = gęstość wytworzonego roztworu SIP (g/mL)
Tak więc, dla SIP w soli fizjologicznej, ri = 1.123 g/mL i dla SIP w sacharozie, ri = 1,149 g/mL, przy założeniu ro = 1,130 g/mL.
*Dokładna gęstość podana na certyfikacie analizy.
Rozcieńczanie roztworów podstawowych Percollu do niższych gęstości
Roztwory podstawowe izotonicznego Percollu (SIP) są rozcieńczane do niższych gęstości przez dodanie 0.15 M NaCl (lub pożywki do hodowli komórkowych o normalnej mocy) do pracy z komórkami lub 0,25 M sacharozy podczas pracy z cząstkami subkomórkowymi lub wirusami.
Następujący wzór może być użyty do obliczenia objętości wymaganych do uzyskania roztworu o pożądanej gęstości.
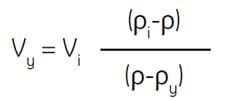
Gdzie:
Vy = objętość medium rozcieńczającego w mL
Vi = objętość SIP w mL
ρi = gęstość SIP w g/mL
ρy = gęstość medium rozcieńczającego w g/mL
(gęstość 0.15 M NaCl wynosi ~1,0046 g/mL) *
(gęstość 0,25 M sacharozy wynosi ~1.032 g/mL)*
ρ = gęstość otrzymanego rozcieńczonego roztworu w g/mL
Przykład: Aby rozcieńczyć 55 mL SIP do końcowej gęstości 1,07 g/mL, określ wymaganą ilość 0,15 M NaCl.

Powyższy wzór jest przydatny do uzyskania gęstości, która będzie bardzo zbliżona do rzeczywistej pożądanej gęstości. Jednak niewielkie różnice w objętości i gęstości rozcieńczanych mediów będą miały wpływ na gęstość końcową. W celu określenia rzeczywistej gęstości zalecamy pomiar końcowej gęstości roztworów Percoll za pomocą densytometru lub refraktometru.
Uwaga: Wykres na rysunku 5 może być również wykorzystany jako empiryczny przewodnik po gęstości roztworów wytworzonych przez rozcieńczenie SIP 0,15 M solą fizjologiczną lub 0,25 M sacharozą. Wykres ten odnosi się do rozcieńczenia SIP, gdzie SIP to 90% (v/v) nierozcieńczony Percoll dostosowany osmotycznie przez dodanie 10% (v/v) soli fizjologicznej lub sacharozy. Aby uniknąć nieporozumień, lepiej jest odnosić się do rzeczywistej gęstości roztworu roboczego (lub podać % SIP) niż odnosić się do roztworu jako procentu Percollu w izoosmotycznej soli fizjologicznej lub sacharozie. Jest to szczególnie ważne w przypadku stosowania jednoetapowej procedury rozcieńczania opisanej poniżej, w której roztwór roboczy o znanej gęstości uzyskuje się przez rozcieńczenie Percollu (nierozcieńczonego) oraz stężonych soli lub sacharozy do końcowej objętości wodą destylowaną.

Rysunek 5.Rozcieńczenie podstawowego izotonicznego roztworu Percoll (SIP) izoosmotycznym roztworem soli fizjologicznej lub sacharozy. Po jest gęstością Percollu (nierozcieńczonego). SIP jest przygotowywany zgodnie z opisem. Przedstawione linie kalibracji służą wyłącznie jako wskazówki. Aby uzyskać dokładne pomiary gęstości, należy odnieść się do wzoru podanego w tekście.
Jednoetapowa procedura rozcieńczania Percollu
Percoll (nierozcieńczony) można rozcieńczyć bezpośrednio w celu uzyskania końcowego roztworu roboczego o znanej gęstości, stosując następującą procedurę. Do cylindra miarowego dodać 1,5 M NaCl lub 2,5 M sacharozy do 1/10 pożądanej objętości końcowej (np. 10 ml dla 100 ml roztworu roboczego). Do tego dodać wymaganą objętość Percollu (nierozcieńczonego), obliczoną według wzoru przedstawionego poniżej. Uzupełnić do końcowej objętości wodą destylowaną.

Gdzie:
Vo = objętość Percollu (nierozcieńczonego) (mL)
V = objętość końcowego roztworu roboczego (mL)
ρ = pożądana gęstość końcowego roztworu (g/mL)
ρo = gęstość Percollu (nierozcieńczonego) (g/mL)
(certyfikat analizy dla dokładnej gęstości)
ρ10 = gęstość 1.5 M NaCl = 1,058 (g/mL)
(niewielkie różnice dla innych soli)
Gęstość 2,5 M sacharozy = 1.316 (g/mL)
(niewielkie różnice dla innych dodatków)
Przykład: Przygotować 100 mL roztworu roboczego Percollu o gęstości 1,07 g/mL w 0,15 M NaCl. Do 10 ml 1,5 M NaCl dodać

Powyższy wzór jest przydatny do uzyskania gęstości, która będzie zbliżona do rzeczywistej pożądanej gęstości. Jednak niewielkie różnice w objętości i gęstości rozcieńczanych mediów będą miały wpływ na gęstość końcową. W celu określenia bardzo dokładnych gęstości zalecamy pomiar gęstości końcowej roztworów Percoll za pomocą densytometru lub refraktometru.
Wykresy podobne do tego pokazanego na rysunku 5 można narysować w celu odniesienia objętości Percoll (nierozcieńczonego) do gęstości końcowej.
Rozcieńczanie roztworu Percoll do pożądanej osmolalności
Aby uzyskać izotoniczny roztwór Percoll dla większości komórek ssaków, zwykle rozcieńcza się 9 części nierozcieńczonego roztworu Percoll z 1 częścią 1,5 M roztworu NaCl lub 2,5 M roztworu sacharozy. Ten podstawowy izotoniczny roztwór Percollu (SIP) jest następnie dalej rozcieńczany buforami fizjologicznymi w zależności od potrzeb. Jednakże, chociaż procedura ta okazała się skuteczna, jest ona dość uproszczona i nie uwzględnia efektu obecności stałych cząstek krzemionki (tj. 100 ml roztworu podstawowego Percollu zawiera pewną objętość stałej krzemionki, co sprawia, że całkowita objętość wodna jest mniejsza niż 100 ml). Ze względu na objętość zajmowaną przez krzemionkę, elektrolity w roztworze podstawowym mają wyższe efektywne stężenie niż w fizjologicznym roztworze soli, a SIP wykonany w ten sposób będzie hiperosmolalny. W związku z tym zawsze zalecano określenie rzeczywistej osmolalności SIP.
Vincent i Nadeau (555) omówili ten problem w elegancki sposób i opisali równanie, które można wykorzystać do obliczenia liczby części Percollu, które należy dodać do jednej części 10-krotnie stężonego buforu soli fizjologicznej, aby uzyskać SIP o dowolnej pożądanej osmolalności. Autorzy określili ułamek całkowitej objętości podstawowego roztworu Percollu, który jest zajmowany przez krzemionkę, a tym samym określili stosunek objętości roztworu wodnego do całkowitego podstawowego roztworu Percollu.

Gdzie:
Vp = liczba części Percollu do dodania
Vc = liczba części rozpuszczonego koncentratu (np. 1,5 M NaCl) do dodania
Oc = osmolalność rozpuszczonego koncentratu (np. 1,5 M NaCl).1,5 M NaCl) do dodania
Oc = osmolalność rozpuszczonego koncentratu (np. 1.5 M NaCl = 2880 mOsm)
Of = pożądana osmolalność
R = stosunek objętości wodnej do całkowitej objętości Percollu (typowo = 0,85 dla NaCl i 0.80 dla sacharozy)
Op = osmolalność nierozcieńczonego roztworu Percoll (certyfikat analizy)
Kluczową zmienną w tym równaniu jest R, które jest miarą rzeczywistej objętości wodnej roztworu Percoll. Wartość R jest funkcją hydrodynamicznej objętości zajmowanej przez cząsteczki Percollu. Ta z kolei jest funkcją siły jonowej ośrodka; to znaczy, że wraz ze wzrostem siły jonowej zmniejsza się objętość hydrodynamiczna. W związku z tym istnieje różnica w wartości R 1,5 M NaCl i 2,5 M sacharozy.
Aby uzyskać SIP o osmolalności = 320 mOsm/kg H2O skorygowanej za pomocą 1,5 M NaCl (tj. 10-krotnie stężonej soli fizjologicznej):

przyjmując:
2880 = osmolalność 1.5 M NaCl
(10× stężona sól fizjologiczna)
20 = osmolalność nierozcieńczonego Percollu
W związku z tym, aby uzyskać SIP 320 mOsm/kg H2O, należałoby dodać 10 części Percollu do 1 części 1,5 M NaCl.
Wpływ osmolalności na pozorną gęstość wyporu komórek i cząstek subkomórkowych
Bardzo niska osmolalność Percollu ułatwiła badanie współzależności osmolalności medium separacyjnego z pozorną gęstością wyporu cząstek. Rysunek 6 pokazuje efekty pasmowania hepatocytów wątroby szczura w gradientach Percolla o osmolalności 200, 300 i 400 mOsm/kg H2O. Pozorna gęstość wyporu komórek wzrasta wraz ze wzrostem osmolalności, z powodu usuwania wody z komórek. Ten sam efekt zaobserwowano w przypadku mitochondriów (Rys. 7) i lizosomów (Tabela 1). Nawet niewielkie zmiany osmolalności powodują duże zmiany w pozornej gęstości wyporu tych organelli. Rzeczywiste zarejestrowane gęstości wyporu cząstek pasmowanych w gradientach Percoll przy fizjologicznej osmolalności są zatem znacznie bardziej prawdopodobne, aby odpowiadały tym istniejącym in vivo, niż gdy cząstki są pasmowane w sacharozie lub innych mediach do wirowania.

Rysunek 6.Frakcjonowanie komórek hepatocytów wątroby szczura (35 × 106 komórek w objętości 2 ml) na samodzielnie wygenerowanym gradiencie Percolla (8 ml roztworu o gęstości 1,065 g/ml). Osmolalność roztworu Percolla zmieniano dodając NaCl do 200 mOsm, 300 mOsm i 400 mOsm. Wirowanie przeprowadzono w rotorze Beckman 30.2 przez 15 minut przy 35 000 × g w temperaturze 4 °C. Gradient gęstości określono przy użyciu Density Marker Beads (strona 23) (27, powielone za uprzejmą zgodą autorów i wydawcy).

Rysunek 7. Rozkład gęstości mitochondriów z komórek wątroby szczura po inkubacji w buforze izoosmotycznym (czerwony) i buforze zawierającym 17,5% albuminy (zielony). Wirowanie przeprowadzono w rotorze Beckman 65 (kąt 23°) przez 30 minut przy 40 000 × g (59, reprodukowane za uprzejmą zgodą autorów i wydawcy).
Frakcja lizosomalna z hepatocytów szczura została odzyskana z gradientu Percoll/0,25 M sacharozy o gęstości od 1,0 do 1,05 g/ml i inkubowana w mediach opisanych w tabeli przez 1 godzinę w temperaturze 37 °C. Gęstość wyporu została następnie ponownie określona w gradiencie Percoll/0,25 M sacharozy (27, powielone za uprzejmą zgodą autorów i wydawcy).
Czynniki wpływające na tworzenie i kształt gradientu
Chociaż uwodniona objętość cząstek Percoll jest mniejsza w obecności 0,15 M NaCl niż w Percoll/0,25 M sacharozy, szybkość sedymentacji cząstek jest szybsza ze względu na niższą lepkość Percoll w soli fizjologicznej. Tak więc, gdy Percoll jest izoosmotyczny z końcowym stężeniem 0,15 M soli fizjologicznej lub pożywki do hodowli tkankowej o równoważnej sile jonowej, utworzy on samoczynnie generowany gradient około 2 do 3 razy szybciej niż równoważny roztwór Percoll wykonany izoosmotycznie z końcowym stężeniem 0,25 M sacharozy.
Wirowanie i czas są ze sobą powiązane, ponieważ jest to całkowita (siła g) × (czas), która określa kształt gradientu. W celu samoczynnego wytworzenia gradientu w rotorach z głowicą kątową należy użyć co najmniej około 10 000 × g dla roztworu Percoll w 0,15 M roztworze soli fizjologicznej i około 25 000 × g dla roztworu Percoll w 0,25 M sacharozie. Geometria wirnika ma wyraźny wpływ na kształt gradientu w danych warunkach, jak pokazano na Rysunku 8. Gdy kąt zbliża się do pionu, długość ścieżki tworzenia gradientu staje się krótsza, a gradient tworzy się szybciej. Rysunki 9 i 10 pokazują, że początkowe stężenie Percollu ma również pewien wpływ na kształt tworzonego gradientu.

Rysunek 8.Wpływ kąta rotora na rozwój gradientu przy użyciu Percoll. Gęstość początkowa wynosiła 1,065 g/ml w 0,15 M NaCl. Warunki pracy: 30 000 × g przez 14 min. Kolorowe linie odnoszą się do pozycji kolorowych kulek Density Marker Beads (45, reprodukowane za uprzejmą zgodą autorów i wydawcy).
Wirowanie w pionowych rotorach bardzo szybko utworzy gradienty Percollu. Należy jednak zachować ostrożność, aby upewnić się, że zagęszczony granulat Percollu, który może powstać w warunkach wirowania z dużą prędkością, nie zanieczyści gradientu podczas frakcjonowania.
Użycie wirników kubełkowych do samodzielnego generowania gradientów nie jest zalecane ze względu na długą ścieżkę i nierównomierną siłę g wzdłuż rury. Jednak Jenkins i wsp. (komunikacja osobista i ref. 87) zgłaszają pewne zalety stosowania tego typu rotorów do subkomórkowego frakcjonowania organelli wątrobowych.
Rotory strefowe mogą być używane do tworzenia gradientów Percollu in situ. Gradienty tworzone w rotorach strefowych mają taką samą charakterystykę jak te generowane w rotorach z głowicą kątową. Ze względu na duże objętości próbek zaleca się empiryczne określenie warunków rozdzielania w rotorze innym niż strefowy przed skalowaniem w rotorze strefowym. Rotory strefowe były używane do oczyszczania wirusów na dużą skalę (21) i do subfrakcjonowania lizosomów (24).
Przy rozpoczynaniu pracy z samodzielnie generowanymi gradientami zaleca się przeprowadzenie modelowego eksperymentu z kolorowymi kulkami Density Marker Beads (strona 22) w celu wytworzenia serii standardowych krzywych w znanych warunkach, które są charakterystyczne dla rotora z głowicą kątową, który ma być używany w kolejnych eksperymentach.

Rysunek 9.Użycie kolorowych kulek do oznaczania gęstości w celu pokazania kształtu gradientu. Gradienty utworzone z roztworów Percollu zmieniających się od 90% do 20% podstawowego izotonicznego Percollu w 0,15 M NaCl. Warunki pracy Wirnik z głowicą kątową 23°, 30 000 × g, 15 min.

Rysunek 10.Użycie kolorowych kulek do oznaczania gęstości w celu pokazania kształtów gradientu. Rozcieńczenia Percoll jak na Rysunku 9, warunki pracy: Wirnik z głowicą kątową 23°, 60 000 × g, 15 min. Stromsze gradienty zostały utworzone przez większą siłę g.
Stopniowe gradienty
Stopniowe gradienty oferują dużą elastyczność i łatwość użycia. Często do uzyskania doskonałego wzbogacenia lub rozdzielczości docelowego typu komórek wystarczy tylko poduszka Percollu lub pojedynczy etap. Na przykład, większość komórek krwi można wzbogacić przy użyciu gradientów nieciągłych (Rysunek 11).
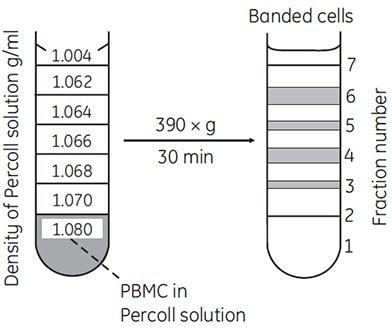
Rysunek 11.Oddzielenie limfocytów i monocytów przez wirowanie z nieciągłą gęstością w Percoll. Od 1,5 do 2,0 × 107 PBMC (komórek jednojądrzastych krwi obwodowej) wyizolowanych na Ficoll-Paque™ zmieszano w 11,25 ml Percollu w BSS Hanksa zawierającym 1% bufor HEPES (gęstość = 1,080 g/ml) i umieszczono poniżej etapów pokazanych na rysunku (69, powielone za uprzejmą zgodą autorów i wydawcy).
Aby utworzyć nieciągły gradient, SIP jest rozcieńczany do serii różnych gęstości, jak opisano na stronie 12. Roztwory o różnej gęstości są następnie ostrożnie układane w kolejności gęstości jeden na drugim, zaczynając od najgęstszego na dnie probówki. Najwygodniej jest to zrobić za pomocą pipety lub strzykawki wyposażonej w igłę o szerokim otworze. Ważne jest, aby końcówka przyrządu przylegała do ścianki probówki tuż nad powierzchnią cieczy, aby uniknąć "rozpryskiwania" i mieszania na granicy faz. Tworzenie się ostrego pasma komórek na interfejsie nastąpi tylko wtedy, gdy nastąpi gwałtowna zmiana gęstości.
Wirowanie przeprowadza się w stosunkowo łagodnych warunkach, takich jak 400 × g przez 15 do 20 minut w wirówce stołowej. Te łagodne warunki powodują izopikniczne pasmowanie komórek na odpowiednich interfejsach. Warunki niskiego g i krótki czas pracy nie spowodują sedymentacji Percollu i nie wpłyną w żaden sposób na gradient.
Ciągłe gradienty liniowe i nieliniowe
Ciągłe gradienty charakteryzują się płynną zmianą gęstości od góry do dołu probówki. Zamiast oczywistych interfejsów obecnych w gradiencie nieciągłym, gradient ciągły można postrzegać jako posiadający nieskończoną liczbę interfejsów. Dlatego izopikniczne pasmowanie komórek występuje przy dokładnej gęstości komórki.
Aby utworzyć taki gradient, SIP jest najpierw rozcieńczany w celu wytworzenia dwóch roztworów o znanej gęstości na granicach wymaganego zakresu, a następnie mieszany przy użyciu dwukomorowego urządzenia do wytwarzania gradientu. Tworzony jest gradient liniowy obejmujący zakres między granicami dwóch roztworów wyjściowych.
Jednokanałowa pompa perystaltyczna w połączeniu z mieszalnikiem gradientowym może być używana do generowania gradientów liniowych, wypukłych i wklęsłych, w zależności od względnych średnic zastosowanych rurek. Można utworzyć bardzo wąski zakres gęstości od góry do dołu gradientu, aby uzyskać maksymalną rozdzielczość żywych komórek. Cięższe komórki zwykle osiadają, podczas gdy nieżywotne komórki znajdują się w górnej części gradientu. Na przykład, erytrocyty ulegną granulacji, jeśli gęstość w dolnej części gradientu nie przekracza 1,08 g/ml. Kulki markera gęstości mogą być używane jako marker zewnętrzny w probówce zawierającej identyczny gradient jak w probówce z próbką.
Warunki wirowania niezbędne do uzyskania separacji są takie same jak w przypadku gradientów nieciągłych. Przykłady separacji wykonywanych na gradientach ciągłych obejmują oczyszczanie komórek Leydiga, laktotrofów, komórek szpiku kostnego, komórek nabłonka jelitowego, mikroalg morskich i chloroplastów.
Wykonane samodzielnie gradienty
Wykonanie gradientu przez wirowanie może być wygodną alternatywą dla użycia urządzenia do wytwarzania gradientu lub pompy. Jak opisano wcześniej, Percoll będzie sedymentował, gdy zostanie poddany znacznym siłom g (tj. 10 000 × g). Podczas wstępnego wykonywania gradientu, SIP jest rozcieńczany do gęstości, która leży w środku zakresu, w którym wymagana jest maksymalna rozdzielczość. Dwie probówki wirówkowe są wypełnione materiałem gradientowym (jedna do eksperymentu i jedna zawierająca kulki markera gęstości). Druga probówka służy zarówno jako przeciwwaga, jak i zewnętrzna metoda monitorowania gradientu. Probówki są odwirowywane w wirniku z głowicą kątową (np. 30 000 × g przez 15 minut), a gradient tworzy się izometrycznie wokół gęstości początkowej (Rysunek 4). Stosunkowo "płaski" obszar gradientu powinien obejmować zakres wymagany dla maksymalnej rozdzielczości komórek docelowych. Można to potwierdzić, obserwując kształt gradientu w probówce zawierającej kulki markera gęstości. Z czasem gradient staje się coraz bardziej stromy. Wykazano, że kształt gradientu jest w przybliżeniu liniowy w zależności od całkowitej siły g i czasu wirowania.
Po utworzeniu gradientu, izopikniczne pasmowanie komórek można osiągnąć przez wirowanie z niską prędkością przez 15 do 20 minut przy 400 × g. Jeśli wymagane jest oszacowanie gęstości komórek, objętość równa objętości zawiesiny komórek jest nakładana na probówkę zawierającą kulki markera gęstości. Służy to zarówno jako sposób oszacowania gęstości komórek, jak i jako przeciwwaga.
Gradienty tworzone in situ
Współczynniki sedymentacji cząstek subkomórkowych i wirusów są zwykle zbyt niskie, aby umożliwić pasmowanie na wstępnie uformowanych gradientach przy niskich siłach g. Dlatego często wygodne jest mieszanie zawiesiny cząstek biologicznych z Percollem i pasmowanie cząstek na gradiencie utworzonym in situ. Gradienty Percollu utworzone przez wirowanie są metastabilne (tj. będą się zmieniać w sposób ciągły podczas wirowania z dużą prędkością). Szybkość sedymentacji koloidu jest wystarczająco wolna, aby umożliwić pasmowanie małych wirusów i organelli komórkowych o wartościach "S" > 60S, gdy gradient jest tworzony in situ.
Powszechną metodą tworzenia gradientów in situ jest przygotowanie SIP, przy użyciu 9 części Percollu do 1 części 2,5 M sacharozy. SIP jest następnie rozcieńczany do pożądanej gęstości przy użyciu 0,25 M sacharozy. (Chociaż sacharoza jest zwykle używana do tworzenia gradientów in situ, można również użyć pożywek do hodowli komórkowych). W przypadku mieszania próbki bezpośrednio z materiałem gradientu, wpływ na ogólną gęstość roztworu Percoll można obliczyć ze wzoru na stronie 13. Wstępne wymieszanie próbki z materiałem gradientowym jest wygodne, gdy pożądany jest dokładny pomiar gęstości wyporu cząstek. Jednak lepszym rozwiązaniem może być nałożenie próbki eksperymentalnej na materiał gradientu, szczególnie w przypadkach, gdy pożądane jest oddzielenie cząstek subkomórkowych od rozpuszczalnych białek. Rozpuszczalne białka pozostaną w warstwie buforu powyżej gradientu, a cząstki subkomórkowe oddzielą się w gradiencie Percoll in situ.
Wirowanie należy przeprowadzić w wirniku z głowicą kątową. Do monitorowania gradientu używana jest probówka wagowa zawierająca kulki markera gęstości zamiast próbki eksperymentalnej. Odpowiedni eksperyment modelowy, podobny do opisanego na stronie 22, powinien być najpierw przeprowadzony w celu ustalenia charakterystyki tworzenia gradientu przez rotor, który ma być użyty.
Maksymalne obciążenie próbki dla gradientów Percoll
Nie ma standardowych zasad regulujących maksymalną ilość komórek lub materiału subkomórkowego, który może być rozdzielony na gradientach Percoll. W przypadku frakcjonowania subkomórkowego, udane oczyszczanie można osiągnąć przy całkowitym obciążeniu od 1 do 5 mg białka w objętości próbki 0,5 ml na 10 ml materiału gradientowego (Pertoft, komunikacja osobista).
Doświadczenie modelowe w celu standaryzacji warunków dla gradientów Percoll
Na dokładny kształt i zakres gradientów powstających podczas wirowania ma wpływ model i kąt zastosowanego rotora oraz rozmiar probówek wirówkowych. Poniższy eksperyment ma na celu umożliwienie ustalenia serii krzywych gradientu dla określonego rotora i probówek i może być używany jako odniesienie dla wszystkich przyszłych eksperymentów.
Wybrany przykład dotyczy gradientów 10 ml, ale można go przeskalować dla większych rozmiarów probówek.
- Zmieszaj 49,5 ml Percollu z 5,5 ml 1,5 M NaCl, aby utworzyć SIP.
- Zmieszaj SIP z kroku 1 z 0,15 M NaCl, aby utworzyć serię 10 ml próbek eksperymentalnych (całkowity rozmiar probówki wirówki = 13,5 ml), jak pokazano w poniższej tabeli:
- Dodaj 10 μL zawiesiny każdego rodzaju kulek Density Marker Beads do każdej probówki zgodnie z instrukcjami dostarczonymi w opakowaniu.
- Wyważ i zakorkuj probówki, a następnie wymieszaj je poprzez kilkukrotne odwrócenie.
- Umieść probówki w rotorze z głowicą kątową (jeśli jest tylko 8 miejsc, pomiń probówki 1 i 10).
- Wiruj przy 30 000 × g przez 15 min.
- Ostrożnie wyjmij probówki i używając milimetrowego papieru milimetrowego zmierz z dokładnością do 0,5 mm odległość każdego pasma od dna probówki.
- Wykreśl kształt gradientu dla każdej probówki, kalibrując każde pasmo z dokładną gęstością wyporu dla każdego koralika markera.
- Ponownie wymieszaj zawartość każdej probówki przez odwrócenie i powtórz wirowanie, tym razem używając 60 000 × g przez 15 min.
- Zmierz gradienty i wykreśl wyniki jak poprzednio. Oblicz dokładną gęstość rozcieńczenia przy użyciu wzoru (strona 13). Rysunki 9 i 10 przedstawiają typowe przykłady serii krzywych wygenerowanych przy użyciu Percollu w 0,15 M NaCl.
Eksperyment można powtórzyć przy użyciu Percollu w 0,25 M sacharozie.25 M sacharozy; w tym przypadku warunki pracy powinny wynosić 50 000 × g przez 25 minut, a następnie 100 000 × g przez 25 minut.
Aby przeliczyć obroty na minutę (RPM) na względną siłę odśrodkową (RCF) lub siłę g, użyj Kalkulatora siły g.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?