About This Item
Wzór empiryczny (zapis Hilla):
C324H478N94O90S8
Masa cząsteczkowa:
7386.36
Numer MDL:
Kod UNSPSC:
12352202
NACRES:
NA.32
Polecane produkty
Formularz
solid
Poziom jakości
Warunki transportu
dry ice
temp. przechowywania
−20°C
informacje o genach
human ... CACNA1G(8913) , CACNA1H(8912) , CACNA1I(8911)
mouse ... CACNA1G(12291) , CACNA1H(58226) , CACNA1I(239556)
rat ... CACNA1G(29717) , CACNA1H(114862) , CACNA1I(56827)
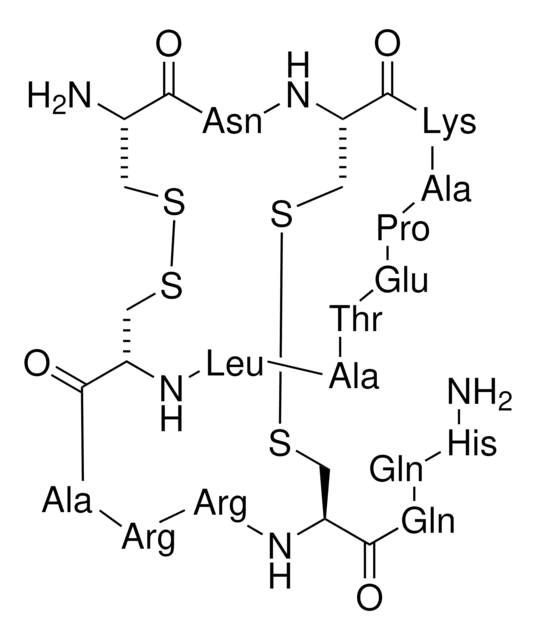
Amino Acid Sequence
Lys-Ile-Asp-Gly-Tyr-Pro-Val-Asp-Tyr-Trp-Asn-Cys-Lys-Arg-Ile-Cys-Trp-Tyr-Asn-Asn-Lys-Tyr-Cys-Asn-Asp-Leu-Cys-Lys-Gly-Leu-Lys-Ala-Asp-Ser-Gly-Tyr-Cys-Trp-Gly-Trp-Thr-Leu-Ser-Cys-Tyr-Cys-Gln-Gly-Leu-Pro-Asp-Asn-Ala-Arg-Ile-Lys-Arg-Ser-Gly-Arg-Cys-Arg-Ala
Opis ogólny
Kurtoxin is hydrophobic in nature and shares sequence identity with α-scorpion and has cysteine-stabilized α-helix and β-sheet (CSαβ) motif. It interacts with N-type, and P-type calcium (Ca2+) channels as well.
Zastosowanie
Kurtoxin has been used as a blocker of T-type and R-Type voltage-gated calcium channels (VGGCs) in hippocampal neurons.
Działania biochem./fizjol.
Kurtoxin is isolated from the venom of the South African scorpion Parabuthus transvaalicus. It associates with voltage-gated sodium channels and delays their inactivation.
T-type Ca2+ channel blocker; Scorpion toxin
Ta strona może zawierać tekst przetłumaczony maszynowo.
Kod klasy składowania
11 - Combustible Solids
Klasa zagrożenia wodnego (WGK)
WGK 3
Temperatura zapłonu (°F)
Not applicable
Temperatura zapłonu (°C)
Not applicable
Środki ochrony indywidualnej
Eyeshields, Gloves, type N95 (US)
Wybierz jedną z najnowszych wersji:
Masz już ten produkt?
Dokumenty związane z niedawno zakupionymi produktami zostały zamieszczone w Bibliotece dokumentów.
Serguei S Sidach et al.
The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(6), 2023-2034 (2002-03-16)
Studies of Ca channels expressed in oocytes have identified kurtoxin as a promising tool for functional and structural studies of low-threshold T-type Ca channels. This peptide, isolated from the venomous scorpion Parabuthus transvaalicus, inhibits low-threshold alpha1G and alpha1H Ca channels
R S Chuang et al.
Nature neuroscience, 1(8), 668-674 (1999-04-10)
The biophysical properties of T-type voltage-gated calcium channels are well suited to pacemaking and to supporting calcium flux near the resting membrane potential in both excitable and non-excitable cells. We have identified a new scorpion toxin (kurtoxin) that binds to
Giulietta Pinato et al.
Journal of cellular physiology, 220(3), 727-747 (2009-05-15)
Blockage of GABA-A receptors in hippocampal neuronal cultures triggers synchronous bursts of spikes initiating neuronal plasticity, partly mediated by changes of gene expression. By using specific pharmacological blockers, we have investigated which sources of Ca2+ entry primarily control changes of
Chul Won Lee et al.
Biochemistry, 51(9), 1862-1873 (2012-02-15)
Kurtoxin is a 63-amino acid polypeptide isolated from the venom of the South African scorpion Parabuthus transvaalicus. It is the first and only peptide ligand known to interact with Cav3 (T-type) voltage-gated Ca(2+) channels with high affinity and to modify
Chul Won Lee et al.
Biochemical and biophysical research communications, 416(3-4), 277-282 (2011-11-19)
Kurtoxin, a 63-amino acid peptide stabilized by four disulfide bonds, is the first reported peptide inhibitor of T-type voltage-gated calcium channels. Although T-type calcium channels have been implicated in a number of disease states, including epilepsy, chronic pain, hypertension and
Nasz zespół naukowców ma doświadczenie we wszystkich obszarach badań, w tym w naukach przyrodniczych, materiałoznawstwie, syntezie chemicznej, chromatografii, analityce i wielu innych dziedzinach.
Skontaktuj się z zespołem ds. pomocy technicznej