Duolink® PLA試験を正しく実行するには、アッセイプロトコルを適切に準備、セットアップおよび実施するための考慮事項に従う必要があります。Duolink® PLA製品には、蛍光用と明視野顕微鏡用があります。蛍光用Duolink® PLA試薬は、顕微鏡とフローサイトメトリーの両方のアプリケーションフォーマットで使用できます。
実験計画
Duolink® PLA試験を正しく計画するにあたり考慮すべき要素は数多くあります。以下にその一部を示します:
- 標的タンパク質・アッセイタイプの決定
- サンプルの選択(細胞または組織)
- 測定計画の立案
- 実験制御の計画(技術的・生物学的)
標的の特定
まず始めに、対象となる標的タンパク質を決定します。単一発現タンパク質、タンパク質間相互作用(PPI)、またはタンパク質翻訳後修飾(PTM)などから選択します。Duolink® PLAを使用して種々のタイプの標的タンパク質を検出する方法について、以下に簡単に説明します。
単一発現タンパク質の検出
単一標的タンパク質を検出する方法には、標的に対して1つの一次抗体を用いる方法(単独識別)と2つの一次抗体を用いる方法(二重識別)の2通りがあります。
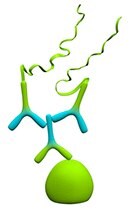
図1.単独識別
単独識別は最高感度をもたらし、発現レベルの低い状態で存在する単一標的タンパク質の検出に推奨されます。この方法は、2つの抗体を使用する試験の前に、個々の一次抗体の濃度を測定するためにも有用です。しかし、この方法が推奨されるのは、十分に機能する特異的一次抗体の利用が可能な場合に限られます。非特異的一次抗体を使用すると、アッセイの感度が影響を受けてバックグラウンドが高くなります。

図2.二重識別
二重識別は、2つの一次抗体の使用によって特異性を向上させます。各一次抗体は、同じ標的分子上の異なる非競合的エピトープを標的とする必要があります。また、2つの一次抗体は、異なる動物種(マウス、ウサギ、またはヤギ)で生成され、同じ試験条件下で標的と結合しなければなりません。これらの条件については、この後のアッセイの準備のセクションで詳しく説明します。
タンパク質間相互作用の検出
Duolink® PLAは、タンパク質相互作用を検出するための優れた方法を提供します。検出は、2つの一次抗体を用いて行われます。各抗体はいずれかの対象標的に対する抗体であり、またそれぞれ異なる動物種(マウス、ウサギ、またはヤギ)で生成されます。この2つの一次抗体は、同じ試験条件下で標的と結合しなければなりません。

図3.タンパク質間相互作用
タンパク質-核酸相互作用の検出
修飾in situハイブリダイゼーション技術とDuolink® PLAの組み合わせにより、タンパク質-DNAおよびタンパク質-RNA相互作用を検出することもできます。Duolink® PLAを用いたタンパク質-DNAまたはタンパク質-RNA相互作用の検出について詳しくは、参考文献をご覧ください。
サンプルの選択
サンプルと標的タンパク質に関する予備知識は重要です。既知の標的発現タンパク質を用いたシステムを選択すれば、Duolink® PLA試験で成果が上げられる機会が格段に高まります。
Duolink® PLA試験に必要なサンプルは、従来の免疫蛍光法(IF)、免疫組織染色(IHC)、またはフローサイトメトリーで使用するサンプルと同じです。Duolink® PLA試薬は、以下を含む広範なサンプルタイプに使用できます:
- 接着細胞
- 細胞懸濁液
- 血液細胞
- サイトスピン調製
- パラフィン包埋細胞サンプル
- パラフィン包埋組織切片
- 冷凍凍結組織切片
- 新鮮組織切片
Duolink® PLA試験を実施する前に、すべてのサンプルを固定してください。フローサイトメトリーアプリケーションの場合は、細胞浮遊液を使用する必要があります。
測定手段の選択
Duolink® PLA製品には、蛍光用と明視野用があります。蛍光用Duolink® PLA試薬は、顕微鏡とフローサイトメトリーの両方のアプリケーションフォーマットで使用できます。
測定手段を選択する際は、利用できる専用装置を考慮することが重要です。Duolink® PLA試験に用いられる最も一般的な測定手段は、蛍光顕微鏡です。上述したすべてのサンプルタイプは、蛍光用Duolink® PLA試薬を使用できますが、サンプルのなかには顕著な自己蛍光を示すものもあります。そのような場合、あるいは蛍光装置を利用できない場合は、明視野用Duolink® PLAを光学顕微鏡とともに使用できます。
フローサイトメトリー法は、装置のタイプに依存せず(計画した実験に適したフィルターを利用できることが前提)、接着細胞や細胞懸濁液に容易に適用できます。
実験制御
Duolink® PLAから得られるのは、タンパク質の事象(発現、相互作用または修飾)の相対的な定量結果です。そのため、技術的制御と、可能な場合には生物学的制御を取り入れることが重要です。
技術的制御
すべてのDuolink® PLA試験で取り入れるべき技術的制御は、2つあります。具体的には:
- 各一次抗体を個別に省略する
- 各一次抗体の非特異的結合の検出に使用
- 最適な一次抗体力価の決定に有用
- すべての一次抗体を省略する
- システム内のDuolink® PLAプローブの非特異的結合の検出に使用
生物学的制御
技術的制御に加えて、生物学的制御の使用が強く推奨されます。ポジティブとネガティブ両方の生物学的制御から、価値のある情報が得られます。
- ポジティブコントロール
- タンパク質発現、相互作用または修飾が判明している個別のサンプルを試験試薬に含める
- 誘導系(例えば、増殖因子刺激、熱ショックなど)の使用により、Duolink® PLAシグナルの生物学的関連性を得る
- ネガティブコントロール
- タンパク質標的を発現しないサンプルの使用(例えば、ノックアウト、サイレンシングなど)により、一次抗体の特異性に関する情報を得る
- 関連のない抗体(例えば、アイソタイプIgG、非結合タンパク質に対する抗体など)の使用により、Duolink® PLAプローブの特異性に関する情報を得る
- タンパク質の相互作用や修飾を妨げる阻害剤の使用により、Duolink® PLAシグナルの生物学的関連性を得る
アッセイの準備
Duolink® PLA試験を正しく実行するには、しっかりと準備を行う必要があります。この準備作業は、従来法のIF、IHCまたはフローサイトメトリーに要する作業と同じです。このセクションでは、一次抗体の特定、サンプルの調製、および抗体の最適化に関する考慮事項について詳しく説明します。
一次抗体の選択
Duolink® PLA試薬は、二次抗体を使用して標的特異的な一次抗体の存在を検出するための多用途な試薬です。Duolink® PLA試験のセットアップにあたり、一次抗体の選択はきわめて重要です。
必要条件
Duolink® PLAプローブは、ロバ抗マウス、抗ウサギ、または抗ヤギ二次抗体です。従って、一次抗体に関する一定の必要条件があります。具体的には:
- 宿主はマウス、ウサギ、またはヤギであること(これ以外の場合はDuolink®プローブメーカーの使用が必要)
- IgGクラス
- モノクローナルまたはポリクローナルが可能
- 交差反応を最小限に抑えるためにアフィニティー精製が望ましい
- IFまたはIHCによるバリデーションを推奨
直接結合一次抗体の使用
直接結合一次抗体の使用が必要な場合があります。Duolink®プローブメーカーを使用すると、PLAオリゴ(PLUSまたはMINUS)をあらゆる抗体と結合できます。以下の場合に、Duolink®プローブメーカーの使用が検討されます:
- 一次抗体の宿主がマウス、ウサギ、またはヤギ以外の場合
- 同じ動物種から2つの一次抗体を使用する場合
- 同じ宿主から産生された一次抗体を組織サンプルとして(例えば、「マウスをマウスに」)使用する場合
一次抗体の最適化
Duolink® PLA試験を正しく実行するには、一次抗体が試験対象サンプル内で最適な性能を発揮できる条件を特定することが重要です。考慮すべき一次抗体最適化の条件を以下に示します:
- サンプル処理(固定、透過化、および抗原回復)
- 一次抗体の濃度
- ブロッキング溶液と抗体希釈剤
サンプル処理、ブロッキング、および抗体希釈剤のそれぞれについて考慮すべき事項を、以下に示します。一次抗体に関する条件を、まずIFまたはIHC染色によって特定することが強く推奨されます。2つの一次抗体を用いる場合は、各一次抗体の最適化を個別に行う必要がありますが、サンプル処理は両方の一次抗体に対し最適な性能を両立させるものでなければなりません。
IFまたはIHCによって条件が決定されれば、Duolink® PLAにこれらの条件を適用できます。しかし、Duolink® PLAはIFやIHCよりもはるかに高感度で、シグナルが大きく増幅されるため、Duolink® PLA試験に用いる一次抗体濃度の滴定が必要になる場合があります。一次抗体の濃度を最適化する際は、上述したDuolink® PLAの単独識別法を用いれば最高感度が得られます。これらの条件は、両方の一次抗体を用いたDuolink® PLA試験に使用できます。
サンプル処理
サンプルには、固定、透過化、およびエピトープ回復の処理が適切に行われなければなりません。アッセイの性能を発揮させるには、試験に使用する一次抗体の条件を最適化することが重要です。
固定
細胞構造と細胞下構造を維持しながら抗原を固定化するために、固定が用いられます。固定剤の選択は、サンプルタイプ(細胞または組織)、一次抗体およびタンパク質標的に大きく依存することがあります。固定剤が異なると、抗原性、つまり一次抗体の性能に影響を及ぼすおそれがあります。選択した一次抗体に推奨される固定剤がない場合は、ユーザーによる最適化が必要です。
Duolink® PLA試薬は、IFおよびIHCに通常使用される、例えば以下のような固定剤のすべてに適合します:
- アセトン
- エタノール
- ホルマリン
- メタノール
- パラホルムアルデヒド
- 亜鉛
透過化
抗体が細胞内エピトープにアクセスするためには、透過化が必要です。通常は、Triton X-100、NP-40、Tween-20、またはジギトニンなどの界面活性剤の使用によって行われます。さまざまな界面活性剤が利用できますので、使用する固定剤やサンプルに最適なものを使用してください。注目すべきは一部の固定剤(例えば、アセトン、エタノール)も透過化をもたらすことで、これを用いれば透過化の追加ステップを不要にできます。
抗原賦活化
固定の際にマスキングされたエピトープを顕在化させて抗体結合を可能にするために、抗原賦活化が使用されます。抗原賦活化に最もよく使用されるのは、ホルマリン固定とパラフィン包埋(FFPE)のサンプルですが、懸濁液中の固定細胞に使用されることもあります。抗原賦活化に使用する方法が異なると一次抗体の性能に影響を及ぼすおそれがあるため、ユーザーによる最適化が必要です。
主要な方法には、熱処理抗原賦活化(HIER)とタンパク質分解酵素処理抗原賦活化(PIER)の2つがあります。Duolink® PLAは、IHCに使用される、例えば以下のような一般的な抗原賦活化バッファーに適合します。
- HIER:Trilogy™、クエン酸塩、EDTA、および高pH Tris
- PIER:プロテイナーゼK、ペプシン、およびトリプシンによる処理
ブロッキング溶液・抗体希釈剤
Duolink®ブロッキング溶液および抗体希釈剤は、Duolink® PLAプローブ(PLUSおよびMINUS)とともに提供されます。これらの溶液は、Duolink® PLA試薬に使用して、抗体の非特異的結合とオリゴの検出を最小限に抑えるように最適化されています。しかし、使用する一次抗体がこれらの条件下で対象タンパク質標的と特異的に結合することを確認することは重要です。Duolink® PLA単独識別アッセイ、あるいはIFやIHCを使用して、各一次抗体を個別に試験する必要があります。
IFまたはIHC染色に使用するブロッキング溶液および/または抗体希釈剤をすでに特定済みの場合は、Duolink® PLAにもこれらを使用できると思われます。使用する一次抗体と同じ動物種由来のアイソタイプIgGは、Duolink® PLAプローブから誤ったシグナルが生じる原因となるため、これらの溶液のブロッキング試薬として使用しないでください。
付録
反応量
最良の結果を得るには、反応量を反応面積に合わせて調整する必要があります。1 cm2面積あたりの反応量は、40 μLが最適です。反応面積に応じて容量を調整してください。15 μL未満の総反応量は絶対に使用しないでください。
小面積に関する指針
0.2 cm2 – 15 μL総反応量
1 cm2 – 40 μL総反応量
2 cm2 – 80 μL総反応量
3 cm2 – 120 μL総反応量

図4.
大面積に関する指針
1 cm2 – 40 μL総反応量
4 cm2 – 160 μL総反応量
6 cm2 – 240 μL総反応量
8 cm2 – 320 μL総反応量
10 cm2 – 400 μL総反応量

図5.
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?