蛍光標識抗体による免疫染色
免疫蛍光法(Immunofluorescence , IF)では、レーザー光で励起され発光する蛍光色素を標識した抗体を使用します。IFは、ターゲットタンパク質の局在、翻訳後修飾や活性化の確認、および近接するタンパク質やそれらとの複合体形成の解明に用いられています。免疫細胞染色(Immunocytochemistry, ICC)は、細胞のターゲット分子に結合する抗体を用いた解析法として確立された技術ですが、蛍光標識した抗体による免疫検出法と組み合わせたICCは、1942年にCoonsらによって初めて詳細に示されました。 免疫蛍光検出法によって細胞内分子に関する情報を得ることができ、ライフサイエンス研究において最も説得力のある視覚的データを得ることができます。 ICC/IF実験における高品質の画像を得るために、以下のポイントをご参照ください。
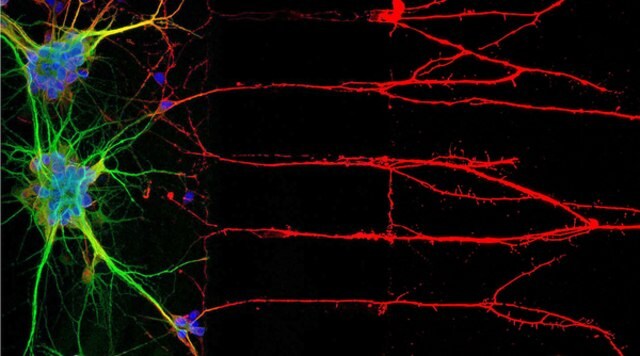
図1.免疫細胞染色(ICC)による神経細胞の核、神経細胞体、および軸索に関連するタンパク質の局在(左)。免疫蛍光染色によるヒト細胞株U-251 MG(右)。
ICCにおける免疫蛍光検出法:段階的ステップ
ICC/IF用のサンプル調製には基本となるプロトコルがいくつかあります。以下は間接染色法用のプロトコルです:

図2.蛍光免疫検出法
最良の組織染色サンプルを得るために、免疫蛍光染色プロトコルにおける工程で、ターゲット分子の細胞内局在や抗原特性などの要因に応じた最適化をする必要があります。
サンプル調製:
高品質なICC/IF結果を得るためには、細胞の培養方法に関わらず、正常な細胞を適切な密度で培養することから始めます。
浮遊細胞:
浮遊細胞の場合、まず培地を除去し、細胞を洗浄してから再懸濁します。次に、懸濁液を小容量チューブに採って細胞を染色します。その後、染色処理した細胞をスライドガラス上に封入して顕微鏡用サンプルとします。 懸濁化した浮遊細胞は、最初に顕微鏡で細胞形態を確認します。また、免疫細胞染色試験に適したサンプルとするために、対象とする細胞株の培養で推奨されるコンフルエント率/力価を超えないよう調製します。正常細胞の培養がサブコンフルエント状態であれば、培地における過度の混濁や酸性を示す黄変を生じることはなく、細胞が明るい円形をなしていることが顕微鏡で確認されるはずです。生細胞数の割合は、血球計算盤およびトリパンブルー色素排除法により測定することができます。細胞を洗浄した後、溶液中でのICC染色、または塗抹法による高接着性細胞用に特別な処理を施したスライドガラス上での染色いずれの場合においても、細胞濃度が1~2 x 106 cells/mLになるよう再懸濁します。
接着細胞を用いる場合、チャンバースライドに播種(および必要に応じ細胞処理)して培養することでICC/IFによるターゲット分子の発現状況の検討ができます。チャンバースライドは、顕微鏡での観察用に最適化されたスライドガラスで、ウェルが1つもしくは複数からなる製品もあり、培養するための培地添加が可能です。チャンバースライドを用いることにより、培養後すぐに細胞を染色し、顕微鏡で染色サンプルを解析することができます。 接着細胞についても、顕微鏡用カバースリップ上に細胞を播種し、培地を入れたウェルに浸してから染色および封入処理を施して顕微鏡用のサンプルとすることができます。
カバースリップ上、あるいはスライドチャンバー内での培養のいずれにおいても、細胞の増殖は慎重にモニタリングする必要があります。これにより、細胞が過剰に増殖する前に細胞を培養液から回収して固定化し、免疫細胞染色用のサンプルとすることができます。 細胞は、(培養面が細胞で覆われる割合が)50~80%コンフルエントになった状態で染色してICCサンプルとすることが一般的です。 免疫染色する前に細胞生存率を測定する必要がある場合、無傷の生細胞膜は透過しないエチジウムホモダイマーなどの核マーカー色素を用います。生細胞と死細胞いずれの細胞核にも反応して蛍光を発するDAPIを併用することにより、エチジウム単独染色核の数とエチジウム+DAPIの2重染色核の数から、生細胞数の割合を算出することができます。これ以外にも、細胞の生死判定用として市販されているLive/Dead Cell Kitを使用することができます。これらのキットでは、細胞と死細胞の識別にカルセインやヨウ化プロピジウムが用いられています。
固定:
アルコールやアセトンのような有機溶媒を用いれば、細胞の固定と透過処理をワンステップで行うことができます。しかし、ターゲットの抗原分子が細胞膜と結合している場合など、脂質の完全性を維持する必要があるサンプルに対しては、有機溶媒を使用するべきではありません。 ホルムアルデヒド(市販品は大半が重合体のパラホルムアルデヒド)は、タンパク質の分解を防止して細胞の構成成分を本来の位置に固定するために一般的に使用されています。しかし、アルデヒド架橋の影響で抗原に対する抗体のアクセスが阻害されることがあるため、ホルムアルデヒドは可能な限り低い濃度で使用します。濃度1~4%のホルムアルデヒド(パラホルムアルデヒド)で10~20分間のインキュベーションによる固定法が一般的です。これにより、細胞構造を確実に保持することができます。 注記: グルタルアルデヒドは自家蛍光源になるため、IFサンプルの固定剤としては使用しないことをお勧めします。
抗原賦活化:
ターゲットのエピトープが、細胞内の濃密な微小環境で複合体化されたり、サンプルの固定処理によってマスキングされたりすることがあります。抗原を賦活化処理することにより、特定ターゲット抗原に対する抗体の結合が増強されることが確認されています。しかし、典型的な賦活化技術における温度や化学的条件はICCサンプルにとって極めて過酷なため、スライド上で賦活化する場合は予備実験により抗原性が損なわれないことを事前に確認し、処理に際しては最大限の慎重さが求められます。
透過処理:
固定化した細胞を効果的に透過処理するために、Triton-XやTween-20などの界面活性剤が一般的に使用されます。しかし、これらの界面活性剤は脂質成分を無差別に分解するもので、サポニンに比して細胞が激しく損傷する可能性があります。サポニンは植物に含まれているグリコシド(配糖体)で、基本的にオルガネラ膜が損傷を受けることはなく、コレステロールを選択的に分解することによって細胞膜に穴を開けます。標的とする分子が細胞膜の細胞内側に結合して局在する場合は、より強力なTriton-X、Tween-20、Brij、あるいはNP-40のほうが、抗体のターゲットへのアクセスには適している可能性があります。サポニンによる透過性作用は弱く、細胞膜表面抗原の完全性は維持されます。しかし、細胞膜内部までの透過性を確保するには不充分であり、ターゲットが核や他のオルガネラ内の分子の場合、抗体によるターゲットへのアクセスが充分に確保できない可能性があります。サポニンの作用は可逆的で洗浄処理によって消失するため、抗体の抗原へのアクセスを確実にするために、染色処理中はサポニンの作用が維持されていることを確認する必要があります。
ブロッキング:
二次抗体を産生した宿主動物種から最大5%濃度の正常血清を調製して用いることで、非特異的結合を効果的にブロックすることができます。血清が入手できない場合は、二次抗体の非特異的交差反応を阻害するタンパク質ブロッカーとして、ウシ血清アルブミン(BSA)などを、PBSにより上記血清と同じ濃度に希釈して使用します。交差反応を最小限に抑えるために、血清とBSAを併用し、抗体の宿主動物種血清による特異的ブロッキングとBSAによる非特異的ブロッキングを行っているラボもあります。市販のBSA製品は凍結乾燥されているため、使用前に溶解液にします。この際、ろ過をしたり、さらに免疫染色サンプル上に沈着してアーティファクト染色を生じる可能性のある微小粒子の有無を確認したりする必要があります。抗体をブロッキングバッファーで希釈することにより、免疫蛍光染色プロセスを通じてブロッキング効果を維持できる場合もあります。
抗体と蛍光色素の選択
蛍光色素の選択
蛍光色素を用いたICCにより細胞を調べる場合、まずは使用する顕微鏡の光学的構成要素を確認する必要があります。 ICC/IF試験では単一ターゲットを対象とする場合もありますが、大半の蛍光顕微鏡の構成は、核とともに複数のターゲットを同時染色したサンプルを用いたマルチプレックス試験に対応できます。以下は、3種類のターゲットと核を同時染色するマルチプレックス試験において、使用され得る光学系や蛍光色素の例を示しています:
蛍光顕微鏡は、励起波長を照射し、発生する蛍光によって得られる染色像を観察・記録する独特の構造をしており、高輝度のアークランプ、または蛍光色素の励起波長に適合する特異的波長のレーザー光源が組み込まれています。種々のフィルターを用いて、励起された蛍光色素から生じるさまざまな波長の蛍光を捉えます。蛍光発光を最大限まで捉えたい場合は広域波長フィルターを使用し、特異性を高める場合は狭域波長フィルターを使用して蛍光発光スペクトルのオーバーラップを低減化します。上記の表では、蛍光顕微鏡における各要素の設定条件に関する代表例を示しています。 レーザーの種類やフィルターを確認することにより、免疫蛍光法(IF)によるICCやIHCのサンプル調製において、最適な蛍光色素標識抗体を選択することができます。 蛍光顕微鏡に関する専門的知識は、IFを用いた実験デザインに役立ちます。
蛍光色素の選択における他の検討事項
光安定性:光退色、すなわち蛍光発光能に影響をおよぼす蛍光色素の不可逆的な光誘起損傷は、周囲の光や顕微鏡の励起光による過度の露光が原因で発生する可能性があります。FITCやTRITCなどの一般的な蛍光色素の多くは特許などによる使用の制約がなく、かつ長期にわたり販売されていることから汎用されていますが、異なる化学的特性に基づき光安定性を改良して発売された蛍光色素と比べると光退色には敏感です。
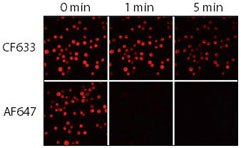
図3.CF633またはAlexa Fluor® 647(AF647)で標識したヤギ抗マウス抗体を用い、各蛍光色素の光安定性を比較。Jurkat細胞を固定・透過処理してウサギ抗CD3抗体を反応させた後、CF633またはAlexa Fluor® 647で標識したヤギ抗ウサギ抗体により染色。水銀アークランプにCy5フィルターを装着し、CCDカメラで細胞を撮影した。連続イメージは0分後、1分後、5分後に撮影。
蛍光標識プローブを含む抗体試薬の希釈作業溶液を調製する場合、褐色バイアルなど遮光容器を用いるようにしてください。保存中の非希釈溶液や市販の抗体試薬と比べ、希釈作業溶液は使用に際し露光が長時間におよぶことがあります。遮光容器を用いることで試験中の露光による影響が低減されるため、蛍光色素の退色を防止できる可能性があります。
蛍光色素の保護:蛍光色素標識抗体・関連製品における製品保管方法
蛍光色素標識抗体について、蛍光色素の光安定性と抗体の機能的完全性を維持するために、特別な保存法や取扱いが求められる可能性があります。まず、抗体が製造元指定の温度条件で届けられ、到着後は製造元が推奨する温度下、遮光された状態でラボにおいて保管されていることを確認します。抗体は、同じラベルを貼った小容量チューブに一定量分注することで、凍結融解や保冷剤の変更、その他の温度変化に曝される回数を減らし、さらには周囲光へのばく露を最小限に抑えることで標識抗体の完全性が確保されます。
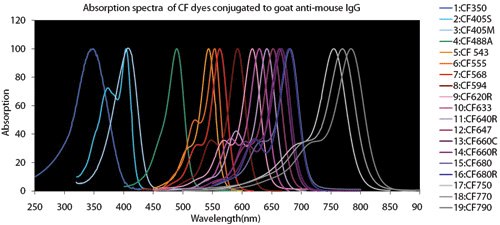
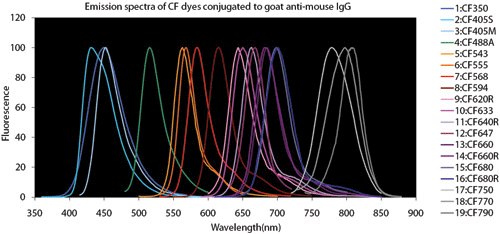
図4.蛍光色素の比較チャート
スペクトルのオーバーラップ:同一サンプルを用いて複数ターゲットを検出するマルチプレックス試験の場合、蛍光色素のスペクトル特性、レーザー光波長、およびフィルターの波長域を確認します。フィルター構成は、吸光スペクトルがオーバーラップしないように顕微鏡の吸収フィルターを選択する必要があります。この際、隣接するフィルターチャネルへのブリードスルー(光の漏れ込み)現象によるロングテールがない蛍光色素を選択することが重要です。

図5.CF543またはAlexa Fluor® 546(AF546)標識のヤギ抗マウス抗体を用い、1タンパク質分子に結合した蛍光色素分子の数(標識度)に対する相対蛍光強度。
抗体の選択:染色技術
抗体の選択:
直接染色法:「直接染色法」は、一次抗体に蛍光色素を直接標識した抗体を使用する方法です。標識抗体によるサンプルの染色と蛍光発光の検出が1回の反応で完了するため、ICC/IF試験に要する時間を削減できます。 この方法では、同一サンプルを用いて複数ターゲットを検出するマルチプレックス染色において、交差反応を避けるために必要な異なる宿主動物種から一次抗体を選択する必要はありません(マルチプレックスICC/IFの詳細は以下の通り)。
蛍光色素標識済み一次抗体を使用する場合、蛍光色素を光退色から保護するために染色処理を暗所で行う必要があります。標識済み一次抗体を反応させてインキュベーションした後、すぐに洗浄して封入処理を行います。サンプル中の複数ターゲットを1回の反応で染色するために、抗体カクテルを使用することもできます。
間接染色法:「間接染色法」による免疫検出では、まずターゲット特異的な非標識一次抗体をサンプルと反応させ、次に一次抗体の宿主動物種を認識する蛍光色素標識済み二次抗体を反応させてターゲットを検出します。 この方法では、複数の蛍光色素を有する二次抗体が一次抗体に結合する可能性があり、抗原部位で蛍光を発する分子数が増えるため、シグナルが増幅するという明確な利点があります。
複数抗原を同時にターゲティングするマルチプレックス試験で間接染色法を使用する場合は、以下の点についても考慮する必要があります。
抗体の選択:抗体の交差性、反応特異性
一次抗体:
間接染色法によるマルチプレックス試験の場合、一次抗体および二次抗体による反応には抗体カクテルを用いることもできます。この場合、一次抗体はターゲットごとに異なる宿主動物種で産生した抗体を用いる必要があります。 これにより、蛍光色素標識済み二次抗体カクテルの各抗体は、対応する動物種の一次抗体と特異的に結合します。各一次抗体の動物種に対応する二次抗体が使用されなかった場合、染色されたサンプルは交差反応がおこらないため解析が不可能になります。 以下は、間接染色法によるマルチプレックスサンプル調製における抗体の選択例です:
この実験例において、ターゲットBに対してウサギを宿主とする一次抗体を使用した場合、蛍光標識済み抗ウサギ二次抗体が、ターゲットAに対する一次抗体とターゲットBに対する一次抗体のいずれにも結合するため、両ターゲットが緑色の蛍光を発することになります。
一次抗体と組織サンプルとの交差反応: 間接染色法で使用する抗体を選択する場合、サンプルと同じ動物種を宿主とする一次抗体の使用は避けてください。具体的には、マウス組織の染色にマウス一次抗体は使用しないことです。 さらに、二次抗体に抗マウス抗体を使用した場合、二次抗体がサンプル組織の広範囲に結合する可能性があり、著しいバックグラウンド染色の原因になります。市販のキットでは、一次抗体の宿主動物種に二次抗体が結合する反応が生じないように構成されています。基本的に、間接染色法に使用する一次抗体にはサンプルと同じ動物種抗体は使用しないことが、交差反応を回避するための最善策です。 注記:通常、直接染色法ではサンプルの動物種と抗体の宿主動物種との交差反応は問題になりません。
二次抗体:
上記の説明(「抗体の選択:染色技術、間接染色法」参照)通り、「間接染色法」によるICC/IFサンプルでは、ターゲットに結合した一次抗体に複数の二次抗体が結合することにより、蛍光発光を増強させることができます。研究において一次抗体の種類が増加し多様化していきますが、標識二次抗体を基本とする間接ICC/IFは種々の一次抗体への効率的な対応が可能になります。これにより、どのようなターゲットに対しても、顕微鏡フィルターのチャネルに対応する標識二次抗体を使用することができます。
洗浄:
抗体などの蛍光標識プローブをサンプルと反応させた後に洗浄処理することで、結合親和性が低い抗体が除去されます。これにより、非特異的結合や交差反応によって生じるバックグラウンドの蛍光シグナルが低減されます。洗浄処理が極めて重要であることは言うまでもありません。 新鮮なPBSによる数分間の洗浄を2回以上繰り返すことにより、染色処理後の組織サンプルに残存する非結合標識抗体や低親和性標識抗体が除去されます。
バッファーへの長時間ばく露によって組織サンプルがスライドガラスやカバースリップから剥離しない限り、洗浄時間の延長は問題にならず、延長することでバックグラウンドが顕著に低下することはありません。 一方、洗浄回数を減らし、かつ洗浄時間を極端に短縮した場合、ターゲットと特異的結合していない標識抗体を効果的に除去することはできず、充分なSN比が得られない可能性があります。
核対比染色と封入処理:
ICC/IF実験において、DAPIやHoechstを用いて細胞核を染色することが一般的に行われています。 これらの核染色剤は、添加して数秒以内にDNAにインターカレーションして蛍光を発します。核染色にDAPIを含む封入剤を使用することにより、核染色と封入処理を1回の処理で完了させることができます。これにより、DAPIやHoechstによる染色反応と洗浄処理を個別に行う必要がなくなり時間を節約でき、さらに、核対比染色における染色剤の濃度やインキュベーション時間のバラツキを減らすことも可能になります。
封入剤はカバースリップをスライドガラスに接着させる効果があり、顕微鏡による観察中にサンプルを乾燥から防ぐことができます。さらに、顕微鏡用に屈折率を最適化するように調製されており、サンプルに結合した蛍光色素の退色を抑制する試薬が含まれている封入剤もあります。
ICC/IFのコントロール
他の実験と同様、ポジティブコントロールやネガティブコントロールを使用することで感度や特異性の確証がなされ、ICC/IFによる試験結果の信頼性が増します。
ICC/IFのコントールにおけるポイントは以下の通りです:
一次抗体反応を忘れる:
ICC実験で容易に思いつく注意点は、間接染色法による免疫検出プロトコルにおいて一次抗体による反応処理を忘れてしまうことです。この問題は、観察される蛍光発光が、標識二次抗体によるサンプルとの直接的な非特異的結合で生じたものかを確認することで明らかになります。
アイソタイプコントロールの使用:
直接染色法において、標識一次抗体の代わりに、同じ蛍光色素で標識したアイソタイプ抗体をコントロールとして使用します。これにより、得られる蛍光発光が、抗原に対する一次抗体の特異性によるものであることが確認されます。アイソタイプコントロール抗体は、通常、標識一次抗体の製造元から入手できます。アイソタイプコントロール抗体は、一次抗体と同じクラスで、イムノグロブリンの種類も同じですが、エピトープに対する特異性がありません。 アイソタイプコントロール抗体を使用することにより、観察される蛍光シグナルが一次抗体タンパク質の“粘着性”によるものではないことが実証されます。
ターゲット抗原非発現細胞の使用:
ターゲット抗原を発現していないことがわかっている細胞株は、ネガティブコントロールとして使用することができます。 遺伝子組換えによりターゲットタンパク質を発現しない細胞(ノックアウト細胞)も、入手可能であればターゲットに対する特異性についての有力なコントロールになります。ネガティブコントロール細胞株の樹立において、ターゲットタンパク質の発現をノックアウトするために、CRISPR/Cas ヌクレアーゼのような遺伝子組換え技術を使用することができます。
ターゲット抗原発現細胞の使用:
ターゲット抗原を発現していることが確認されている細胞が入手可能である場合、ポジティブコントロールとして使用することができます。内因性の発現、あるいは遺伝子組換えによるノックインや過剰発現化のいずれであれ、ターゲットが発現していることが染色処理によって確認されるため、コントロールとして有用です。
ICC/IFにおけるバックグラウンドを回避し最良の蛍光シグナルを得るためのコツ
- ICCへの適応についての確認がされているデータを入手できる抗体を選ぶこと
- 蛍光顕微鏡のレーザー光とフィルターに適応した蛍光色素標識抗体を使うこと
- コンタミネーションや沈殿物がない正常細胞をサブコンフルエントで固定すること
- ターゲット分子とその細胞内局在に応じて、固定と透過処理を最適化すること
- 染色プロトコル中はブロッキングを維持するために、抗体をブロッキングバッファーで希釈すること
- 蛍光色素標識二次抗体を用いる間接染色法により、蛍光発光を増強すること
- 類似のスペクトル特性を有する蛍光色素標識抗体から選ぶ場合、顕微鏡での長時間または繰り返し観察による色素の退色およびスペクトルの重複を回避するために、安定性が高い蛍光色素を選ぶこと
- 染色反応において必ずコントロールを使用すること 可能な限り、ポジティブコントロールとネガティブコントロールの両方を使用すること
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?