体内移植型局所薬物送達プラットフォームとしてのスマートナノファイバーメッシュ
藤澤七海、荏原充宏1, 2, 3
1International Center for Materials Nanoarchitectonics (WPIMANA), National Institute for Materials Science (NIMS), 1-1 Namiki, Tsukuba, Ibaraki 305-0044, Japan, 2Graduate School of Pure and Applied Sciences, University of Tsukuba, 1-1-1 Tennodai, Tsukuba, Ibaraki 305-8577, Japan, 3Graduate School of Industrial Science and Technology, Tokyo University of Science, 6-3-1 Niijuku, Katsushika-Ku, Tokyo 125-8585, Japan
Material Matters 2020, Vol.15 No.3
はじめに
織物・不織材料や複合材料などの分野において繊維素材の担う役割が年々大きくなってきている。特に、直径が数十から数百ナノメートルである“ナノファイバー”は、その高い比表面積、高い空隙率、高い分子配列、ナノサイズ効果などの様々なユニークな特性により新たな繊維材料として大きな注目を集めている(図1A)1。例えば、ナノファイバーは担持させる薬剤の種類や量などに対して幅広い選択肢を有する一方で、それらの放出挙動も容易に制御可能なことから、新たな医療材料としても注目を集めている(図1B)。さらにナノファイバーを不織布状に加工したメッシュは、そのバルク材としての扱いやすさから、外科治療と併用した埋め込み型局所薬物送達プラットフォームとしての利用が期待されている。
図1A)フィルム及びナノファイバーメッシュのイメージ略図。B)ナノファイバーには多様な薬剤・生体分子が容易に内包可能。
これらのナノファイバーはさまざまな方法によって作製することが可能であり、具体的には相分離法、自己集合法、電界紡糸法、延伸法、マイクロ流体デバイス法などが知られている2。このうち最も広く研究されている技術の一つが電界紡糸法(エレクトロスピニング法)である。電界紡糸法は、ポリマー溶液に数万キロボルトの電圧を印可することで紡糸する方法で、マイクロメートル~ナノメートルスケールの均一径の長繊維を比較的安価で容易に作製可能な方法である3。電界紡糸法の適応範囲も広く、ほぼすべての可溶性又は溶融性ポリマーをナノファイバー化できるのも特徴である。
近年、こうしたナノファイバーをさらに機能化したナノファイバーの開発が盛んに行われている。例えば電界紡糸法によって作製されたナノファイバーは、ナノ粒子、カーボンナノチューブ、セラミックス、生体分子、その他の材料をファイバー中に担持させ、新たな機能を持たせることが可能である4。こうした機能性ナノファイバーは、組織工学用の細胞足場材料、バイオセンサー、創傷治癒材など多様な用途への応用を目指し研究が活発である。その中でも特に、透過性、湿潤性、膨潤性を「ON・OFF」で変化させることができるスイッチング機能を持たせた“スマートナノファイバー”が注目を集めている5。スマートナノファイバーの作製にはスマートポリマーと呼ばれるユニークな特性をもつポリマーが使用される。スマートポリマーとは、物理的または化学的刺激に応答してその性質を変化させることが可能なポリマーの総称で、「刺激応答性ポリマー」、「環境応答性ポリマー」、「インテリジェントポリマー」など様々な名前で呼ばれているが、本稿では以後、「スマートポリマー」と呼ぶ。
ナノファイバーは、周囲環境のごくわずかな変化に反応するという特徴を備えている。マクロな構造変化が高速で起こり、しかも可逆的である点が、この材料のユニークな点である。スマートポリマーをナノファイバー化するメリットとして、その高い比表面積から外部刺激に対する応答速度が速いという点が挙げられる6。本稿では、埋植型局所薬物送達プラットフォームとしてのスマートナノファイバーメッシュの応用に焦点を当て、図2に示す4種を紹介する。これらは徐放性(A型)またはON・OFF(B型)の薬剤放出特性を有するナノファイバーメッシュ、及びこれらに熱源を導入した温熱ナノファイバーメッシュ(それぞれC型及びD型)である。
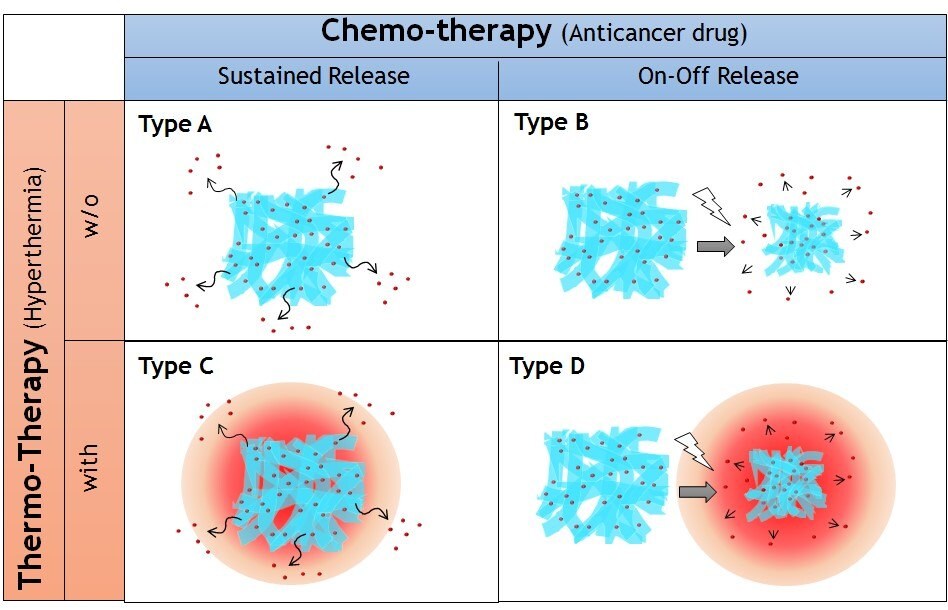
図2本研究で提案する局所薬物送達システム埋め込み型ナノファイバーシステムの4つのタイプ。徐放性(A型)またはON・OFF(B型)の薬剤放出特性を有するナノファイバーとハイパーサーミアとの組み合わせ(それぞれC型及びD型)。
薬剤放出の制御
徐放性放出(A型)
長期薬剤徐放機能を持つスマートナノファイバーメッシュの一例として、末梢神経損傷治療用ナノファイバーメッシュを紹介する。末梢神経が損傷すると、運動麻痺、感覚麻痺及び自律神経障害が生じうる。末梢神経損傷に対する標準治療法として、切創を直接縫合したり、身体の他の部分から神経を採取して移植する方法があるが、最近では神経再生を促進するために用いる人工神経の開発が盛んに行われている。
こうした背景のもと、著者らの研究グループは、損傷した末梢神経の周囲に直接巻き付けて再生を促し機能を回復させるナノファイバーメッシュを開発した。このナノファイバーメッシュの材料には、米国食品医薬品局(FDA:U.S. Food and Drug Administration)でも承認されている生分解性脂肪族ポリエステルであるポリ(ε-カプロラクトン)(PCL)を用いた7。PCLは、オクタン酸スズを触媒に使用した開始剤末端水酸基からの開環重合によって合成された8。PCLナノファイバーメッシュは、1,1,1,3,3,3-ヘキサフルオロイソプロパノール(HFIP)を溶媒に使用し電界紡糸法により製造した。
このメッシュには、活性型ビタミンB12ホモログであるメチルコバラミン(MeCbl:methylcobalamin)が含まれ、これは神経再生及び神経細胞生存の促進に有効なことが示されている。In vitroで試験を行ったところ、PCLナノファイバーメッシュからは少なくとも8週間にわたりMeCblが安定的に徐放された(図3A)。MeCblを担持したナノファイバーシートを局所に埋め込むと、MeCblの血漿濃度に影響することなく、坐骨神経損傷後の運動・感覚機能の回復、神経伝導速度の回復及びミエリン形成の促進が認められた9。このメッシュは現在ヒトでの臨床研究が進行中である。
同様の手法により、基底細胞癌、前立腺癌細胞及び肝癌細胞の治療用にそれぞれ免疫調節薬(図3B)10、不活化ウイルス(図3C)11及びマイクロRNA(図3D)を用いたPCLナノファイバーシステムの検討も行っている。これらの例は、分子の大きさ、形、表面電荷、親・疎水性を問わず異なる種類の分子を簡単に担持できるというナノファイバーの利点を示している。
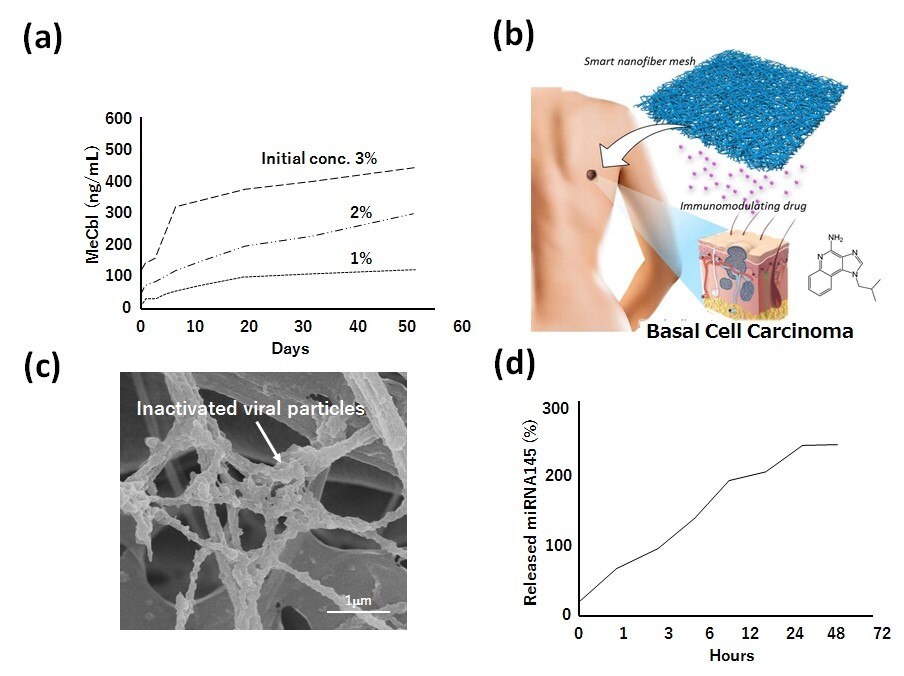
図3A)PCLナノファイバーメッシュからのメチルコバラミン(MeCbl)の薬剤放出挙動。B)基底細胞癌療法のための免疫調節薬封入ナノファイバーメッシュの略図。C)前立腺癌療法のための不活化ウイルス粒子修飾PCLナノファイバーの走査型電子顕微鏡画像。D)PCLナノファイバーメッシュからのマイクロRNA-145の薬剤放出挙動。
「ON・OFF」スイッチングが可能な放出(B型)
徐放型薬物放出に加え、薬剤投与の時間的制御の重要性が化学療法において報告されている。近年、「ドーズデンス化学療法」と呼ばれる新たな投薬の考え方が注目されており、これは用量を上げるのではなく薬剤送達頻度を高めることにより最大限の腫瘍殺傷効果を達成するものである。具体的には、化学療法を3週ごとではなく毎週投与することで、腫瘍細胞の増殖をより抑制可能であることが報告されている13。こうした中、外的刺激によって「ON・OFF」スイッチング的な薬物放出を実現可能なスマートナノファイバーメッシュに期待が寄せられている。しかし、スマートナノファイバーの開発における大きな課題の一つは、ナノスケール及び巨視的スケールの両方で動的かつ可逆的に調節可能なファイバー構造を有するナノファイバーの設計である。その一例が、温度応答性のN-イソプロピルアクリルアミド(NIPAAm)とUV反応性のベンゾフェノン(BP:benzophenone)結合コモノマーの共重合体を電界紡糸したナノファイバーメッシュである14。このファイバーは光架橋可能なため、温度に応答した膨潤・収縮、機械的強度及び空隙率などの動的かつ可逆的変化を示した。ただし、この方法の欠点として、BPが疎水性であるため共重合体の相転移温度が著しく低下してしまう。そこで替わりに、親水性のN-ヒドロキシメチルアクリルアミド(HMAAm)を用いて、NIPAAmとHMAAmの共重合体(ポリ(NIPAAm-co-HMAAm))を電界紡糸したスマートナノファイバーを製造した。HMAAmの水酸基は、その後の熱硬化によって架橋されることより、ファイバーの機械的強度の向上を達成した。ポリ(NIPAAm-co-HMAAm)は、直径約600~700 nmのナノファイバーへ紡糸され、熱硬化後も形態が保持された。
得られた架橋ナノファイバーは、水性溶媒中で体温付近での温度変化サイクルに応じた迅速かつ可逆的な容積変化を示した15。また架橋ナノファイバーからモデル薬物のデキストランのON・OFF放出が認められた。6回の温度サイクル後にナノファイバーからはほぼすべてのデキストランが放出される一方、一定温度下でのデキストラン放出量はごくわずかのみであった。これらの薬物放出プロファイルは、疾患の概日リズムに応じて一定量の薬剤放出の制御が可能であることを示している。上記より、喘息、高血圧、心筋梗塞、関節炎など概日変動を示す慢性疾患の最適な治療として、このような「ON・OFF」スイッチングシステムの応用が期待できる。
ハイパーサーミアとの組み合わせ
徐放性放出と温熱(C型)
化学療法は以前より原発性及び転移性癌の標準治療とされてきたが、単一の抗癌剤を投与する場合、その臨床的有用性は依然として限定的である。したがって、臨床治療では2剤以上の抗癌剤を含む併用化学療法を用いて、過去数十年にわたりさまざまな癌の治療が行われてきた。加えて、放射線療法や温熱治療など他の治療と併用化学療法を組み合わせた場合、腫瘍サイズは大幅に減少することが多数の臨床試験で示されている16。温熱療法はハイパーサーミアとも呼ばれ、身体組織を高温(43~45℃)に曝露することにより、癌細胞を死滅させる癌治療の一種である。
ハイパーサーミアは、抗癌剤に対する癌細胞の感受性を高めることにより、パクリタキセル(PTX:paclitaxel)など特定の抗癌剤の効果を促進することもできる。こうした観点から、より効果的な癌治療のために我々は化学療法とハイパーサーミアの組み合わせた併用療法を同時に実現するスマートナノファイバーシステムを設計した(図4A)17。このメッシュは生分解性のPCLとPTX及び磁性ナノ粒子(MNP:magnetic nanoparticle)からなる(図4B)。In vitroで試験を行ったところ、PCLメッシュからは少なくとも6週間にわたり安定的にPTXが徐放された。さらに、持続的な治療効果がin vivoで認められ、腫瘍部位に直接PTXを注入した場合と比べてメッシュから長期間にわたり薬剤を連続して放出した場合、より高い抗腫瘍効果を示した。また、交流磁場(AMF:alternating magnetic field)をメッシュに照射するとナノファイバー内のMNPが局所発熱し、熱による抗癌作用がみられるとともにPTXの化学療法作用が促進されることが示された。結果、相乗的な抗癌作用が得られた。
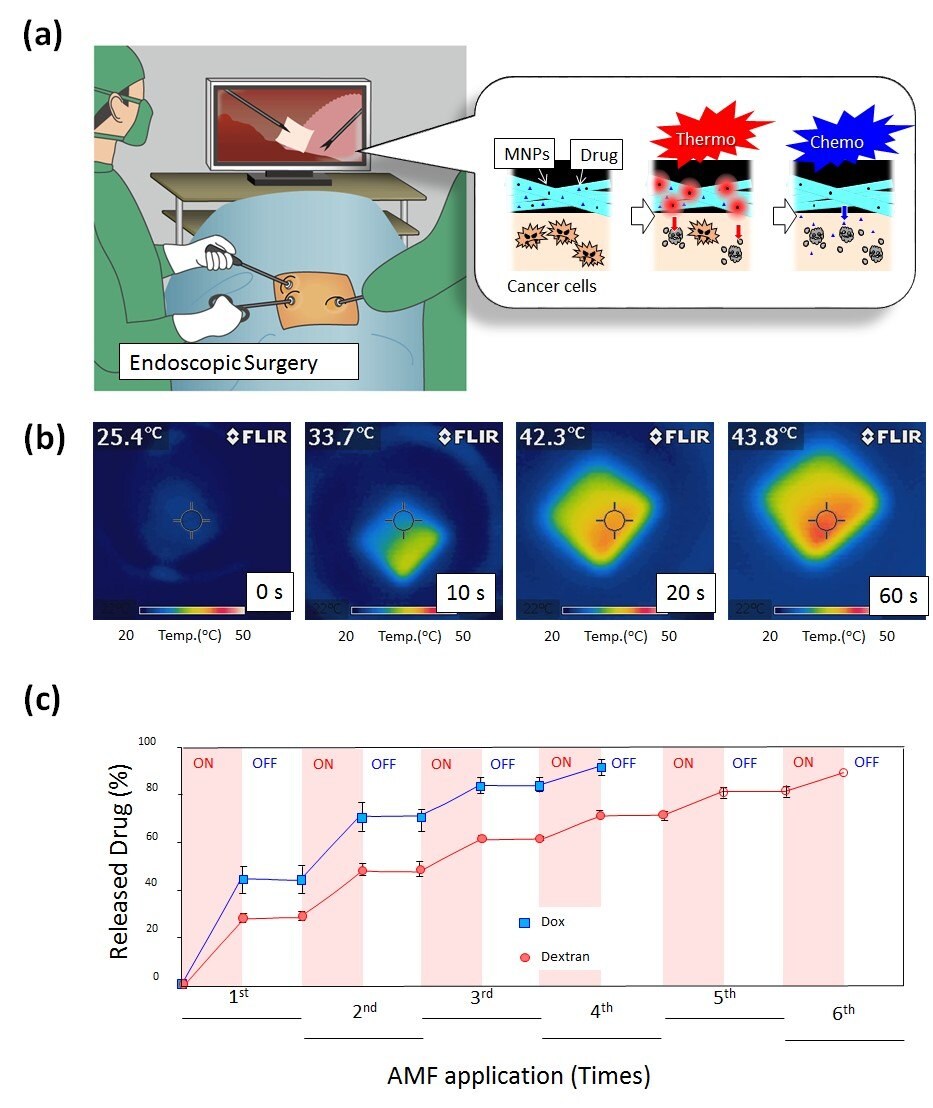
図4A)癌温熱・化学療法のためのON・OFFスイッチングが可能な温度応答性ファイバーメッシュの略図。B)AMF内でのMNP担持ナノファイバーメッシュの赤外線熱画像。C)AMFに応じた温度応答性ナノファイバーメッシュからのDOX及びデキストランの薬剤放出プロファイル。
以上の結果を踏まえ、スマートナノファイバーシステムは今後の癌治療法に有望であり、局所温熱・化学療法の今後の開発に新たな知見を提供することが示唆された。
熱による「ON・OFF」スイッチングが可能な放出と温熱(D型)
ON・OFFスイッチングが可能な薬物送達システムも概日リズムの観点から注目されている18。例えば、時間的プログラム可能な薬物送達システムが時間治療として使用されている。このシステムとハイパーサーミア治療を組み合わせると、温熱によってカスパーゼ7の活性化を介して細胞周期がG2/M期で停止する細胞の割合が増加し、それによりPTXのIC50が低下するため、PTXによる効率的なアポトーシスが促進されることが示されている。
こうした背景を踏まえ著者らは、癌細胞のアポトーシスを誘導するためAMFのON・OFFスイッチング制御によって発熱と薬物放出が同時に実現できるスマートハイパーサーミアナノファイバーメッシュを開発している19。これは化学架橋可能な温度応答性のポリマーであるポリ(NIPAAm-co-HMAAm)と抗癌剤(ドキソルビシン、DOX:doxorubicin)及びMNPからなり、電界紡糸法を用いてナノファイバーメッシュを作製した。
ナノファイバーメッシュは化学架橋を行うことによって水中でナノファイバー形状を維持させ、AMFのON・OFFに応じた脱膨潤・膨潤のスイッチング的な体積変化を示す。AMFの照射により担持させたMNPが発熱することによってナノファイバー内のポリマーネットワークの脱膨潤が誘導され、ナノファイバーからのDOXのON・OFFスイッチング的な放出が認められた(図4C)。ナノファイバーに担持させたMNP及びDOXの存在下でAMF照射を5分間行った結果、温熱・化学併用療法によりヒトメラノーマの70%が死滅した。
このスマートハイパーサーミアナノファイバーメッシュは肺腺癌においても同様の効果を示した。温度応答性メッシュの相転移温度はマイルドハイパーサーミアの温度範囲である約43℃に調節した。In vitroの抗腫瘍試験において、PTXのみを封入したメッシュは細胞を約43%殺傷したのに対し、MNPとPTXの両方を封入したメッシュは細胞を約66%死滅した20。マウス肺癌モデルにおいても、効果的な温熱・化学併用療法の抗腫瘍活性がみられ、かつ抗癌剤が患部局所に放出されることより、マウスに対する全身的な毒性が解消した。提案するこれらの種類のスマートナノファイバーシステムは、安全で有効な癌治療のための次世代局所薬物送達システムとして期待される。
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?