Tanvi Shroff,1 ChangKyu Yoon,2 David H. Gracias1,2
1 Department of Chemical and Biomolecular Engineering, and 2 Department of Materials Science and Engineering, The Johns Hopkins University, Baltimore, MD, USA
Polymeric Drug Delivery Techniques(ドラッグデリバリーにおける高分子科学の手法), 2015, p.28
はじめに
治療薬は、粉末のような単成分の製剤から、カプセル、異方性粒子、微細加工されたニードルパッチなどの多成分の薬物送達システム(DDS:drug delivery system)へと進化しています。効果的なDDSは、スマートかつ多機能でなければなりません。すなわち、特定の時間内に治療対象領域内の特定部位で薬物を放出し、副作用は最小限である必要があります。DDSは、より効果的ながん治療のため、抗体、リガンド、またはアプタマーを使用して細胞受容体を標的にしたり1、酸性が非常に強い胃のような特定の解剖学的領域で溶解して内包物を放出したりすることが可能です2。今までのところ、ポリマー系DDSは、特定の細胞に結合したり生化学的反応で分解したりすることは可能ですが、本質的に静的であり、動的な形状の再構成または変化は起こりません。DDSにおいて形状変化は新しい概念であり、ロボット工学や、細胞または病原体が形状を調節可能であることに着想を得て出現したものです。形状変化により、自律的で環境に応じて機能を多面的に変化できる可能性が生まれます。様々な動的なポリマー系DDSが開発されており、ナノメートルサイズの生体分子を含む構造体からセンチメートルサイズのインプラントまで、そのサイズは広範囲にわたります。これらの新材料は、実験室的な興味の対象から臨床試験まで、その開発段階は多岐にわたります。例えば、DDS用のナノメートルサイズの動的形状変化構造が、DNAのようなスマート生体分子で構成されており、制御可能な蓋を持つ立方体状の箱などの形状に組み立てることが可能です3。本稿では、より大型のマイクロスケールまたはメソスケールのシステムのみを扱い、可逆的な膨潤に基づく動的な薬物送達システムを作製するための形状変化ポリマーマイクロ構造の利用を中心に紹介します。
形状変化するポリマーマイクロ構造
形状記憶ポリマーとハイドロゲルは、おそらく、すべての応答性ポリマーの中で最も重要な種類のものでしょう4–6。通常、これらのシステムは、剛性と柔軟性のある鎖、ないしは疎水性と親水性の構造単位など、2種の分子構造で構成されます。DDSにおける形状記憶ポリマーの利用については別の論文で概説されています7。本稿では、少なくとも1つのハイドロゲル成分で構成される多層およびパターニングしたマイクロ構造の詳細を説明します。この例は、以下の理由から動的薬物送達システムにおける優れたコンセプトの一例です。
- ハイドロゲルの弾性率をはじめとする機械的特性は、ヒトの組織や器官とよく一致します。ハイドロゲルの多くは生体適合性があり、多様な環境的刺激に応答して体積を数桁変化させて膨潤することが可能です8,9。水系の生物学的システムでは、水を吸収または排出することで膨潤または崩壊が起こります。
- ハイドロゲルの膨潤は、pH10、温度11、電場12、生体分子13–17などの多様な刺激に応答して起こすことが可能で、一度に複数の刺激に応答するようにプログラムすることもできます18–20。さらに、in vivoでゲル化を起こすことも可能です21。
- 体積変化が大きいため、膨潤と脱膨潤により大きな機械的変形が生じ、バッテリーやワイヤーなどの他の外部エネルギー供給源を必要とせずに駆動を行うことが可能になります。
- 膨潤性が異なるハイドロゲルまたは勾配を付けて架橋したハイドロゲルを組み合わせた多層構造22により、膨潤の際の体積変化の差を自発的な湾曲または折りたたみに変換し、多様な3次元(3D)形状および構造を形成することが可能です23–25。
- バイオMEMS(microelectromechanical system、微小電気機械システム)の進歩に伴い、フォトリソグラフィ、プリンティング、成形、交互積層法(layer by layer assembly)などの大量生産が可能な方法を使用して、多様な形状やサイズでハイドロゲルのパターンや構造を形成するための複数の技術が開発されています。
【例】セラグリッパー
化学機械的(chemomechanical)に制御された薬物放出のための「セラグリッパー(theragripper)」と呼ばれる自己折りたたみ式DDS26は、温度またはpHの変化に応答して開閉可能な複数の指を持つ手のような形状をしたDDSです。この形状変化を駆動するのは熱応答性ハイドロゲルのポリ(N-イソプロピルアクリルアミド)(pNIPAM)27で、DDS用途や、外科用のより剛性が高い足場材料の作製において広く研究されています。pNIPAMの収縮は、温度が生理的温度以上に上昇したときに、親水性の吸水状態から疎水性の排水状態に転移することで駆動されます。pNIPAMの調整には、フォトリソグラフィ、マイクロ成形、乳化重合、ラジカル重合などを用いることができます28。Shahらは、マイクロ流体デバイスを使用して単分散pNIPAMマイクロゲルを作製する方法や、ゲル化を起こすために必要な条件の設定について概説しています29。
通常、架橋したpNIPAMは弾性率が約150 KPaの比較的柔らかい材料です。物質を掴める程度にセラグリッパーの剛性を高めるため、膨潤性の高いゲルと、弾性率が16 MPaと大幅に剛性が高く膨潤性のないポリプロピレンフマレート(PPF:polypropylene fumarate)が組み合わされて二重層を形成しています。さらに、pH応答性を持たせるため、NIPAMとアクリル酸(AAc:acrylic acid)を共重合させています。この二重層は、以下に説明する手順でポリビニルアルコールの犠牲層の上に、大量生産可能な方法でフォトリソグラフィを用いて手の形状にパターニングされます(図1)。メサラミンやドキソルビシンなどの薬物のセラグリッパーへの充填には、複数の手段が用いられています。その例としては、(a)作製したセラグリッパーを薬物溶液に一夜浸漬し、薬物を多孔性のpNIPAMハイドロゲル層に優先的に浸透させる方法、(b)事前にPPF層に混入させた塩を溶出することで作製されたマイクロポーラスなPPF層に薬物を加える方法、および(c)光架橋反応の前に薬物の乾燥粉末をPPF混合物に導入する方法が挙げられ、特に最後の手法ではより均一に分布させることができます。細胞を把持できることがin vitroで確認されており、薬物の放出は生きたブタの胃においてin vivoで確認されています(図2)26。さらに、このような応答性ポリマーマイクロ構造に磁性ナノ粒子を充填し、磁場を用いて遠隔操作することも可能であり、遠隔誘導の実現につながる可能性があります30。
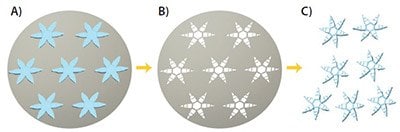
図1微細加工されたセラグリッパー。フォトパターニングで製造された手の形状の二重層マイクロ構造の大量製造法。A)手の形状をした刺激応答性pNIPAMハイドロゲル。B)基板上の剛性ポリマーPPFの分割された層。C)その後の基板からの脱離。

図2セラグリッパーを使用した薬物の充填および送達。A)多孔性ハイドロゲルへの薬物の吸収。B)薬物送達用の柔らかな自立型グリッパー。
展望および課題
自己折りたたみ式の形状変化ハイドロゲルマイクロ構造には、DDSとして多くの利点があります。将来的な応用としては、持続的な薬物放出のための自己付着性デバイス、動脈瘤を防ぐための自己コイリング(coiling)デバイス、自己拡張性をもつ薬物溶出ステント、自己推進能をもつ小型移動デバイスなどが見込まれます。
DDSはin vivoでの応用を目指すものであるため、安全性を確保して毒性を最小限に抑えるため厳格な要件を満たさなければならず、その要件は薬物を放出する解剖学的位置および期間に応じて異なります。先のセラグリッパーの例では、体内でのpNIPAMのバイオセーフティーにはやや疑問があります。一方、pNIPAMは細胞培養容器に広く使用されており、明らかな細胞毒性は観測されていません。また、体内から排出できる可能性を付与するべく、生分解性の架橋剤を用いて作製することも可能です31–33。さらに、pNIPAMの眼科用の配合では、in vitroで細胞毒性がないことが報告されています34。ただし、モノマーであるNIPAMはin vivoで毒性を示す可能性があります35。したがって、このpNIPAMセラグリッパーの例は説明の目的で使用されたものであり、その安全性評価にはさらなる研究が必要であることをここで強調しておきます。また、キトサン36、ゼラチン37、セルロース38、アルギン酸およびヒアルロン酸39、PLGA40、PVA41、PEO、Pluronic®ブロック共重合体のようなPEO-PPO-PEOブロック共重合体、またはポロキサマー42,43など、生体に優しいソフトマテリアルの構造を代わりに使用して、同様な形状変化マイクロ構造の開発に向けたさらなる研究も必要です。
ナノテクノロジーとバイオファブリケーションの大幅な進歩を受けて、将来のDDSには、さらに自己集合および分解、エネルギー散逸、適応のような生体系の特徴が盛り込まれることが予想されます。このようなDDSは動的であり、幅広いサイズにわたって精巧に構築されるでしょう。マクロスケールで設計された複雑なロボット工学デバイスとほぼ同様に、フィードバック、制御、論理といった機能が組み込まれることが予想され、記憶も分子の結合、化学反応、電子回路の組合せを通じて実現される可能性があります。本稿で強調したように、ハイドロゲルの可逆的な膨潤と、屈曲し折りたたまれた3Dマイクロ構造への変形は、外部のエネルギー供給源が存在しない状況で起こることから、多様な自律的形状変化を実現し得ます。結果的に、理想的な治療に向けた壮大なビジョンを実現するための小さな一歩となるスマートな挙動を実現するために役立つ可能性があります。
【プロトコール】セラグリッパーの作製
このプロトコールは、Gracias LaboratoryでPPF/pNIPAMグリッパーを作製するために使用されているものです26,44,45。
1. ストック溶液の調製
a) PVAストック溶液:脱イオン水中に30重量%のPVA(9,000 Da Mw、80%加水分解、360627)溶液を調製します。
b) pNIPAM-AAcストック溶液44:7.5 mLのn-ブタノールを溶媒として、NIPAMモノマー3 g(415324)をpNIPAM 0.4 g(535311)およびビス-アクリルアミド(0.18 g、146072)と混合します。この溶液を一夜撹拌し、未溶解の結晶をデカンテーションで使用前に分離します。デカンテーションの前に、0.31 mLのアクリル酸(147230)をpNIPAMとNIPAMの溶液に混合します。
c) PPFストック溶液45:ポリマーPPFはメリーランド大学John Fisher研究室で合成されました。以下に要約されているPPFの合成は、同研究室が発表しているプロトコールに基づくものです45。簡単に説明すると、モル比3:1のプロピレングリコール(309028)とフマル酸ジエチル(D95654)を、不活性雰囲気で撹拌速度を漸次増加させながら反応させます。フマル酸ジエチル1モルあたり、0.01モルのZnCl2(229997)(触媒)と0.002モルのヒドロキノン(H9003)(架橋阻害剤)を加えます。反応温度を徐々に130℃まで上げると、中間体のフマル酸ビス(ヒドロキシプロピル)と、副生成物の蒸留物としてエタノールが生成します。エタノールの理論的収率の90%が回収されたら、反応の終了点を示しています。
最初の反応に続いて、減圧条件(1 torr未満)下で温度を徐々に130℃まで上げると、中間体のエステル交換によりPPFポリマーと副生成物のプロピレングリコールが生成します。ゲル浸透クロマトグラフィー(GPC)を用いて、所望の分子量のPPF(私たちの場合は952 Da)が得られる反応の終点を決定します。その後、以下の手順で精製します。最初にポリマーを塩化メチレンに溶解し、次に塩酸(320331)、蒸留水、そして塩水溶液で洗浄して、触媒と鎖がより短いポリマーを除去します。硫酸ナトリウムとエチルエーテルで洗浄した後、減圧下でPPF溶液から溶媒を蒸発させて除去します。
2. 犠牲層
PVA溶液を清浄なシリコンウェハ上に3,000 rpmでスピンコートし、115℃で5分間、ホットプレート上で乾燥します。
3. PPF層
PPF溶液を犠牲層の上に3,000 rpmでスピンコートし、Quintelマスクアライナーを使用して強度650 mJ/cm2のUV光に暴露します。
a) pNIPAM-AAc層:100 µLのIrgacure 2100(光開始剤、Ciba)をpNIPAM溶液に加えます。以後の作製工程も含め、溶液の瓶はホイルで覆ったままにします。1 mLのこの溶液をPPF層の上にスピンコートし、強度50 mJ/cm2のUV光に暴露します。最初にエタノール、次に脱イオン水を使用してこれらの2層を現像し、セラグリッパーの形状を出します。
b) セラグリッパーの放出:セラグリッパーが付着したシリコンウェハを脱イオン水に20分間浸漬し、PVA層を溶解して構造物を脱離させます。
4. セラグリッパーへの薬物の充填26
a) 方法1:脱離とともに、セラグリッパーを薬物の溶液に一夜浸漬します。pNIPAMハイドロゲル層の親水性と膨潤能力により、薬品溶液はPPF層よりもハイドロゲル層に多く浸透します。
b) 方法2:5%NaCl 溶液をPPFに加え、上記手順3と同様にスピンコートします。脱イオン水を使用したグリッパーの脱離の際に、脱イオン水によりPPF層から塩も溶出してPPF層内が多孔化します。薬物溶液に浸漬すると、薬物がセラグリッパーの両方の層に進入します。
c) 方法3:薬物の乾燥粉末をPPF層に混合して乾燥充填した後にポリマーを架橋することで、PPF層のポリマーメッシュに薬物を組み込みます。薬物の放出はin vitroとin vivoの両方で制御されます。
本論文の翻訳は山形大学 落合文吾教授に監修いただきました。御礼申し上げます。
掲載誌
「ドラッグデリバリーにおける高分子科学の手法 Polymeric Drug Delivery Techniques」
まとめてご覧になりたい方のためにPDFをご用意しています。
関連製品
PNIPAM
PNIPAM共重合体
その他刺激応答性ポリマー
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?