細胞シート組織工学のためのポリ(N-イソプロピルアクリルアミド) 修飾スマート表面
Masamichi Nakayama1, Teruo Okano1, Françoise M. Winnik2
1Institute of Advanced Biomedical Engineering and Science, Tokyo Women′s Medical University (TWIns), Kawada-cho 8-1, Shinjuku, Tokyo 162-8666, Japan, 2Department of Chemistry and Faculty of Pharmacy, University of Montreal, CP 6128 Succursale Centre Ville, Montreal QC Canada H3C 3J7
Material Matters 2010, Vol.5 No.3

図1(a)ポリ(N-イソプロピルアクリルアミド) グラフト表面への細胞の接着(37℃)と脱着(20℃)を示す概略図。細胞の回収は、温度を下げるだけで行うことができます。(b)37℃と20℃における、PNIPAMをコーティングした培養皿上の内皮細胞の顕微鏡写真。左の写真に見られる伸張した細胞形状は基材表面に接着している特徴を示し、右の写真で見られる丸みのある細胞形状は溶液中の遊離した細胞の特徴を示しています。
培養した細胞は、培養皿一面に増殖した状態(コンフルエント状態)に達したのちに、細胞培養温度を37℃から20℃に下げるだけで、生体組織に似た細胞の単層すなわち「細胞シート」の形でPNIPAM修飾表面から剥離・回収することができます。この細胞操作技術によって、生分解性ポリマーの足場を使用せずに細胞シートをホスト組織に移植できるため、従来の組織工学の大きな制約が克服されます。本稿では、水溶液中のPNIPAMの性質について簡単に説明した後、このプロセスの基礎をなす化学的性質、特に多機能細胞シートを得るために使用する改質表面の設計と作製を中心に解説します。
ポリ(N-イソプロピルアクリルアミド):ユビキタススマートポリマー
PNIPAMは、クロロホルム、アセトン、メタノールをはじめとする各種アルコールなどの有機溶媒に溶解します。また、溶液が適度な低温に保たれる限り、水にも溶解します。PNIPAM水溶液を32℃(曇点(CP:Cloud Point)または下限臨界溶液温度(LCST:Lower Critical Solution Temperature))以上に加熱すると、透明な溶液が瞬時に乳白色の懸濁液に変わります。この現象は可逆的で、32℃未満に冷却すると直ちに透明な溶液に戻ります3。1960年代後半に、HeskinsとGuilletによって水/PNIPAM系の相図が初めて発表されましたが、これは、PNIPAM濃度の関数としての相転移温度を測定することで作成されたものです4。これとほぼ同時期に、架橋した網目構造PNIPAM(ゲル)も水中で特異な性質を示すことが明らかになっています。すなわち、このゲルは冷水中で大きく膨潤しますが、32℃を超えて加熱すると直ちに収縮します。PNIPAM溶液の場合と同様にゲルの挙動は可逆的で、32℃未満に冷却すると直ちに元の体積まで膨潤します。数百回の膨潤/収縮サイクルを繰り返しても、ゲルに材料疲労の兆候は現れません。Allan S. Hoffmannはこの特異な現象に注目しました。彼は、色素や薬物の放出をはじめとする生物医学的応用に関連した現象を制御するために、温度によって引き起こされるPNIPAM誘導体の相転移を利用した、最初の研究者の1人です5。この先駆的な研究によって応答システム分野の基礎が築かれ、現在も引き続き研究が盛んに行われています6。PNIPAM水溶液が示す熱誘起相転移はそれ固有の性質ではなく、その他の多くの水溶性ポリマーが曇点を持ちます。しかし、PNIPAMは、転移の鋭敏さ、体温に近い転移温度、ポリマー自体の強固さ、およびポリマーとその相転移に関する情報が容易に入手可能であるために、今なお、生物医学分野で最もよく研究され続けている物質です。
分子レベルにおいて、巨視的な相転移は、PNIPAM鎖の脱水和とそれに続く水分子の解離した疎水性鎖の小型球状物質(より大きなメソ球状物質に凝集します)への変化に対応します(図2)7,8。ただし、この相転移は、温度変化による分子の再配列のみに起因しているわけではありません。その他のいくつかの要因がPNIPAMのCPに影響を与える可能性がありますが、その効果は必ずしも予測可能なものではありません。
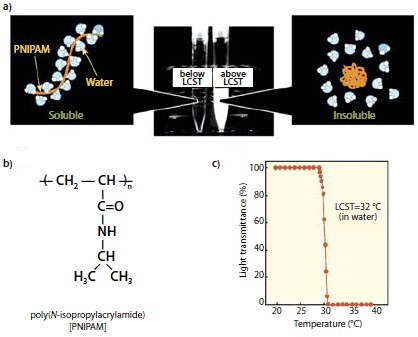
図2ポリ(N-イソプロピルアクリルアミド)(PNIPAM)水溶液の温度応答性。(a)LCST以上に加熱すると、水和して伸張していたPNIPAM鎖は結合している水分子を放出しながら疎水性のグロビュール状態へと変化します。(b)PNIPAMの化学構造。(c)温度の関数としてプロットしたPNIPAM水溶液の溶液透過率。LCSTは転移曲線の中点に対応します。
分子量
曇点に対するポリマー分子量の影響について議論されています。水中のPNIPAMの曇点が分子量と直接関係していることを示す報告がある一方で、CPが逆の分子量依存性を示すという報告や、PNIPAM水溶液のCPは分子量に依存しないという報告もあります。これらの違いは、高分子鎖末端の化学的性質がCP値に大きな影響を与える比較的短いポリマー鎖(Mw<20,000 g/L)で得られた結果と比較すると、特に際立っています9。親水性末端基を持つポリマーは、低濃度の溶液で比較的高い曇点を示す傾向があるのに対し、疎水性末端基を持つポリマーのCPの場合、同じ条件下であればこれより通常低くなります10。n-オクタデシル鎖などの疎水性の強い末端基を持つPNIPAM溶液ではこの傾向は見られなくなり、水中で自己組織化してフラワーミセルや星形ミセルを形成します11,12。
溶媒系
多溶媒系の存在もPNIPAMのCPに影響を与える可能性があります。たとえば室温において、広い組成範囲にわたる水/メタノール混合溶液にPNIPAMは溶解せず、共貧溶媒性(cononsolvency)と呼ばれる現象を示します13。
塩の存在
塩の存在もPNIPAM水溶液のCPに影響を与える可能性があり、ある塩はCPを上昇させますが、別の塩を添加した場合にはCPが低下します。これらの観察結果に対して、いくつかの説明がなされています14。PNIPAMの相転移に影響を与える要因が完全に理解されれば、それらを利用して、PNIPAMを調製、最適化し、更なる応用に用いることができるようになります。しかしながらその一方で、すでにいくつかの非常に興味深い用途において、この優れたポリマー材料の利用が進んでいます。
細胞シート工学用の温度応答性細胞培養皿
PNIPAMをコーティングした細胞培養皿は、NIPAMの2-プロパノール溶液を市販の組織培養用ポリスチレン(TCPS)製細胞培養皿に塗布した後、NIPAMモノマーへ電子線照射(150 kV、0.3 MGy)することによって調製します(図3)。この処理によって、NIPAMの重合とTCPS表面上における成長ポリマー鎖の共有結合グラフト化が同時に生じます。この方法はクリーンな上、スケールアップとパターニングが容易であり、ポリマー層の厚さの微調整が可能です。ほとんどの細胞培養用途では、グラフトしたPNIPAMの膜厚は15~20 nmの範囲が必要であり、これは1.4~2.0 μg/cm2のグラフト密度に相当します15。

図3ポリ(N-イソプロピルアクリルアミド)でグラフトした細胞培養皿の作製手順を示した概略図
通常のTCPS培養皿と同様の条件下で、さまざまなタイプの細胞が温度応答性PNIPAM培養表面上で接着して増殖します。37℃で細胞がコンフルエントな状態に達した後、培養皿を32℃未満(通常は20℃)に冷却します。ポリマー鎖は再び水和して細胞は接着しなくなるため、細胞は連続した単一の層からなる細胞シートの形で培養表面から剥離します。従来の細胞ベースの組織工学では、細胞接着分子と細胞外マトリックス(ECM:extracellular matrix)たんぱく質を分解することで細胞を剥離回収しているために、たんぱく質分解酵素(たとえば、トリプシンやディスパーゼ)を培地に加えます。この処理は、さまざまな種類の細胞に関する特徴的な機能に不可欠な細胞膜たんぱく質に影響を与える可能性もあります。一方、温度応答性表面上で培養した細胞を回収するための酵素処理は必要ありません。したがって、回収した細胞シートは、その基底に存在するECMたんぱく質を保持したまま、新しい培養皿、他の細胞シート、または生体組織に移すことができます。現在、いくつかの細胞シート組織工学の臨床試験が進められており、角膜や歯根膜などの単一細胞シートの移植が行われています。継続中の研究には、同種および異種の細胞シートを複数用いて積層化させた3次元の組織様構造(たとえば、心臓や肝臓の組織)の作製などがあります16。
異種細胞の共培養に用いられるパターニングされた温度応答性表面
特定の組織機能を模倣するには、異種細胞間で相互作用を持ち、空間的に整列した組織構造を再構築する必要があります。一般に、細胞種が異なると接着特性と増殖特性も異なるため、複数の細胞種を1つの3次元組織構造の中に統合することは容易ではありません。多くの場合、異なる細胞種の共培養は微細パターニングされた表面上で行われます。温度応答性を持つ微細パターニング表面は、PNIPAMのLCSTがコモノマーによっても調節できるため、容易に作製可能です。LCSTは、親水性コモノマーとのNIPAM共重合体では32℃より高く、n-メタクリル酸ブチル(BMA)などの疎水性モノマーとのNIPAM共重合体では32℃未満です。微細パターニング表面を調製するには、BMAの2-プロパノール溶液をPNIPAMグラフトTCPS培養皿の上に塗布します。その後、BMAを塗布した表面に、ステンレススチール製の微細パターンマスクを通して電子線を照射します17。照射した領域のあらかじめ作製しておいたPNIPAM層にBMAモノマーがグラフトされる一方、マスク領域では元のPNIPAMがそのままの状態に保たれます。照射領域の転移温度は32℃未満です。実際のLCST値は、BMAの組み込み量を制御して調節します。このパターニング方法を、肝細胞(HC:hepatocyte)と内皮細胞(EC:endothelial cell)の共培養に応用した例を図4に示します。
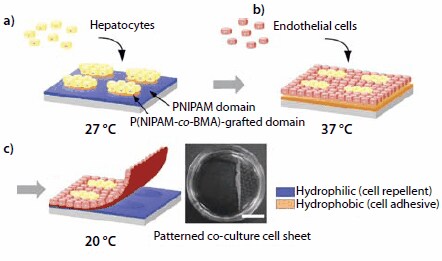
図4パターニングされた温度応答性表面を用いた共培養細胞シートのパターン状の細胞共培養と回収を示す概略図。(a)肝細胞(HC)を27℃で播種および培養すると、疎水性を示すP(NIPAM-co-BMA)グラフト領域にHCが局在化します。(b)次に、内皮細胞(EC)を37℃で播種および培養すると、パターニングされた共培養が生じます。(c)温度を20℃に下げると、共培養された細胞シートが剥離します。右の写真は、回収したパターニング共培養細胞シートです(Scale bar:1 cm)。
まず、27℃に保った微細パターニング上にHCを播種します。この温度で脱水和した疎水性のP(NIPAM-co-BMA)領域にしかHCは接着しません。PNIPAM領域は27℃で水和し、親水性を示すために細胞は接着しません(図4a)。次に、HCが接着した後に培養皿を37℃に加温します。するとPNIPAM領域が疎水性となり、ECが接着します。ECはPNIPAM領域に接着して増殖します(図4bおよび4c)。培養温度を20℃に下げると、表面全体の水和が進み、共培養した細胞単層は自発的に剥離し、異種細胞間で相互作用のある連続した細胞シートが得られます。回収した共培養細胞シートを操作して他の細胞シートの間に挟むと、生体組織を模倣した多層構造物を作製することができます。
温度応答性培養皿の機能化
化学的に活性な(機能性)コモノマーをグラフト化PNIPAM層に組み込むと、生理活性分子を導入する部位として活用することができます(図5を参照)15。

図5インテグリン受容体とRGDS(Arg-Gly-Asp-Ser)ペプチドの間の温度応答性アフィニティー制御を示す概略図。RGDS配位子は、カップリング試薬としてのN-(3-dimethylaminopropyl)-N'-ethylcarbodiimidehydrochloride(水溶性カルボジイミド(WSC))とのアミド結合によって、P(NIPAM-co-CIPAAm)と結合します。温度応答性ポリマーは37℃で収縮し、細胞膜インテグリン受容体(黄色)からRGDS配位子(赤色の点)が露出します。このようにして、RGDS固定化温度応答性培養皿の上で、細胞を無血清条件で培養することが可能です。培養温度を20℃に下げると、細胞は非侵襲的に回収されます。RGDS配位子は、温度応答性ポリマー表面に付着した状態で残ります。
最初に、NIPAM/2-carboxyisopropylacrylamide(CIPAAm)の混合物(CIPAAm含有率:1~5 mol%)の電子線重合により、TCPS培養皿をNIPAMとCIPAAmの共重合体でグラフト化します。その後、合成細胞の接着したテトラペプチドArg-Gly-Asp-Ser(RGDS)を標準的なアミド結合形成反応によってP(NIPAM-co-CIPAAm)グラフトTCPS培養皿に共有結合させます18。表面上のRGDSに存在することで、組み換え成長因子を添加した無血清条件下で37℃における細胞の接着と増殖が促進されます。コンフルエントな状態に達した後、PNIPAMグラフト培養皿の場合と同様に温度を20℃に下げるだけで、細胞を完全な状態の細胞シートとして回収できます。PNIPAM表面鎖の再水和によって、表面固定化RGDSペプチドと細胞膜インテグリン受容体の間の相互作用は不可逆的に解消されます。この方法によって培養期間が大幅に短縮され、従来使用されてきたウシ胎児血清を用いずに細胞の培養が可能になります。このことは、ヒトの細胞療法の臨床応用に使用される組織を製造する上で必要なほ乳類由来のサプリメントに起因する潜在的なリスクを回避する観点からも重要な成果です。
結論
今後、温度応答性細胞シート作製技術が進展するには、さまざまな組織の細胞シートを精密に作製するための高精度で最適化されたPNIPAMグラフト表面の構築が必要不可欠です。期待されている表面作製法の一つに、原子移動ラジカル重合(ATRP:atom transfer radical polymerization)や可逆的付加-開裂連鎖移動型ラジカル(RAFT:reversible addition-fragmentation chain transfer)重合などの精密ラジカル重合法があり、高分子鎖の厚さとグラフト密度が制御されたPNIPAMブラシを利用することができます19-21。これらの新規なスマート表面の開発と研究、および医学用途での使用によって、生物学と医学の分野において新たな領域が切り開かれるでしょう。
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?