おすすめの製品
グレード
Proteomics Grade
品質水準
フォーム
lyophilized powder
比活性
50-150 units/mg protein
分子量
29.5 kDa
組成
Protein, ~40% biuret
溶解性
H2O: soluble 0.9-1.1 mg/mL, clear, colorless
その他の活性
endopeptidase, essentially free
保管温度
−20°C
詳細
亜鉛を含有する酵素です。
特異性
N末端アミノ酸、特にロイシンの選択的な遊離を触媒しますが、グルタミン酸やアスパラギン酸には作用しません。
アプリケーション
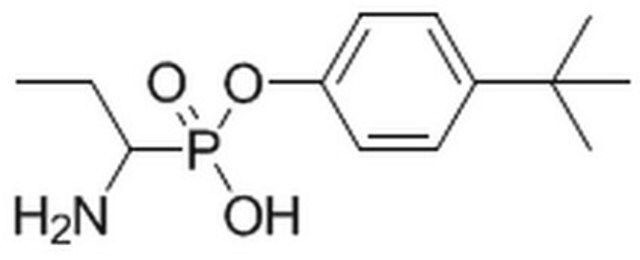
アミノペプチダーゼは広く分布しているプロテアーゼファミリーで、タンパク質の成熟、ホルモン産生およびペプチド消化など、多くの重要な生物学的過程の研究に使用できる可能性があります。この酵素は、一般的プロテアーゼ阻害剤であるベスタチンのアミノペプチダーゼへの結合動態における反応速度定数の測定に使用されています。
生物化学的/生理学的作用
エロモナス・プロテオリチカ由来のアミノペプチダーゼは、単一ポリペプチド内にZn2+原子が2つある分子量約29.5 kDa(沈降法で測定)の金属酵素です。この酵素は高度に安定しており、温度70℃でさえ数時間安定しています。8 M尿素中では部分的に不活化されます。最大の安定性および活性はpH 8.0~8.5で示されます。エロモナス・プロテオリチカ由来のアミノペプチダーゼはエステラーゼとしても機能できます。
エロモナス・プロテオリチカ由来のアミノペプチダーゼはタンパク質の成熟、ホルモン産生およびペプチド消化に関係しています。
単位の定義
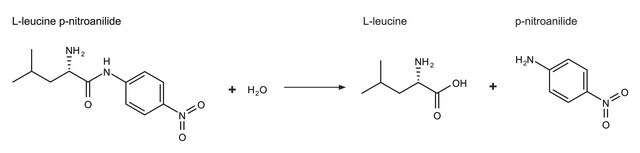
1ユニットは、pH 8.0、25°C、1分間で、1.0 μmolのL-ロイシンp-ニトロアニリドを加水分解してL-ロイシンとp-ニトロアニリンにする酵素量です。
物理的形状
凍結乾燥品(pH 8.0のトリシンバッファ-, 塩化亜鉛, 安定化剤を含有)。
調製ノート
0.9~1.1 mg/mL濃度で水に溶解すると、無色透明な溶液になります。
シグナルワード
Danger
危険有害性情報
危険有害性の分類
Eye Irrit. 2 - Resp. Sens. 1 - Skin Irrit. 2 - STOT SE 3
ターゲットの組織
Respiratory system
保管分類コード
11 - Combustible Solids
WGK
WGK 1
引火点(°F)
Not applicable
引火点(℃)
Not applicable
個人用保護具 (PPE)
Eyeshields, Gloves, type N95 (US)
適用法令
試験研究用途を考慮した関連法令を主に挙げております。化学物質以外については、一部の情報のみ提供しています。 製品を安全かつ合法的に使用することは、使用者の義務です。最新情報により修正される場合があります。WEBの反映には時間を要することがあるため、適宜SDSをご参照ください。
Jan Code
A8200-BULK:
A8200-100UN:
A8200-250UN:
A8200-VAR:
A8200-250UN-PW:
A8200-100UN-PW:
この製品を見ている人はこちらもチェック
James Kahn et al.
Biochemistry and molecular biology education : a bimonthly publication of the International Union of Biochemistry and Molecular Biology, 38(4), 238-241 (2011-05-14)
We have recently designed a biochemistry laboratory experiment for the purpose of providing students an advanced experience with enzyme kinetics and the kinetics of binding. Bestatin, a well-known and commercially available general protease inhibitor, is a slow-binding inhibitor of aminopeptidase
S Nirasawa et al.
The Biochemical journal, 341 ( Pt 1), 25-31 (1999-06-23)
An aminopeptidase from Aeromonas caviae T-64 was translated as a preproprotein consisting of three domains; a signal peptide (19 amino acid residues), an N-terminal propeptide (101 residues) and a mature region (273 residues). We demonstrated that a proteinase, which was
Krzysztof P Bzymek et al.
The Journal of biological chemistry, 279(30), 31018-31025 (2004-05-13)
Glutamate 151 has been proposed to act as the general acid/base during the peptide hydrolysis reaction catalyzed by the co-catalytic metallohydrolase from Aeromonas proteolytica (AAP). However, to date, no direct evidence has been reported for the role of Glu-151 during
Kiet T Nguyen et al.
Methods in molecular medicine, 142, 117-130 (2008-04-26)
The emergence of bacterial pathogens resistant to current antibiotics has caused an urgent demand for new treatments. Peptide deformylase (PDF) has become an exciting target for designing novel antibiotics. To facilitate the screening of PDF inhibitors, three robust, coupled assays
K M Huntington et al.
Biochemistry, 38(47), 15587-15596 (1999-11-26)
Peptide-derived thiols of the general structure N-mercaptoacyl-leucyl-p-nitroanilide (1a-c) were synthesized and found to be potent, slow-binding inhibitors of the aminopeptidase from Aeromonas proteolytica (AAP). The overall potencies (K(I)) of these inhibitors against AAP range from 2.5 to 57 nM exceeding
ライフサイエンス、有機合成、材料科学、クロマトグラフィー、分析など、あらゆる分野の研究に経験のあるメンバーがおります。.
製品に関するお問い合わせはこちら(テクニカルサービス)