前臨床

前臨床試験によって、標的化合物がヒトを対象とした試験に進むために必要な安全性と有効性を有しているか確認します。この段階は、in vitroおよびin vivo試験に数年を要し、それらに成功した場合は、新薬治験開始申請書を作成して提出します。
バイオテックリソース
- FDA Investigational New Drug (IND) Application
バイオテクノロジースタートアップ企業の薬剤開発にきわめて重要なステップであるIND申請に関するFDAのガイダンスを確認します。 Navigate regulatory intricacies efficiently.
- Emerging BioTalk Blog
Your gateway to the latest news in biotech. Dive into discussions on market trends, bioprocessing, and technologies for novel modalities.早速ディスカッションにご参加ください。
- カタログ:統合的なバイオプロセスソリューション
Navigate the path to commercialization with our comprehensive guide for Biopharmaceutical Startups.弊社の広範なツールとサービスで歩みを促進します。
- バイオ医薬品アプリケーションガイド
MAb、ADCおよびmRNAのプロセスに関するリソースやソリューションを提示する弊社のアプリケーションガイドでバイオ医薬品の状況のかじ取りをします。
毒性試験サービス は極めて重要です。広範なin vitroおよびin vivoの毒性試験が要求され、国際的なガイドラインに従って設計し、医薬品の安全性に関する非臨床試験の実施基準(GLP)を完全に遵守して実施する必要があります。
プロセス開発の検討事項
- 細胞株の開発
- クローンの選定
- 培地およびフィードのスクリーニング
- アップストリームのプロセス開発
- マスターセルバンクの構築
- ダウンストリームのプロセス開発
- 製剤処方設計
- 分析法の開発と最適化
- 分析法プロセスの開発サポート
- バイオシミラーの同等性分析プログラム
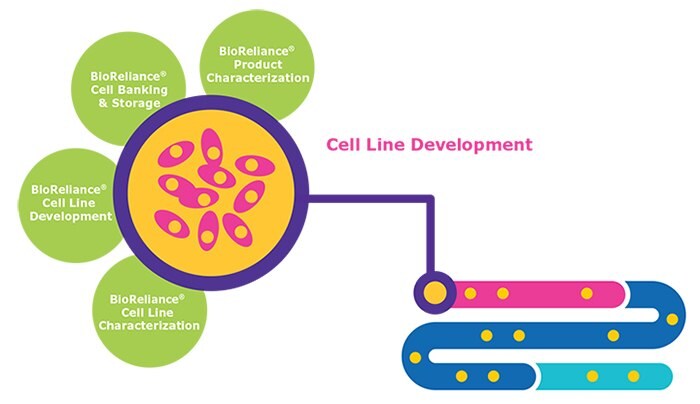
細胞株の開発における検討事項
- クローンの選定 – 十分に高い力価と品質で生物製剤を産生できる細胞株
- 頑健性試験 – スケールアップ条件を再現する試験
- 遺伝子的安定性 – 60回以上細胞を継代してもタンパク質の産生および品質が持続的に安定
プロセス開発の検討事項
- プロセス効率 – 無駄なステップを排除して製造キャパシティーを活用
- プロセスの実行可能性 – スケールアップおよび技術移転による再現性
- 経済的な実行可能性 – バランスの良い生産性とコスト

技術的検討事項
- フレキシビリティ – シングルユース機器によって、フレキシビリティ、テンプレート活用、および迅速な製造ラインの導入が促進され、洗浄コストが削減されます。
- スケーラビリティ – 最も初期の技術選択時に、哺乳類細胞培養の3 Lから200 L、さらに2,000 Lへのバイオリアクターのスケールアップなどを検討することが重要です。
- 使い勝手の良さ – ソリューションには事前組立て済みの無菌プロセス用フローパスが含まれます。コネクターは無菌での取り付け、取り外し、再取り付けが可能です。
規制上の検討事項
- 患者さんの安全性 – 臨床開発のマイルストーンでは安全性および製品の有効性を評価しなければなりません。
- 製品の品質およびプロセスの堅牢性 – データの収集および分析で確認する必要があります。
- 申請の戦略 – 申請予定の国々についてよく知ってから、製造施設の査察担当者を案内すべきです。
ビジネスにおける検討事項
- 臨床までのスピード – 研究開発には見返りのない多大な投資がなされています。
- プロセスの効率性 – 初期段階のスピードだけでなく、その後のスケールアップを積極的に検討
- 申請の戦略 – 最初に申請する国を特定し、市場へのアクセスを迅速に獲得します。
適切なリソースを利用すれば、必要とする患者さんに有用である可能性が最も高い候補の発見に集中することができます。開発プロセスの段階を選択して詳細を学ぶ、または製品およびサービスの各リンクからリソースについて参照してください。
バイオテクノロジーハブリソースのワークフロー


創薬
新たな医薬品の開発に必要な検討事項、リソース、およびサポートの特定

第I相~第II相
工程開発を促進させるヒント、テンプレートおよび申請ガイド

第III相・製造
治験および商品化に向けたスケールアップおよび技術移転から高品質生産までの発展

スタートアッププログラム
お客様の医薬品の可能性を広げるリソースと認可プログラムの連結

規制
世界で最も厳格な規制を有する産業への挑戦は信頼されているガイドとともにはじまります。
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?



