T7309
Tripsina
≥2,500 USP units/mg solid, meets USP testing specifications
Sinonimo/i:
Serine Protease 1
Autenticatiper visualizzare i prezzi riservati alla tua organizzazione & contrattuali
About This Item
Prodotti consigliati
agenzia
USP/NF
meets USP testing specifications
Livello qualitativo
Stato
solid
Attività specifica
≥2,500 USP units/mg solid
PM
23.8 kDa
Purificato mediante
crystallization
Solubilità
H2O: soluble
saline: soluble
applicazioni
diagnostic assay manufacturing
Temperatura di conservazione
−20°C
Cerchi prodotti simili? Visita Guida al confronto tra prodotti
Categorie correlate
Applicazioni
Per la digestione di peptidi con la tripsina, utilizzare un rapporto compreso all′incirca tra 1:100 e 1:20 per tripsina:peptide. L′impiego tipico di questo prodotto consiste nella rimozione delle cellule aderenti da una superficie di coltura. La concentrazione di tripsina necessaria per staccare le cellule dal relativo substrato dipende principalmente dal tipo di cellule e dall′età della coltura. Le tripsine sono state adoperate anche per la ri-sospensione delle cellule durante la coltura cellulare, nella ricerca proteomica per la digestione delle proteine e in varie digestioni in gel. Ulteriori applicazioni comprendono la valutazione della cristallizzazione con tecniche basate su membrana e l′impiego in uno studio per stabilire se i tassi e la resa del folding proteico possono essere limitati dalla presenza di trappole cinetiche.
Azioni biochim/fisiol
La tripsina scinde i peptidi sul lato C-terminale dei residui di lisina e arginina. La velocità di idrolisi di questa reazione viene rallentata se su uno dei lati del sito di scissione è presente un residuo acido. L′idrolisi si arresta se sul lato carbossile del sito di scissione è presente un residuo di prolina. Il pH ottimale per l′attività della tripsina è 7-9. La tripsina può anche scindere i legami esterei e ammidici dei derivati sintetici degli amminoacidi. L′EDTA viene aggiunto alle soluzioni di tripsina come agente chelante che neutralizza gli ioni di calcio e magnesio che oscurano i legami peptidici su cui agisce la tripsina. La rimozione di questi ioni aumenta l′attività enzimatica.
Gli inibitori delle serin proteasi, tra cui ad esempio DFP, TLCK, APMSF, AEBSEF e aprotinina, inibiscono la tripsina.
Gli inibitori delle serin proteasi, tra cui ad esempio DFP, TLCK, APMSF, AEBSEF e aprotinina, inibiscono la tripsina.
Componenti
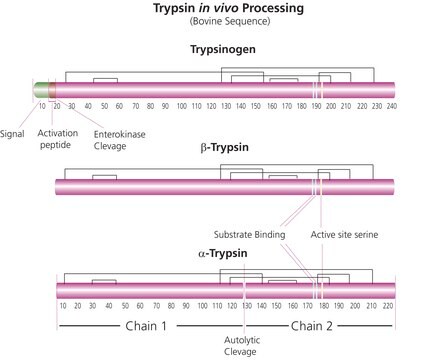
Trypsin consists of a single chain polypeptide of 223 amino acid residues, produced by the removal of the N-terminal hexapeptide from trypsinogen which is cleaved at the Lys - lle peptide bond. The sequence of amino acids is cross-linked by 6 disulfide bridges. This is the native form of trypsin, beta-trypsin. BETA-trypsin can be autolyzed, cleaving at the Lys - Ser residue, to produce alpha-trypsin. Trypsin is a member of the serine protease family.
Avvertenza
Solutions in 1 mM HCl are stable for 1 year in aliquots and stored at -20°C. The presence of Ca2+ will also diminish the self-autolysis of trypsin and maintain its stability in solution. Trypsin will also retain most of its activity in 2.0 M urea, 2.0 M guanidine HCl, or 0.1% (w/v) SDS.
Definizione di unità
Un′unità BAEE produce una A253 di 0,001 al minuto a pH 7,6 a 25°C usando il BAEE come substrato.
Nota sulla preparazione
Soluble in 1 mM HCl at 1 mg/mL.
Prodotti correlati
N° Catalogo
Descrizione
Determinazione del prezzo
Avvertenze
Danger
Indicazioni di pericolo
Consigli di prudenza
Classi di pericolo
Eye Irrit. 2 - Resp. Sens. 1 - Skin Irrit. 2 - STOT SE 3
Organi bersaglio
Respiratory system
Codice della classe di stoccaggio
11 - Combustible Solids
Classe di pericolosità dell'acqua (WGK)
WGK 1
Dispositivi di protezione individuale
dust mask type N95 (US), Eyeshields, Faceshields, Gloves
Scegli una delle versioni più recenti:
Possiedi già questo prodotto?
I documenti relativi ai prodotti acquistati recentemente sono disponibili nell’Archivio dei documenti.
I clienti hanno visto anche
Shuo Sui et al.
Journal of applied crystallography, 54(Pt 4), 1034-1046 (2021-08-26)
A novel capillary-based microfluidic strategy to accelerate the process of small-molecule-compound screening by room-temperature X-ray crystallography using protein crystals is reported. The ultra-thin microfluidic devices are composed of a UV-curable polymer, patterned by cleanroom photolithography, and have nine capillary channels
Monika Gulia-Nuss et al.
PloS one, 6(5), e20401-e20401 (2011-06-08)
Mosquitoes are insects that vector many serious pathogens to humans and other vertebrates. Most mosquitoes must feed on the blood of a vertebrate host to produce eggs. In turn, multiple cycles of blood feeding promote frequent contacts with hosts and
Olivier Rivoire
Physical review letters, 110(17), 178102-178102 (2013-05-18)
Studies of coevolution of amino acids within and between proteins have revealed two types of coevolving units: coevolving contacts, which are pairs of amino acids distant along the sequence but in contact in the three-dimensional structure, and sectors, which are
Mian Zhou et al.
Nature, 495(7439), 111-115 (2013-02-19)
Codon-usage bias has been observed in almost all genomes and is thought to result from selection for efficient and accurate translation of highly expressed genes. Codon usage is also implicated in the control of transcription, splicing and RNA structure. Many
Janina Boyken et al.
Neuron, 78(2), 285-297 (2013-04-30)
Neurotransmission involves calcium-triggered fusion of docked synaptic vesicles at specialized presynaptic release sites. While many of the participating proteins have been identified, the molecular composition of these sites has not been characterized comprehensively. Here, we report a procedure to biochemically
Il team dei nostri ricercatori vanta grande esperienza in tutte le aree della ricerca quali Life Science, scienza dei materiali, sintesi chimica, cromatografia, discipline analitiche, ecc..
Contatta l'Assistenza Tecnica.