Lipopolisacharydy w badaniach naukowych - struktura, funkcja i zastosowania
Dr. Sai Sandeep Mannimala, Global Product Manager
Merck
Niniejszy artykuł ma na celu zbadanie struktury, funkcji i zastosowań badawczych lipopolisacharydów, kluczowego składnika bakterii Gram-ujemnych. Odkryj rolę LPS w obronie bakteryjnej, specyficzność serologiczną oraz jego potencjał w opracowywaniu szczepionek i badaniach nad lekami.Aby uzyskać więcej informacji na temat naszej oferty produktów, zapraszamy do wypełnienia poniższego formularza internetowego.
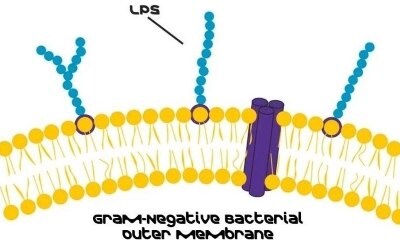
Wprowadzenie do lipopolisacharydów
Lipopolisacharydy (LPS) są glikolipidami i głównym składnikiem zewnętrznej błony bakterii Gram-ujemnych. LPS jest zlokalizowany w zewnętrznej warstwie błony i jest, w szczepach niekapsułkowanych, eksponowany na powierzchni komórki. Przede wszystkim przyczyniają się do integralności błony zewnętrznej i chronią komórkę przed działaniem soli żółciowych i lipofilowych antybiotyków.1
Poza funkcjami strukturalnymi, LPS przyjmuje silną rolę jako endotoksyna bakteryjna. Nawet w niewielkich ilościach LPS może okazać się śmiertelny po wejściu do krwioobiegu.2 Przedział organizmu zazwyczaj zapobiega ich wejściu, ale czynniki takie jak zmiany jelitowe lub dieta bogata w lipidy mogą ułatwić transport.3 LPS wywołuje silną pirogenną odpowiedź immunologiczną i stanowi zagrożenie dla zdrowia w różnych produktach, szczególnie dla osób z chorobami przewodu pokarmowego.4
Dodatkowo LPS reprezentuje jedną z zachowanych struktur drobnoustrojów odpowiedzialnych za aktywację wrodzonego układu odpornościowego. Upośledzony układ odpornościowy nasila endotoksyczne działanie LPS podczas infekcji, potencjalnie prowadząc do ciężkich stanów, takich jak wstrząs septyczny.5 Bakterie Gram-ujemne dostosowują się poprzez modyfikację struktury LPS, łącząc LPS z chorobami autoimmunologicznymi i alergiami. W krwiobiegu białka wiążące lipopolisacharydy działają jako nośniki, przenosząc LPS do makrofagów lub lipoprotein surowicy. LPS związany z makrofagami indukuje reakcje prozapalne, podczas gdy dostarczanie lipoprotein osłabia reakcję immunologiczną i może prowadzić do dyslipidemii.6
Struktura i skład lipopolisacharydu
Lipopolisacharydy (LPS) mają złożoną strukturę molekularną, która jest trudna do określenia ilościowego pod względem masy cząsteczkowej ze względu na ich niejednorodność i tendencję do tworzenia agregatów o różnych rozmiarach. W najczystszym stanie LPS składają się z makrocząsteczek o masie cząsteczkowej 10-20 kDa. Jednak po poddaniu działaniu SDS i ciepła masa cząsteczkowa LPS zazwyczaj mieści się w zakresie od 50 do 100 kDa. W określonych warunkach LPS może łączyć się w micele o masie około 1000 kDa bez potrzeby stosowania środków powierzchniowo czynnych, polegając zamiast tego na środkach sekwestrujących kationy dwuwartościowe, takich jak EDTA. Gdy obecne są kationy dwuwartościowe, takie jak Ca2+ i Mg2+, LPS może przyjąć strukturę dwuwarstwową, która może przejść przez błonę 0,2 μm, ale nie przez błonę 0,025 μm. W środowiskach bogatych w kationy dwuwartościowe, LPS może nawet tworzyć pęcherzyki o średnicy do 0,1 μm. Samoagregacja LPS zależy głównie od składnika lipidowego A, który umożliwia również przyleganie do powierzchni hydrofobowych. Składają się one z trzech głównych składników:
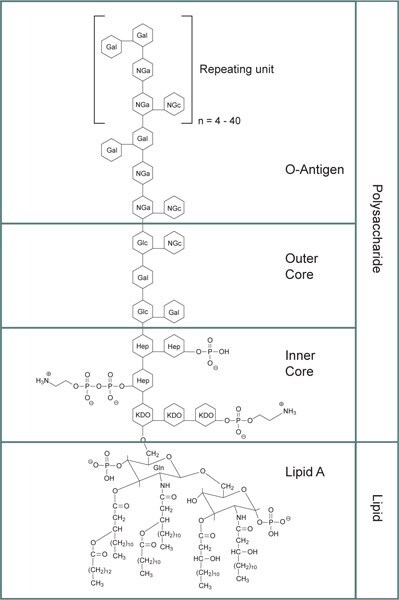
Rysunek 1.Ogólna struktura lipopolisacharydów bakteryjnych. Skróty: KDO: Kwas 3-deoksy-α-D-mannooktulozonowy; Hep: Heptuloza (ketoheptoza); NGa: Galaktozamina; NGc: Glukozamina.
- O-antygen: Najbardziej zewnętrzna część LPS, O-antygen, jest powtarzającym się oligosacharyd jednostka, która różni się w zależności od serotypu bakterii. Jest to podstawowa cecha, która odróżnia różne szczepy bakterii, pomagając w ich identyfikacji.7
- Rdzeniowy łańcuch polisacharydowy: hydrofilowy rdzeń polisacharyd łańcuch, który zawiera składniki takie jak kwas 3-deoksy-α-D-manno-oktulozowy (KDO) i heptuloza (ketoheptoza). Części te są często fosforylowane lub modyfikowane grupami zawierającymi fosforany, przyczyniając się do ogólnego ładunku ujemnego i stabilności strukturalnej.
- Lipid A: Jest to hydrofobowa część odpowiedzialna za toksyczne właściwości LPS, która składa się z jednostek opartych na glukozaminie z przyłączonymi estrami kwasów tłuszczowych.
Należy zauważyć, że LPS może wykazywać zmienność strukturalną, szczególnie w części rdzeniowej i lipidowej A, co prowadzi do niejednorodności preparatów LPS.
Ekstrakcja i oczyszczanie
Przygotowanie LPS można osiągnąć przy użyciu różnych metod, takich jak kwas trójchlorooctowy (TCA),8 fenol,9 lub ekstrakcja fenol-chloroform-eter naftowy (PCP),10 z niewielkimi różnicami strukturalnymi między nimi. LPS ekstrahowany TCA i LPS ekstrahowany fenolem wykazują podobne wzory elektroforetyczne i endotoksyczność. Kluczowe różnice polegają jednak na ilości zanieczyszczeń kwasami nukleinowymi i białkami. Ekstrakty TCA zawierają około 2% RNA i około 10% zdenaturowanych białek, podczas gdy ekstrakty fenolowe zawierają do 60% RNA i mniej niż 1% białka. Procesy oczyszczania, w tym chromatografia filtracji żelowej i chromatografia jonowymienna, pomagają zmniejszyć te zanieczyszczenia, ostatecznie dając produkty LPS o minimalnej zawartości białka i RNA.
Koniugaty FITC (izotiocyjanian fluoresceiny), TRITC (izotiocyjanian tetrametylorodaminy) i TNP (trinitrofenyl) zostały przygotowane przez reakcję LPS odpowiednio z FITC, TRITC lub kwasem 2,4,6-trinitrobenzenosulfonowym.11 Są one wykorzystywane w badaniach nad niezależną od limfocytów T odpowiedzią immunologiczną komórek B na bakteryjny LPS.11
Oferujemy Lipopolisacharydy o różnym poziomie białka i RNA, ekstrahowane przy użyciu TCA, fenolu i tCA.Phenol i PCP metodami, w tym oczyszczone przy użyciu wymiany jonowej i chromatografii filtracji żelowej. Dodatkowo, oferujemy również napromieniowane promieniami gamma, detoksykowane, koniugat FITC i gotowe rozwiązanie, aby wspierać różnorodne zastosowania badawcze.
Nasze preparaty lipopolisacharydowe mają poziom endotoksyny nie mniejszy niż 500 000 EU (jednostek endotoksyny) na miligram, chyba że zaznaczono inaczej. Aby spojrzeć na to z perspektywy, jeden nanogram endotoksyny odpowiada 0,5 EU w 1 ng materiału, biorąc pod uwagę poziom endotoksyny 500 000 EU/mg (test lizatu Limulus) i 10 EU (test chromogenny).
Funkcje
W bakteriach Gram-ujemnych LPS odgrywają kluczową rolę w ochronie przed działaniem soli żółciowych i lipofilowych antybiotyków.1 Co więcej, LPS są stabilne wobec ciepła i związane z indukowaniem silnej odpowiedzi immunologicznej w normalnych komórkach ssaków, szczególnie w kontekście wstrząsu septycznego (posocznicy) u ludzi.12 Składnik lipidowy A w LPS odgrywa kluczową rolę w jego aktywności endotoksycznej. Badania wykazały, że syntetyczne i naturalne preparaty lipidu A Escherichia coli dają identyczne bioaktywne wyniki, podkreślając znaczenie lipidu A w LPS.13 Podstawowym receptorem odpowiedzialnym za rozpoznawanie LPS jest kompleks receptora CD14/TLR4/MD2, który wyzwala uwalnianie cytokin prozapalnych, takich jak czynnik martwicy nowotworów-α i interleukina-1.14 Podczas gdy lipid A głównie aktywuje odpowiedzi immunologiczne, składnik polisacharydowy LPS Salmonella enterica jest również kluczowy dla aktywacji NF-κB.15
Zastosowania badawcze
Preparaty lipopolisacharydów służą jako kluczowe narzędzia do badania zawiłości struktury LPS,16 metabolizmu,17 immunologii,18 biologii komórki,19 fizjologii,20 i toksyczności,21 rzucając światło na interakcję między bakteriami a układem odpornościowym gospodarza. Dodatkowo LPS stymuluje syntezę i wydzielanie kluczowych czynników wzrostu, takich jak interleukiny, odgrywając kluczową rolę w różnych procesach biologicznych.22, 23.
Marker diagnostyczny
Wczesne wykrywanie infekcji: LPS w krwiobiegu służy jako czuły marker infekcji bakteryjnych, umożliwiając wczesną diagnozę i interwencję, ostatecznie poprawiając wyniki pacjentów.
Badanie sepsy i wstrząsu: LPS, w szczególności jego składnik endotoksyny, wywołuje reakcje zapalne i ciężkie stany, takie jak posocznica i wstrząs, zapewniając cenny wgląd w rozwój strategii diagnozowania i leczenia.
Badania immunomodulacji
Zależna od T odpowiedź komórek B: Koniugaty LPS z cząsteczkami fluorescencyjnymi ułatwiają badanie odpowiedzi immunologicznej komórek B niezależnej od T na bakteryjny LPS, przyczyniając się do lepszego zrozumienia złożoności układu odpornościowego.
Mikrobiom jelitowy i odporność: LPS z różnych bakterii jelitowych wpływa na układ odpornościowy w różny sposób, na przykład promując zdrową odpowiedź immunologiczną lub będąc powiązanym z alergiami pokarmowymi i zaburzeniami autoimmunologicznymi, podkreślając znaczenie zrozumienia tych interakcji dla optymalnego zdrowia.
Vaccines and Drug Delivery Research
Adjuvants: Niskie dawki LPS aktywują receptory Toll-podobne (TLR) na komórkach odpornościowych, zwiększając skuteczność szczepionek i immunoterapii w celu uzyskania silniejszych odpowiedzi immunologicznych i potencjalnych ulepszeń terapeutycznych.
Drug Delivery: LPS przyczynia się do rozwoju ukierunkowanych systemów dostarczania leków, przyłączając środki terapeutyczne do cząsteczek LPS w celu bardziej skutecznego i specyficznego dostarczania, zmniejszając w ten sposób skutki uboczne.
Badania kliniczne
Rozwój terapii: LPS odgrywa istotną rolę w zrozumieniu i leczeniu różnych chorób, w tym sepsy, zaburzeń autoimmunologicznych i raka, w celu opracowania nowych terapii ukierunkowanych na określone szlaki w celu poprawy wyników leczenia pacjentów.
Zrozumienie układu odpornościowego: LPS służy jako cenne narzędzie do badania zawiłości układu odpornościowego, pomagając naukowcom w głębszym zrozumieniu, w jaki sposób organizm broni się przed patogenami i opracowywaniu strategii modulowania odpowiedzi immunologicznej w celach terapeutycznych.
Przechowywanie i stabilność
Roztwory lipopolisacharydów LPS w stężeniu 1 mg/ml w buforze lub pożywce hodowlanej zachowują stabilność przez około miesiąc, gdy są przechowywane w temperaturze 2-8 °C. Zamrożone podwielokrotności mogą być przechowywane przez okres do dwóch lat, ale najlepiej unikać powtarzających się cykli zamrażania/rozmrażania. Aby zachować integralność LPS, konieczne jest przechowywanie roztworów w silanizowanych pojemnikach, ponieważ LPS może przylegać do tworzyw sztucznych i niektórych rodzajów szkła, szczególnie gdy stężenie wynosi poniżej 0,1 mg / ml. Jeśli stężenie LPS przekracza 1 mg/ml, adsorpcja na ściankach fiolki jest minimalna. Jeśli używane są szklane pojemniki, należy zapewnić dokładne mieszanie przez co najmniej 30 minut w celu całkowitego ponownego rozpuszczenia zaadsorbowanego produktu.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?