Dysmutaza ponadtlenkowa
Dysmutaza ponadtlenkowa
Dysmutaza ponadtlenkowa (SOD) katalizuje redukcję anionów ponadtlenkowych do nadtlenku wodoru. Odgrywa kluczową rolę w obronie komórek przed toksycznym działaniem rodników tlenowych. SOD konkuruje z tlenkiem azotu (NO) o anion ponadtlenkowy, który inaktywuje NO, tworząc nadtlenoazotyn. Dlatego też, zmiatając aniony ponadtlenkowe, SOD promuje aktywność NO. SOD hamuje apoptozę w hodowanych szczurzych pęcherzykach jajnikowych, apoptozę neuronalną w neuronalnych liniach komórkowych i transgenicznych myszach poprzez zapobieganie konwersji NO do nadtlenoazotanu, induktora apoptozy.8,9,10 Stwierdzono, że kowalencyjne sprzężenie dysmutazy ponadtlenkowej z glikolem polietylenowym (PEG) zwiększa okres półtrwania w krążeniu i zapewnia przedłużoną ochronę przed częściowo zredukowanymi formami tlenu. 7

Rysunek 1.Struktura dysmutazy ponadtlenkowej
Numer Komisji Enzymatycznej (EC): 1.15.1.1 ( BRENDA | IUBMB )
Właściwości dysmutazy ponadtlenkowej
- Enzym bydlęcy występuje jako dimeryczne białko zawierające miedź i cynk o masie cząsteczkowej 2 X 16 300.3
- The E. coli enzym występuje jako dimeryczna glikoproteina zawierająca mangan lub żelazo o masie cząsteczkowej 2 x 22 000.4,5
- Człowieczy enzym występuje jako tetrameryczna glikoproteina zawierająca miedź, cynk lub mangan o masie cząsteczkowej 2 X 23-28 300.3,6
Reakcja dysmutazy ponadtlenkowej

Rysunek 2.Reakcja SOD
Km dla O2- dla bydlęcej SOD = 0.35 mM
Test enzymatyczny dysmutazy ponadtlenkowej
Aktywność dysmutazy ponadtlenkowej jest mierzona jako hamowanie szybkości redukcji cytochromu c przez rodnik ponadtlenkowy, obserwowane przy 550 nm:
Cytochrom c (utleniony) + O2-. → Cytochrom c (zredukowany) + O2
Rodnik ponadtlenkowy jest wytwarzany enzymatycznie w reakcji z oksydazą ksantynową:
Ksantyna + O2 + H2O  Kwas moczowy + O2-. + H+
Kwas moczowy + O2-. + H+
Uszkodzenia komórek
Uszkodzenia komórek są indukowane przez reaktywne formy tlenu (ROS). ROS to wolne rodniki, reaktywne aniony zawierające atomy tlenu lub cząsteczki zawierające atomy tlenu, które mogą wytwarzać wolne rodniki lub są przez nie aktywowane chemicznie. Przykładami są rodnik hydroksylowy, nadtlenek, nadtlenek wodoru i nadtlenoazotyn. Głównym źródłem ROS in vivo jest oddychanie tlenowe, chociaż ROS są również wytwarzane przez peroksysomalną β-oksydację kwasów tłuszczowych, mikrosomalny metabolizm cytochromu P450 związków ksenobiotycznych, stymulację fagocytozy przez patogeny lub lipopolisacharydy, metabolizm argininy i enzymy specyficzne dla tkanek.1,2
W normalnych warunkach ROS są usuwane z komórki poprzez działanie dysmutazy ponadtlenkowej (SOD), katalazy lub peroksydazy glutationowej (GSH). Główne uszkodzenia komórek wynikają z indukowanej przez ROS zmiany makrocząsteczek, takich jak wielonienasycone kwasy tłuszczowe w lipidach błonowych, niezbędne białka i DNA. Ponadto stres oksydacyjny i ROS są powiązane ze stanami chorobowymi, takimi jak choroba Alzheimera, choroba Parkinsona, rak i starzenie się.
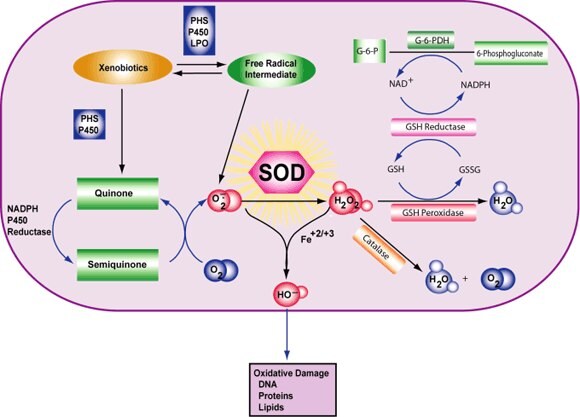
Rysunek 3.Reakcja dysmutazy ponadtlenkowej
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?