Glikozaminoglikany i proteoglikany
Zapoznaj się z rolą glikozaminoglikanów i proteoglikanów, w tym z pięcioma typami łańcuchów glikozaminoglikanów i ich strukturami, biosyntezą, degradacją i funkcjami. Przeglądaj również produkty glikozaminoglikanów i proteoglikanów do swoich badań.
Czytaj więcej o
Struktury GAG
Glikozaminoglikany (GAG) są dużymi liniowymi polisacharydami zbudowanymi z powtarzających się jednostek disacharydowych z podstawowymi konfiguracjami zawierającymi aminocukier (GlcNAc lub GalNAc) i kwas uronowy (kwas glukuronowy i/lub kwas iduronowy). Istnieje pięć zidentyfikowanych łańcuchów glikozoaminoglikanów (Rysunek 1):
Hialuronian nie jest siarczanowany, ale inne łańcuchy glikozoaminoglikanów zawierają podstawniki siarczanowe w różnych pozycjach łańcucha. Grupy siarczanowe, a także kwasy uronowe powodują, że łańcuchy glikozoaminoglikanów mają ładunek ujemny. Polimery GAG są znacznie większe niż N-glikany lub O-glikany, a łańcuchy są raczej liniowe niż rozgałęzione jak N-glikany.
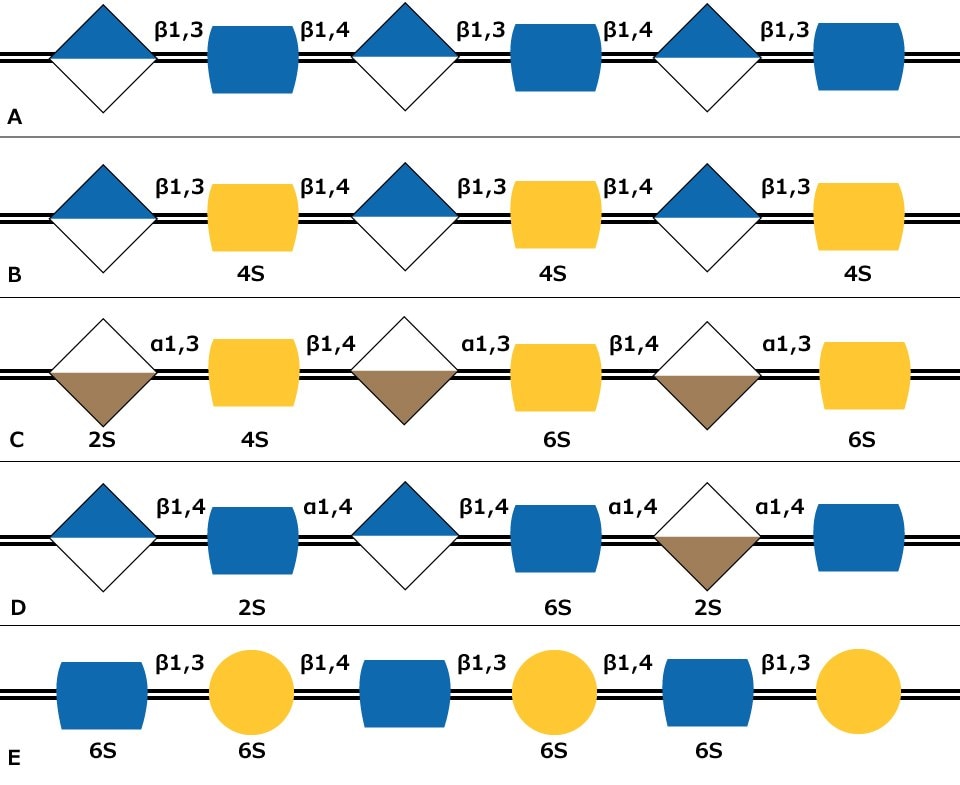
Rysunek 1. Sekwencje węglowodanów pięciu typów łańcuchów glikozaminoglikanów przy użyciu symboli monosacharydów: (A) Hialuronan, (B) Chondroityna, (C) Dermatan, (D) Heparyna i (E) Keratan. Wskazano możliwą obecność i lokalizację siarczanowania (2S, 4S lub 6S).
Hialuronan
.Hialuronian (HA; kwas hialuronowy) składa się z naprzemiennych reszt β-D-(1→3) kwasu glukuronowego (GlcA) i β-D-(1→4)-N-acetyloglukozaminy (GlcNAc) (Rysunek 2). W przeciwieństwie do innych glikozoaminoglikanów, hialuronian nie przyłącza się do białek, tworząc proteoglikany.
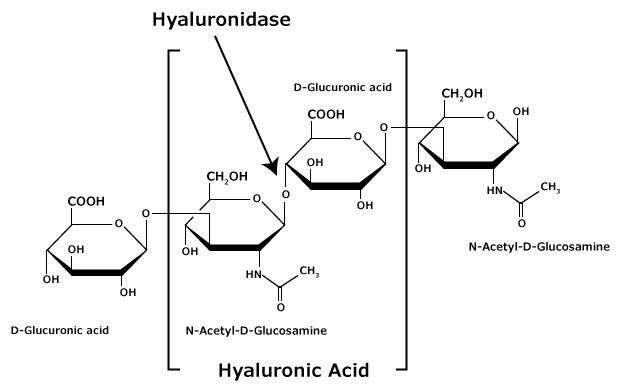
Rysunek 2.Kwas hialuronowy składa się z naprzemiennych reszt kwasu β-D-(1 3) glukuronowego i β-D-(1 4)-N-acetyloglukozaminy.
Chondroityna i dermatan
Siarczan chondroityny i siarczan dermatanu (siarczan chondroityny B) składają się z jednostek disacharydowych zawierających N-acetylogalaktozaminę (GalNAc) i kwas uronowy połączonych odpowiednio wiązaniami β(1→4) lub β(1→3) (Ryc. 3, 4, 5). Chondroityny zawierają kwas glukuronowy (GlcA) i są 4-O-siarczanowane (siarczan chondroityny A) lub 6-O-siarczanowane (siarczan chondroityny C). Siarczan dermatanu zawiera również N-acetylogalaktozaminę (GalNAc), ale kwas uronowy obecny w dermatanie to kwas L-iduronowy (IdoA).1
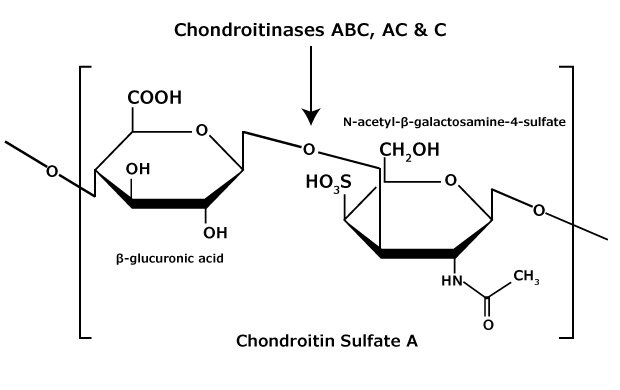
Rysunek 3.Siarczan chondroityny A składa się z naprzemiennego kopolimeru siarczanu kwasu β-glukuronowego-(1 3)-N-acetylo-β-galaktozaminy-4.
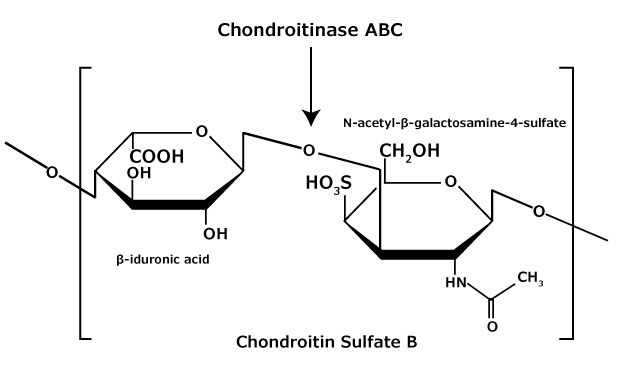
Rysunek 4.Siarczan chondroityny B (siarczan dermatanu) składa się z naprzemiennego kopolimeru siarczanu kwasu β-iduronowego-(1 3)-N-acetylo-β-galaktozaminy-4.

Rysunek 5.Siarczan chondroityny C składa się z naprzemiennego kopolimeru siarczanu kwasu β-glukuronowego-(1 3)-N-acetylo-β-galaktozaminy-6.
Heparan i heparyna
Glikozaminoglikany heparan i heparyna są złożonymi heterogenicznymi mieszaninami powtarzających się jednostek disacharydowych składających się z kwasu uronowego (D-glukuronowego lub L-iduronowego) i D-glukozaminy lub N-acetylo-Dglukozaminy (Rysunek 6). Na każdej jednostce monosacharydowej występują różne stopnie siarczanowania (w grupach zawierających tlen i/lub azot), od zera do trójsiarczanowania. Heparan jest mniej zasiarczony niż heparyna.
Rysunek 6.Glikozaminoglikan heparanu i heparyny składa się z heterogenicznych mieszanin powtarzających się jednostek D-glukozaminy i kwasów L-iduronowych lub kwasów D-glukuronowych, siarczanowanie przy każdej reszcie może się różnić.
Keratan
Siarczan keratanu różni się od innych łańcuchów glikozaminoglikanów tym, że nie zawiera reszt kwasu uronowego. Keratan składa się z podjednostek nacetylolaktozaminy (βGal-β(1→4)-GlcNAc). Może być przyłączony do szkieletu białka poprzez wiązanie N lub O.
Proteoglikany to specyficzna grupa glikoprotein, które mają co najmniej jeden łańcuch glikozoaminoglikanu przyłączony do białka; kategoryzacja jest zwykle oparta na obecnych łańcuchach GAG. Siarczan heparanu/heparyny i siarczan chondroityny są najczęstszymi GAG zawartymi w proteoglikanach. Ponadto większość proteoglikanów zawiera również N-linked i O-linked glikanów.
Biosynteza i degradacja
Biosynteza kwasu hialuronowego (hialuronianu) jest stereospecyficzną enzymatyczną kopolimeryzacją N-acetyloglukozaminy i kwasu glukuronowego. Syntetazy hialuronianu zaangażowane w ten proces wymagają UDP-Nacetyloglukozaminy i kwasu UDP-glukuronowego jako donorów cukru i mogą generować polimer o masie 1 000 000 daltonów w czasie krótszym niż minuta. Hialuronian jest rozszczepiany przez hialuronidazy; hialuronidazy jąder degradują hialuronian do tetrasacharydów, podczas gdy hialuronidazy bakteryjne degradują hialuronian do disacharydów. W lizosomach hialuronan jest degradowany do monosacharydów N-acetyloglukozaminy, która jest poddawana recyklingowi, i kwasu glukuronowego, który jest dalej metabolizowany na szlaku fosforanu pentozy.
Biosynteza siarczanowanych glikozoaminoglikanów obejmuje zarówno etapy polimeryzacji, jak i sulfatacji. Sulfacja jest przeprowadzana przez sulfotransferazy wykorzystujące donor siarczanu aktywowany 3′-fosfoadenylo-5′-fosforanem (PAPS). Łańcuchy keratanu mogą mieć ponad 20 000 daltonów i zawierać szereg podjednostek laktozaminy (βGal-β(1→4)-GlcNAc), które są niesiarczanowane, monosiarczanowane (6-pozycja GlcNAc) lub disiarczanowane (6-pozycja zarówno Gal, jak i GlcNAc). U zwierząt degradacja zachodzi poprzez katalizowane przez sulfatazę usunięcie końcowego siarczanu i sekwencyjne działanie egzoglikozydaz. Bakteryjne keratanazy mogą degradować siarczan keratanu w określonych pozycjach.
Zarówno siarczan chondroityny, jak i siarczan heparanu klasy siarczanowanych glikozoaminoglikanów łączą się z resztami seryny w białkach rdzeniowych poprzez wspólną konstrukcję tetrasacharydową (GlcA-Gal-Gal-Xyl-Ser). Proces ten jest inicjowany przez katalizowane przez ksylotransferazę przyłączenie ksylozy przy użyciu UDP-ksylozy jako donora. Po przyłączeniu tetrasacharydu struktura proteoglikanu różni się, ponieważ następne wiązanie węglowodanowe określa dołączoną klasę glikozoaminoglikanu. Wiązanie β-glikozydowe do N-acetylogalaktozaminy powoduje przyłączenie siarczanu chondroityny do peptydu, podczas gdy wiązanie α-glikozydowe do N-acetyloglukozaminy powoduje przyłączenie siarczanu heparanu.
Glycosaminoglycan & Proteoglycan Functions
Glikozaminoglikany i proteoglikany pełnią wiele funkcji. Hialuronian jest głównym składnikiem macierzy zewnątrzkomórkowej; wiąże i zatrzymuje cząsteczki wody oraz wypełnia luki między włóknami kolagenu. CD44, ludzka glikoproteina powierzchniowa, która uczestniczy w wielu funkcjach komórek, wiąże się z hialuronianem, a interakcje hialuronian-CD44 są związane z inwazją nowotworów złośliwych. Interakcje glikozaminoglikanów z różnymi ligandami są związane ze stanem zapalnym, wzrostem, krzepnięciem, fibrynolizą, lipolizą i biologią macierzy komórkowej.
Proteoglikany są również składnikami macierzy zewnątrzkomórkowej i wchodzą w interakcje z różnymi cząsteczkami, w tym cząsteczkami adhezji komórkowej i czynnikami wzrostu, takimi jak transformujący czynnik wzrostu-β (TGF-β) i podstawowy czynnik wzrostu fibroblastów (bFGF).
Znajdź więcej zasobów technicznych na naszej stronie poświęconej glikobiologii.
Glukozaminoglikany
Hydrolazy i liazy GAG
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?