Inteligentne powierzchnie na bazie poli(N-izopropyloakryloamidu) do inżynierii tkankowej arkuszy komórkowych
Masamichi Nakayama1, Teruo Okano1, Françoise M. Winnik2
1Institute of Advanced Biomedical Engineering and Science, Tokyo Women′s Medical University (TWIns), Kawada-cho 8-1, Shinjuku, Tokyo 162-8666, Japan, 2Department of Chemistry and Faculty of Pharmacy, University of Montreal, CP 6128 Succursale Centre Ville, Montreal QC Canada H3C 3J7
Material Matters 2010, 5.3, 5
Wprowadzenie
Inżynieria tkankowa stała się kluczowym narzędziem terapeutycznym w leczeniu uszkodzonych lub chorych narządów i tkanek, takich jak naczynia krwionośne i pęcherze moczowe.1 Niemniej jednak, główne wyzwania wciąż pozostają do pokonania, w szczególności budowa tkanek o wysokiej gęstości komórek i zapobieganie stanom zapalnym po transplantacji. Obiecujące podejście do inżynierii tkankowej opiera się na wykorzystaniu powierzchni hodowli komórkowych szczepionych poli(N-izopropyloakryloamidem) (PNIPAM, Prod. Nr 535311).2 Podstawową ideą jest to, że adhezja/odłączanie komórek na podłożach zmodyfikowanych PNIPAM może być osiągnięte poprzez prosty przełącznik temperatury (Rysunek 1).

Rysunek 1.(a) Schematyczne przedstawienie adhezji (37 °C) i oderwania (20 °C) komórki na powierzchni szczepionej poli(N-izopropyloakryloamidem). Zbiór komórek uzyskuje się po prostu poprzez obniżenie temperatury. (b) Mikrografie komórek śródbłonka na płytkach pokrytych PNIPAM w temperaturze 37 °C i 20 °C. Zwróć uwagę na wydłużony kształt komórek na lewym mikrografie, charakterystyczny dla podtrzymywanej hodowli komórkowej i zaokrąglony kształt komórek po prawej stronie, charakterystyczny dla wolnych komórek w roztworze.
Hodowane komórki mogą być pobierane z "inteligentnych" powierzchni PNIPAM w postaci podobnej do tkanki monowarstwy komórkowej lub "arkusza komórek" po prostu poprzez obniżenie temperatury hodowli komórek z 37 °C do 20 °C po osiągnięciu konfluencji. Ta technologia manipulacji komórkami umożliwia przeszczepianie arkuszy komórek do tkanek gospodarza bez użycia biodegradowalnych rusztowań polimerowych, przezwyciężając główne ograniczenia konwencjonalnej inżynierii tkankowej. W niniejszym artykule opisano chemię leżącą u podstaw tego procesu, zaczynając od krótkiego przeglądu właściwości PNIPAM w roztworze wodnym. Szczególny nacisk położono na projektowanie i wytwarzanie zmodyfikowanych powierzchni wykorzystywanych do uzyskania wielofunkcyjnych arkuszy komórkowych.
Poly(N-izopropyloakrylamid): The Ubiquitous "Smart" Polymer
PNIPAM jest rozpuszczalny w rozpuszczalnikach organicznych, takich jak chloroform, aceton, metanol i różne inne alkohole. Jest również rozpuszczalny w wodzie, o ile roztwór jest utrzymywany w rozsądnie niskiej temperaturze. Ogrzewanie wodnego roztworu PNIPAM powyżej 32 °C (punkt zmętnienia (CP) lub niższa temperatura krytyczna roztworu (LCST)) natychmiast przekształca klarowny roztwór w mleczną zawiesinę. Zjawisko to jest odwracalne: gdy tylko mleczna zawiesina zostanie schłodzona poniżej 32 °C, odzyskuje swoją klarowność.3 Pod koniec lat 60-tych Heskins i Guillet opublikowali pierwszy diagram fazowy układu woda/PNIPAM, który skonstruowali mierząc temperaturę przejścia fazowego w funkcji stężenia PNIPAM.4 Mniej więcej w tym samym czasie okazało się, że usieciowane sieci PNIPAM (żele) również wykazują ciekawe właściwości w wodzie: są bardzo spuchnięte w zimnej wodzie, ale kurczą się, gdy tylko zostaną podgrzane powyżej 32 ° C. Podobnie jak w przypadku roztworów PNIPAM, zachowanie żeli jest odwracalne, pęczniejąc z powrotem do pierwotnej objętości, gdy tylko zostaną schłodzone poniżej 32 ° C. Żel może wykonać setki cykli pęcznienia/kurczenia, bez oznak zmęczenia materiału. To niezwykłe zjawisko zostało zauważone przez Allana S. Hoffmanna, który jako jeden z pierwszych wykorzystał indukowane temperaturą przejście fazowe pochodnych PNIPAM jako wyzwalacz do kontrolowania zjawisk istotnych dla zastosowań biomedycznych, takich jak uwalnianie barwnika lub leku.5 Ta pionierska praca położyła podwaliny pod dziedzinę systemów responsywnych, która nadal pobudza wyobraźnię naukowców.6 Indukowane ciepłem przejście fazowe wykazywane przez wodne roztwory PNIPAM nie jest wyjątkowe, ponieważ wiele innych rozpuszczalnych w wodzie polimerów ma punkty zmętnienia. Jednak PNIPAM pozostaje liderem w zastosowaniach biomedycznych ze względu na ostrość przejścia, temperaturę przejścia zbliżoną do temperatury ciała, wytrzymałość samego polimeru oraz dostępność informacji na temat polimeru i jego przejścia fazowego.
Na poziomie molekularnym makroskopowe przejście fazowe odpowiada odwodnieniu łańcuchów PNIPAM, a następnie zapadnięciu się denudowanych łańcuchów hydrofobowych w zwarte globulki, które agregują się w większe mezoglobulki (Rysunek 2).7,8 Jednak przejście fazowe nie zależy wyłącznie od przegrupowania molekularnego wywołanego temperaturą. Kilka innych czynników może wpływać na CP PNIPAM, chociaż efekty nie zawsze są przewidywalne.
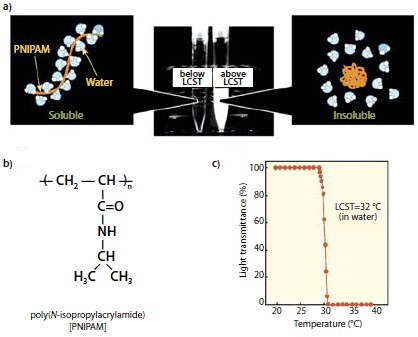
Rysunek 2.Właściwości wodnych roztworów poli(N-izopropyloakryloamidu) (PNIPAM) reagujące na temperaturę; (a) po podgrzaniu powyżej LCST, uwodniony wydłużony łańcuch PNIPAM zapada się w hydrofobową globulę z jednoczesnym uwolnieniem związanych cząsteczek wody; (b) struktura chemiczna powtarzalnej jednostki PNIPAM; (c) wykres zmian transmitancji roztworu w funkcji temperatury dla roztworu PNIPAM w wodzie. LCST odpowiada środkowemu punktowi krzywej przejściowej.
Masa cząsteczkowa
Zakres wpływu masy cząsteczkowej polimeru na punkt zmętnienia jest przedmiotem dyskusji. Istnieją doniesienia wskazujące, że punkt zmętnienia PNIPAM w wodzie jest bezpośrednio związany z masą cząsteczkową, podczas gdy inne donoszą o odwrotnej zależności CP od masy cząsteczkowej, a jeszcze inne donoszą, że CP wodnych roztworów PNIPAM są niezależne od masy cząsteczkowej. Różnice są szczególnie uderzające przy porównywaniu wyników uzyskanych dla stosunkowo krótkich łańcuchów polimerowych (Mw <20,000 g/L), dla których chemiczna natura końca łańcucha ma znaczący wpływ na wartość CP.9 Polimery z hydrofilowymi grupami końcowymi mają tendencję do wykazywania stosunkowo wysokiego punktu zmętnienia w roztworach o niskim stężeniu, podczas gdy polimery z hydrofobowymi grupami końcowymi zwykle mają niższe CP w tych samych warunkach.10 Tendencje te ulegają załamaniu w przypadku roztworów PNIPAM z silnie hydrofobowymi grupami końcowymi, takimi jak łańcuchy n-oktadecylowe, które samoorganizują się w wodzie, tworząc micele kwiatowe i gwiaździste.11,12
Systemy rozpuszczalników
Obecność systemów wielorozpuszczalnikowych może mieć również wpływ na CP PNIPAM. Na przykład, w temperaturze pokojowej, PNIPAM nie jest rozpuszczalny w mieszanym roztworze wody i metanolu w szerokim zakresie składu - wykazując zjawisko zwane współrozpuszczalnością.13
Obecność soli
Obecność soli może również wpływać na CP wodnych roztworów PNIPAM, przy czym niektóre sole powodują wzrost CP, podczas gdy dodanie innych soli powoduje spadek CP. Zaproponowano kilka wyjaśnień, aby wyjaśnić te obserwacje.14 Gdy czynniki wpływające na przejście fazowe PNIPAM zostaną w pełni zrozumiane, można je wykorzystać do dostosowania i optymalizacji PNIPAM do dalszych zastosowań. Jednak ekscytujące zastosowania tego inteligentnego polimeru zostały już odkryte.
Temperaturowo reagujące naczynia do hodowli komórkowych do inżynierii arkuszy komórkowych
Naczynia do hodowli komórkowych pokryte PNIPAM są przygotowywane przez napromieniowanie wiązką elektronów (0.3 MGy przy 150 kV) monomeru NIPAM (724459), osadzonego na komercyjnych naczyniach do hodowli komórkowych z polistyrenu do hodowli tkankowych (TCPS) z roztworu NIPAM w 2-propanolu (Rysunek 3). Obróbka ta skutkuje jednoczesną polimeryzacją NIPAM i kowalencyjnym szczepieniem rosnących łańcuchów polimerowych na powierzchniach TCPS. Metoda ta jest czysta, łatwa do skalowania i modelowania oraz umożliwia precyzyjną kontrolę nad grubością warstwy polimeru. Dla większości zastosowań w hodowli komórkowej, grubość szczepionej warstwy PNIPAM powinna mieścić się w zakresie 15-20 nm, co odpowiada gęstości szczepienia 1,4-2,0 μg/cm2.15

Rysunek 3.Schemat procedury przygotowania naczyń do hodowli komórkowych szczepionych poli(N-izopropyloakryloamidem).
Różne typy komórek przylegają i rosną na powierzchniach hodowlanych PNIPAM reagujących na temperaturę w warunkach hodowli podobnych do tych stosowanych ze zwykłymi płytkami TCPS. Po osiągnięciu zbieżności komórek w temperaturze 37°C, naczynia są schładzane poniżej 32°C (zazwyczaj do 20°C). Łańcuchy polimerowe nawadniają się i odpychają komórki, powodując ich odrywanie się od powierzchni hodowlanej w postaci arkusza komórek składającego się z przylegającej do siebie monowarstwy komórek. W konwencjonalnej inżynierii tkankowej opartej na komórkach, enzymy proteolityczne (np. trypsyna i dyspaza) są dodawane do pożywki hodowlanej w celu oderwania komórek poprzez rozerwanie cząsteczek adhezji komórkowej i białek macierzy zewnątrzkomórkowej (ECM). Obróbka ta może również wpływać na białka błony komórkowej, które są istotne dla różnych funkcji różnych typów komórek. Do pobrania komórek hodowanych na powierzchniach reagujących na temperaturę nie jest konieczna obróbka enzymatyczna. W związku z tym odzyskane arkusze komórek, które nadal posiadają podstawowe białka ECM, mogą być przenoszone na nowe naczynia hodowlane, inne arkusze komórek lub żywe tkanki. Trwa kilka badań klinicznych inżynierii tkankowej z wykorzystaniem przeszczepów pojedynczych arkuszy komórek, takich jak rogówka i więzadło przyzębia. Trwające badania obejmują homo- i heterotypowe nakładanie warstw wielu arkuszy komórek w celu stworzenia trójwymiarowych architektur przypominających tkanki, takich jak tkanki serca lub wątroby.16
Patterned Temperature-responsive Surfaces for Heterotypic Cell Co-Culture
Aby naśladować określone funkcje tkanek, konieczna jest regeneracja uporządkowanych przestrzennie architektur tkankowych z heterotypowymi interakcjami komórka-komórka. Integracja wielu typów komórek w ramach jednej architektury tkankowej 3D nie jest łatwa, ponieważ właściwości adhezyjne i proliferacyjne różnych typów komórek zwykle nie są takie same. W większości przypadków, współhodowla różnych typów komórek jest przeprowadzana na powierzchniach z mikrowypustkami. Mikrowzorzyste powierzchnie reagujące na temperaturę można łatwo wytwarzać w oparciu o fakt, że LCST PNIPAM można również modulować poprzez włączenie komonomeru. Kopolimery NIPAM z hydrofilowymi komonomerami mają LCST >32 °C, podczas gdy kopolimery NIPAM zawierające hydrofobowy monomer, taki jak metakrylan n-butylu (BMA), mają LCST <32 °C. Aby przygotować powierzchnię z mikrowzorem, roztwór BMA (235865) w 2-propanolu jest rozprowadzany na naczyniu TCPS szczepionym PNIPAM. Następnie powierzchnia pokryta BMA jest napromieniowywana wiązką elektronów przez maskę z mikrowzorem ze stali nierdzewnej.17 Monomery BMA są szczepione na wstępnie uformowanej warstwie PNIPAM w napromieniowanych obszarach, w przeciwieństwie do zamaskowanych sekcji, w których zachowany jest oryginalny PNIPAM. Temperatura przejścia napromieniowanych obszarów jest niższa niż 32 °C. Rzeczywista wartość LCST jest modulowana poprzez kontrolowanie poziomu inkorporacji BMA. Zastosowanie tej metody wzorcowania do współhodowli hepatocytów (HC) i komórek śródbłonka (EC) przedstawiono na Rysunku 4.
.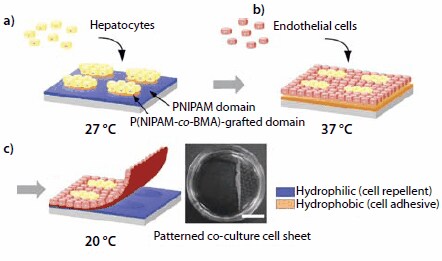
Rysunek 4.Schematyczne przedstawienie wzorzystej ko-kultury komórkowej i zbioru arkusza ko-kulturowanych komórek przy użyciu wzorzystej powierzchni reagującej na temperaturę. (a) Hepatocyty (HCs) są wysiewane i hodowane w temperaturze 27 °C, co skutkuje lokalizacją HCs na wyspach szczepionych P(NIPAM-co- BMA) wykazujących charakter hydrofobowy. (b) Komórki śródbłonka (ECs) są wysiewane i hodowane w temperaturze 37 °C, tworząc wzorzyste ko-kultury. (c) Obniżenie temperatury do 20 °C indukuje oderwanie arkusza współhodowanych komórek. Zebrany wzorzysty arkusz współhodowanych komórek (po prawej; pasek skali: 1 cm).
Najpierw, HC są wysiewane na mikrowzór utrzymywany w temperaturze 27 °C. Przylegają one wyłącznie do domen P(NIPAM-co-BMA), które są odwodnione (hydrofobowe) w tej temperaturze. Domeny PNIPAM, które są uwodnione (hydrofilowe) w temperaturze 27 °C, odpychają komórki (Rysunek 4a). Następnie interfejs pokryty HC jest podgrzewany do 37 °C. Domeny PNIPAM stają się hydrofobowe i EC są wysiewane. Przylegają one do domen PNIPAM i namnażają się (Rysunek 4b i 4c). Obniżenie temperatury hodowli do 20°C powoduje uwodnienie całej powierzchni. Współhodowana monowarstwa komórek oddziela się spontanicznie, tworząc ciągłą warstwę komórek z heterotypowymi interakcjami komórkowymi. Odzyskane arkusze współhodowanych komórek mogą być manipulowane i umieszczane pomiędzy innymi arkuszami komórek w celu przygotowania wielowarstwowych materiałów naśladujących tkanki.
Funkcjonalizacja naczynia hodowlanego reagującego na temperaturę
Chemicznie reaktywne (funkcjonalne) komonomery mogą być włączone do szczepionej warstwy PNIPAM i służyć jako miejsca wprowadzania bioaktywnych cząsteczek, jak pokazano na Rysunku 5.15

Rysunek 5.Schematyczna ilustracja reagującej na temperaturę kontroli powinowactwa między receptorami integrynowymi a peptydami RGDS (Arg-Gly-Asp-Ser). Ligandy RGDS są sprzężone z P(NIPAM-co-CIPAAm) przy użyciu tworzenia wiązania amidowego z chlorowodorkiem N-(3-dimetyloaminopropylo)-N′-etylokarbodiimidu (rozpuszczalny w wodzie karbodiimid (WSC, nr prod. E1769) jako odczynnik sprzęgający. W temperaturze 37 °C polimer reagujący na temperaturę kurczy się, odsłaniając ligandy RGDS (czerwone kulki) na receptory integrynowe błony komórkowej (żółte). W ten sposób komórki mogą być hodowane w warunkach wolnych od surowicy na unieruchomionych przez RGDS naczyniach hodowlanych reagujących na temperaturę. Obniżając temperaturę hodowli do 20°C, komórki są zbierane nieinwazyjnie. Ligandy RGDS pozostają przyczepione do powierzchni polimeru reagującego na temperaturę.
Po pierwsze, naczynia TCPS są szczepione kopolimerem NIPAM i 2-karboksyizopropyloakryloamidu (CIPAAm) poprzez polimeryzację wiązką elektronów mieszaniny NIPAM/CIPAAm (zawartość CIPAAm: 1-5 mol%). Następnie syntetyczny tetrapeptyd adhezji komórkowej, Arg-Gly-Asp-Ser (RGDS, A9041) jest łączony kowalencyjnie z naczyniem TCPS szczepionym P(NIPAM-co- CIPAAm) przy użyciu standardowych metod tworzenia wiązań amidowych.18 Obecność RGDS na interfejsie promuje adhezję komórek i wzrost do konfluencji w temperaturze 37 °C w warunkach hodowli bez surowicy uzupełnionej rekombinowanymi czynnikami wzrostu. Po osiągnięciu konfluencji, komórki mogą być zbierane jako nienaruszone arkusze komórek poprzez proste obniżenie temperatury do 20 °C, tak jak w przypadku naczyń hodowlanych szczepionych PNIPAM. Rehydratacja łańcuchów powierzchniowych PNIPAM nieodwracalnie przerywa interakcje między powierzchniowo immobilizowanymi peptydami RGDS a receptorami integrynowymi błony komórkowej. Strategia ta znacznie skraca okres hodowli i pozwala na wzrost komórek przy braku tradycyjnej płodowej surowicy bydlęcej, co jest ważnym czynnikiem, biorąc pod uwagę potencjalne ryzyko związane z wykorzystaniem produktów pochodzących od ssaków w produkcji tkanek stosowanych w zastosowaniach klinicznych w terapiach komórkowych dla ludzi.
Wnioski
.Przyszły postęp w inżynierii arkuszy komórkowych reagujących na temperaturę zależy od dostępności precyzyjnie zoptymalizowanych powierzchni szczepionych PNIPAM, umożliwiających kontrolowaną produkcję heterotypowych arkuszy komórkowych. Jedno z obiecujących podejść opiera się na zastosowaniu szczotek PNIPAM o kontrolowanej grubości i gęstości szczepienia przygotowanych w wyniku kontrolowanej polimeryzacji rodnikowej, takiej jak polimeryzacja rodnikowa z przeniesieniem atomu (ATRP) i odwracalna polimeryzacja z przeniesieniem łańcucha addycji i fragmentacji (RAFT).19-21 Rozwój tych nowych inteligentnych powierzchni oraz ich badania i zastosowania medyczne otworzą nowe granice w dziedzinie biologii i medycyny.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?