Polimerowe przeciwutleniacze dla metod terapeutycznych
Ilker S. Bayer
Smart Materials, Istituto Italianao di Tecnologia, Via Morego 30 Genova, 16163, Italy
Material Matters™, 2022, 17.2 | Material Matters™ Publications
Wprowadzenie
Stres oksydacyjny jest krytycznym elementem powiązania toksyczności środowiskowej z wieloetapowym procesem rakotwórczym. Reaktywne formy tlenu (ROS) lub reaktywne formy tlenu i azotu (RONS) są generowane zarówno w odpowiedzi na bodźce endogenne (z wewnątrz), jak i egzogenne (z zewnątrz). Aby zrównoważyć uszkodzenia, w których pośredniczą RONS, aktywowany jest endogenny system obrony antyoksydacyjnej. Jednakże, gdy stopień utlenienia przekracza takie mechanizmy zapobiegawcze, pojawia się stres oksydacyjny. Przewlekły i skumulowany stres oksydacyjny indukuje różne modyfikacje podstawowych makrocząsteczek biologicznych, takich jak DNA, lipidy i białka. Jest on również kluczowym źródłem skutków ubocznych związanych ze standardowymi metodami leczenia raka. Suplementacja przeciwutleniaczami, w tym witaminami A, C i E oraz polifenolami, takimi jak kwas taninowy, kwas galusowy i galusan epigalokatechiny (EGCG), może zmniejszyć działania niepożądane i toksyczne związane ze stresem oksydacyjnym i została udowodniona w różnych badaniach klinicznych. Pomimo ich silnego potencjału, bardzo niewiele przeciwutleniaczy zostało zatwierdzonych w medycynie ze względu na kilka ograniczeń, takich jak niska stabilność, słaba rozpuszczalność w wodzie, niska biodostępność i krótki czas krążenia w krwiobiegu, co prowadzi do niskiej skuteczności przeciwutleniaczy i długowieczności.1,2,3
Aby obejść ograniczenia związane z suplementami antyoksydacyjnymi, polimery antyoksydacyjne są uważane za skuteczne terapie antyoksydacyjne nowej generacji.4,6. Polimerowe przeciwutleniacze mają przedłużoną stabilność i krążenie oraz mogą uniknąć szybkiego usuwania przez układ odpornościowy, co skutkuje lepszą biodostępnością i potencjałem przeciwutleniającym. Ponadto, ponieważ polimery mogą być zaprojektowane w kilku użytecznych formach, takich jak filmy, żele, roztwory i nanocząstki, polimery przeciwutleniające mogą być dostarczane do miejsca zainteresowania i uwalniać zamknięte leki w kontrolowanej odpowiedzi na środowisko zapalne. Antyoksydacyjne platformy polimerowe mogą być zaprojektowane tak, aby reagować na kilka czynników biologicznych, takich jak pH, potencjał redoks i enzymy, a także bodźce egzogenne, takie jak światło, magnetyzm, ultradźwięki i promieniowanie rentgenowskie (Rysunek 1). Jako takie, polimerowe platformy przeciwutleniające służą jako nośniki transportowe do skutecznego dostarczania leków i płynnie działają jako zmiatacze RONS w całym procesie terapeutycznym.
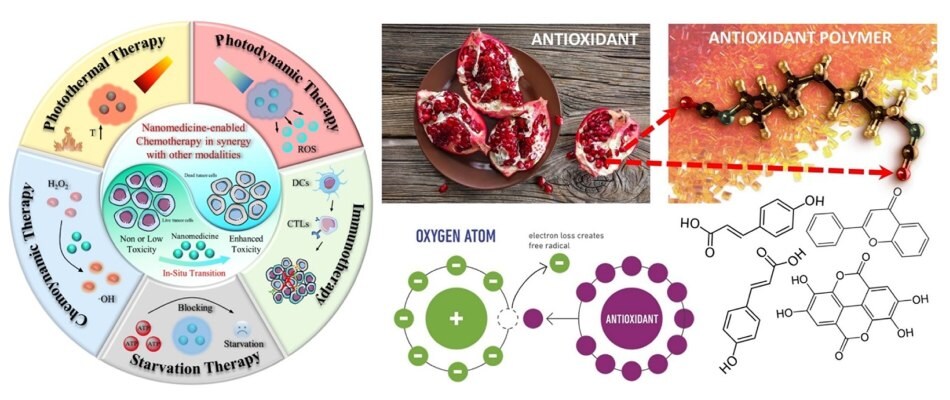
Rysunek 1.A) Schematyczne przedstawienie kilku szlaków chemioterapii wspomaganych nanomedycyną i powiązanych terapii przeciwnowotworowych. Przedrukowano za zgodą z odnośnika 9, prawa autorskie 2022 Springer. B) Cząsteczki przeciwutleniaczy mogą być ekstrahowane z kilku różnych roślin, owoców, a nawet ich odpadów po przetworzeniu. Mogą one skutecznie zmniejszać lub eliminować powstawanie wolnych rodników związanych z utratą elektronów w układach metabolicznych. Przedrukowano za zgodą z odnośnika 4, prawa autorskie 2021 Multidyscyplinarny Cyfrowy Instytut Wydawniczy.
Polimery z cząsteczkami przeciwutleniającymi
Historycznie, polimery z cząsteczkami przeciwutleniającymi zostały po raz pierwszy opracowane przemysłowo, aby zapobiec degradacji polimerów przez utlenianie. Na przykład, polipropylen został uodporniony na degradację oksydacyjną poprzez przyłączenie do głównego łańcucha wiązań krzyżowych cząsteczek przeciwutleniających.7 Zastosowania biotechnologiczne i biomedyczne zmodyfikowały polimery biomedyczne w podobny sposób, aby zmiatać ROS i RONS, takie jak szczepienie kwasu elagowego do chitozanu.8 Podobnie, wanilina, silny naturalny przeciwutleniacz (Rysunek 2A), może sieciować się z chitozanem i jako taka zwiększa jego właściwości mechaniczne i przekształca chitozan w polimer przeciwutleniający.10
Ponadto, nowe polimery przeciwutleniające są syntetyzowane metodami chemo-enzymatycznymi, takimi jak biopochodne liniowe oligomery alifatyczno-aromatyczne z kwasu ferulowego i lakazy Trametes versicolor.11 Wykazano również, że polimery hydroksycynamonowe o wysokiej masie cząsteczkowej pochodzące z Symphytum asperum Lepech (roślina kwitnąca) są skutecznymi antylipoperoksydantami (zmniejszają utlenianie lipidów). Jest to ważne, ponieważ poziom stresu oksydacyjnego i peroksydacji lipidów może wzrosnąć podczas różnych metod terapeutycznych w leczeniu raka, zaprzeczając samemu leczeniu.12,13
W naukach medycznych uszkodzenie wątroby związane z niedokrwieniem/reperfuzją (I/R) jest silnie związane ze stresem oksydacyjnym, w którym pośredniczy H2O2 i jest kluczowym arbitrem uszkodzenia komórek i tkanek. Dlatego H2O2 jest istotnym celem terapeutycznym dla stanów zapalnych związanych ze stresem oksydacyjnym. Polimer poli(szczawianu waniliny) (PVO) (Rysunek 2B) generuje CO2 poprzez wyzwalane przez H2O2 utlenianie estrów nadtlenowych i uwalnia wanilinę, która wywiera działanie przeciwutleniające i przeciwzapalne oraz hamuje stan zapalny i apoptozę.14 Ostatnio, synteza przeciwutleniających polimerów z pochodnych ligniny jest również bardzo interesująca.4 Fenole o różnych strukturach chemicznych można uzyskać z dekonstrukcji ligniny; wśród nich wanilina i kwas ferulowy. Różne polimery mogą być syntetyzowane poprzez różne modyfikacje chemiczne i ścieżki polimeryzacji.
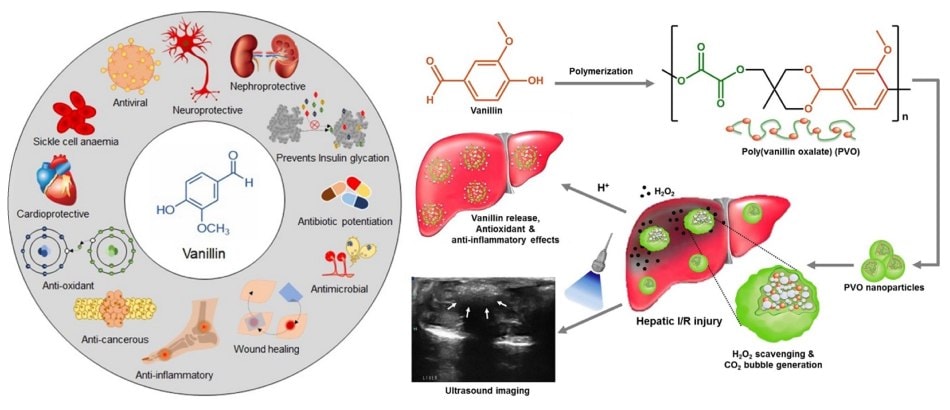
Rysunek 2.A) Cząsteczka przeciwutleniacza, wanilina. Ten naturalny ekstrakt może być łatwo polimeryzowany, ale jako cząsteczka wykazuje doskonałe właściwości terapeutyczne, takie jak przeciwnowotworowe, przeciwutleniające, przeciwzapalne, neuroprotekcyjne, przeciwobrzękowe, przeciw agregacji amyloidu i hamujące nieenzymatyczną glikację, przeciwbakteryjne, przeciwgrzybicze, anty-quorum sensing, wzmacnianie antybiotyków, gojenie się ran / inżynieria tkankowa i przeciwwirusowe. Przedrukowano za zgodą z referencji 15, prawa autorskie 2021 Springer Singapore. B) Schemat ilustrujący przeciwutleniający polimer PVO o właściwościach echogenicznych wyzwalanych przez H2O2 oraz wewnętrznej aktywności przeciwutleniającej i przeciwzapalnej. Leczenie PVO zwiększa intensywność echa w obrazowaniu ultrasonograficznym i wywiera działanie terapeutyczne w urazach niedokrwienia/reperfuzji (I/R) towarzyszących H2O2. Przedrukowano za zgodą z referencji 14, prawa autorskie 2016 Elsevier.
W przeciwieństwie do metod opartych na nośnikach, kowalencyjne wiązanie przeciwutleniaczy z polimerami może umożliwić wyższą względną zawartość przeciwutleniaczy poprzez zwiększenie ich trwałości i obecności. Strukturalne włączenie cząsteczek przeciwutleniaczy do polimerów może oferować większą elastyczność w stosowaniu systemów polimerowych do celów terapeutycznych, podczas gdy metody enkapsulacji są często ograniczone do systemów cząstek. Wśród powszechnych suplementów przeciwutleniających, witaminy A, C i E są szczególnie interesujące dla polimeryzacji. Te trzy witaminy są dobrze znane jako przeciwutleniacze, a ich niska lub zerowa toksyczność i zatwierdzenie regulacyjne sprawiają, że są one korzystne dla alternatywnych nowych materiałów. Jednak wiele witamin ma bardzo niską tolerancję na światło, ciepło i wilgoć, co komplikuje zachowanie bioaktywności podczas polimeryzacji lub szczepienia.16 Nawet jeśli ich kopolimeryzacja niekoniecznie jest prosta, szczepienie witamin do polimerów biomedycznych przy jednoczesnym zachowaniu silnego działania przeciwutleniającego może zapewnić identyczną ochronę antyoksydacyjną in vivo jak sama witamina.
Kwas retinowy, najbardziej aktywna biologicznie forma witaminy A, odgrywa istotną rolę w indukcji różnicowania komórek i zatrzymywaniu ich proliferacji. Został on wykorzystany w inżynierii komórek macierzystych i terapii przeciwnowotworowej, szczególnie w terapii różnicowania ostrej białaczki szpikowej. Ma on jednak niski poziom krążenia krwi ze względu na szybki metabolizm w wątrobie. Krążenie można poprawić poprzez szczepienie kwasu retinowego do rozpuszczalnego w wodzie oligosacharydu chitozanu w celu utworzenia przeciwutleniającego leku polimerowego.17 Podobnie, interesujące badanie nad witaminą E wykazało, że Trolox, syntetyczny przeciwutleniacz i rozpuszczalny w wodzie analog witaminy E, został spolimeryzowany w celu utworzenia aktywnego polimeru utleniającego jako nowej klasy biomateriału. Ten przeciwutleniający polimer hamował wewnątrzkomórkowe tworzenie ROS i zmniejszał podstawowe poziomy ROS w monocytach i komórkach śródbłonka. Skutecznie hamował również bezpośrednie skutki stresu oksydacyjnego, takie jak tworzenie karbonylu białkowego, poziomy 3-nitrotyrozyny i 4-hydroksy-2-trans-nonenalu w komórkach śródbłonka.18
Metal-chelating Intrinsically Antioxidant Polymers
Leki chelatujące i kompleksy metali chelatujących są potrzebne do zapobiegania, diagnozowania i leczenia raka. Zarówno komórki nowotworowe, jak i normalne wymagają do wzrostu i proliferacji niezbędnych jonów metali, takich jak żelazo, miedź i cynk. Chelatory mogą być ukierunkowane na szlaki metaboliczne komórek nowotworowych poprzez kontrolowanie białek zaangażowanych w regulację tych metali. Jednak nadmierny wychwyt jonów metali przez komórki może wyzwalać i katalizować RON, a specjalne chelatory mogą potencjalnie hamować oksydacyjne uszkodzenia DNA spowodowane przez centra katalityczne żelaza i miedzi. W szczególności chelatowanie nadmiaru żelaza w organizmie może skutecznie zwalczać guzy i skutki uboczne niektórych metod leczenia raka. W tym celu obiecującym początkiem może być nowo zsyntetyzowany poli(1,8-oktanodiol-co-cytrynian-co-askorbinian) (POCA), biodegradowalny elastomer na bazie kwasu cytrynowego o natywnych i wewnętrznych właściwościach przeciwutleniających (Rysunek 3A). POCA, syntetyzowany z 1,8-oktanodiolu, kwasu cytrynowego i kwasu askorbinowego, zmniejszał wytwarzanie ROS w komórkach i chronił komórki przed śmiercią komórkową wywołaną stresem oksydacyjnym (Rysunek 3B). Co ważne, właściwości przeciwutleniające POCA pozostały obecne po degradacji.19
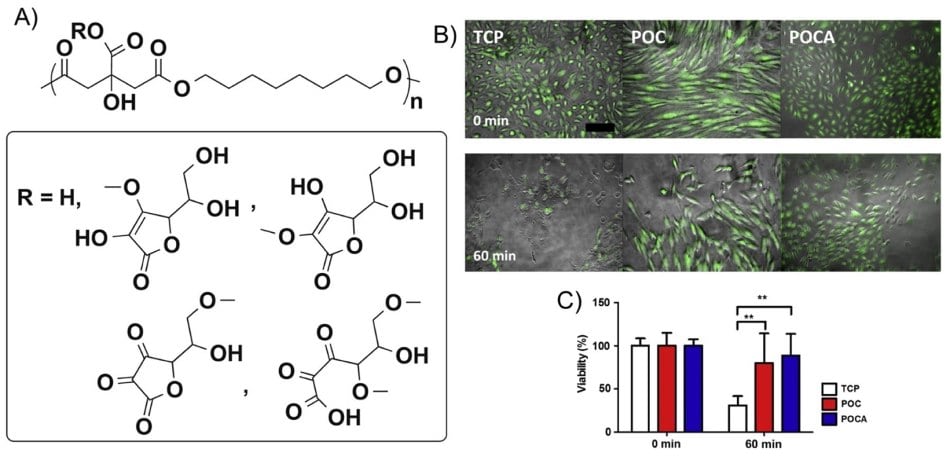
Rysunek 3.A) Proponowana struktura i schemat poli(1,8-oktanodiol-co-cytrynian-co-askorbinian) (POCA). W przypadku R = H, kopolimerem jest poli(1,8-oktanodiol-co-cytrynian) (POC). B) Ludzkie komórki śródbłonka żyły pępowinowej (HUVEC) hodowane na POC i POCA wykazywały przedłużone przeżycie po stymulacji menadionem przez 60 minut. POC i POCA zapewniały ochronę przed nadmierną śmiercią komórek wywołaną przez ROS. Pokazano połączony obraz nakładania się kontrastowej mikroskopii świetlnej z obrazem fluorescencyjnym. Kolor zielony oznacza barwnik kalceinowy AM dla żywych komórek. Słupek = 200 μm. C) Ilościowe określenie odsetka komórek kalceinowo AM dodatnich po 120 minutach w stosunku do komórek nieobciążonych. N = 4, średnia ± S.D., **p < 0,01. TCP oznacza płytkę do hodowli tkankowej. Przedrukowano za zgodą z referencji 20, prawa autorskie 2014 American Chemical Society.
Kolejny bardzo skuteczny polimer przeciwutleniający ze zdolnością chelatowania metali został zademonstrowany jako biodegradowalny, termoresponsywny żel z wewnętrznymi właściwościami przeciwutleniającymi odpowiedni do dostarczania środków terapeutycznych. Kwas cytrynowy, poli(glikol etylenowy) (PEG) i poli-N-izopropyloakrylamid (PNIPAAm) kopolimeryzowano przez sekwencyjną polikondensację i polimeryzację rodnikową w celu wytworzenia poli(cytrynianu glikolu polietylenowego-co-N-izopropyloakrylamidu) (PPCN).20 PPCN wykazywał aktywność zmiatania wolnych rodników, chelatował jony żelaza i hamował peroksydację lipidów, umożliwiając jednocześnie dostarczanie chemokin w kontrolowany sposób (Rysunek 4A). Dodatkowo, PPCN natychmiast tworzył makroskopowy żel in situ po wstrzyknięciu do tkanki podskórnej szczura, ułatwiał tworzenie nowej tkanki łącznej przy minimalnej reakcji ciała obcego i był resorbowany przez organizm po 30 dniach od implantacji (Rysunki 4B-D).

Rysunek 4.A) Struktura żelu polimerowego poli(cytrynian glikolu polietylenowego-co-N-izopropyloakrylamid) (PPCN). Żel PPCN ma niższą krytyczną temperaturę roztworu (LCST) 26 ° C i wykazuje wewnętrzne właściwości przeciwutleniające w oparciu o jego zdolność do zmiatania wolnych rodników, chelatowania jonów metali i hamowania peroksydacji lipidów. Podskórne wstrzyknięcie 150 µL PPCN (100 mg/ml, pH = 7,4) samicom szczurów Sprague Dawley. Czarne strzałki oznaczają lokalizację żelu B) bezpośrednio po wstrzyknięciu na grzbiecie szczura powstała wyczuwalna grudka C) Żel PPCN po 3 dniach D) zamrożony fragment żelu PPCN w tkance pobranej po 30 dniach. Większość żelu została zastąpiona nową tkanką. Przedrukowano za zgodą z referencji 20, prawa autorskie 2014 American Chemical Society.
Desferrioksamina (DFO), deferipron (DFP), desferasirox (DFX) i kwas etylenodiaminotetraoctowy (EDTA) są obecnie jedynymi zatwierdzonymi przez FDA związkami chelatującymi metale do specyficznego usuwania metali z metabolizmu. Pomimo zatwierdzenia przez FDA, związki te mają ograniczoną biodostępność, niewystarczającą selektywność, neurotoksyczność i inne sprzeczne wyniki dotyczące skuteczności terapeutycznej, szczególnie w odniesieniu do EDTA. Nowy system polimerowy DFO został opracowany przez otwarcie pierścienia glicydolu i reakcje aldehydowe z peronianem sodu. Polimerowy chelator żelaza został zsyntetyzowany przez sprzężenie DFO z hiperrozgałęzionym poliglicerolem (HPG) i spowodował poprawę czasu życia w krążeniu i usunięcie nadmiaru żelaza in vivo. Dodatkowo, polimer skutecznie regulował poziom ferrytyny w osoczu, co może potencjalnie przynieść korzyści pacjentom cierpiącym na przeciążenie żelazem po transfuzji.21 Zsyntetyzowano szereg dendrymerów wiążących żelazo zakończonych ligandami heksadentanowymi pochodzącymi z hydroksypirydynonu, hydroksypiranonu i cząsteczek katecholowych, które mogą służyć jako klinicznie użyteczne polimery chelatujące selektywnie żelazo (III). Zdolności chelatujące żelazo tych i podobnych polimerów powinny być brane pod uwagę, na przykład, w przypadku potencjalnego przeciążenia żelazem po tandemowej chemioterapii wysokodawkowej i autologicznym przeszczepie komórek macierzystych u pacjentów z neuroblastomą wysokiego ryzyka.22
Jednym z unikalnych zastosowań polimerów chelatujących metale jest wysoce specyficzne radioznakowanie przeciwciał monoklonalnych (mAbs) i ich wpływ na wychwyt guza i normalnej tkanki. Radioimmunoterapia (RIT) wykorzystuje mAbs skompleksowane z radionuklidami, które emitują cząstki α, β lub elektrony Augera do ogólnoustrojowego leczenia raka. Jednak w przypadku guzów litych nadal istnieją bariery dostarczania i penetracji znakowanych radioaktywnie mAb. Jednym z potencjalnych sposobów na pokonanie tej przeszkody jest zwiększenie odsetka cząsteczek przeciwciał niosących radionuklid w komórkach lub masach nowotworowych. Najczęściej radioznakowanie przeprowadza się poprzez sprzęganie chelatorów z mAbs, takich jak kwas dietylenotriaminopentaoctowy (DTPA) lub kwas tetraazacyklododekano-1,4,7,10-tetraoctowy (DOTA) w celu utworzenia kompleksu z radiometalami, jednak z bardzo niską wydajnością podstawienia/chelatowania. Nowy polimer chelatujący metal, oparty na szkielecie poliglutamidu (PGlu) ze szczepioną DOTA i glikolem polietylenowym (PEG), wykazał bardzo skuteczne leczenie RIT różnej wielkości złogów nowotworowych.23,24
Nanoterapie polimerowe z antyoksydantami
.Jak wspomniano wcześniej, zamiast kapsułkowania przeciwutleniaczy w żelach polimerowych lub nanocząstkach, alternatywną metodą oferującą obiecujące nowe metody leczenia jest sprzęganie leku lub przeciwutleniacza bezpośrednio z degradowalnym lub niedegradowalnym polimerem. Podejście to jest napędzane przez rosnący rynek farmaceutycznie aktywnych, ale strukturalnie delikatnych pro-leków, w których dowolna wybrana grupa funkcyjna cząsteczki leku jest modyfikowana w celu ochrony przed dezaktywacją i umożliwienia konwersji z powrotem do postaci aktywnej po podaniu. Wiele schorzeń można obecnie leczyć za pomocą nowych nanoterapeutyków, takich jak zakrzep, który jest związany z nadmiernym tworzeniem się szkodliwego H2O2.25 Ponieważ większość małocząsteczkowych przeciwutleniaczy posiada jedną lub więcej grup hydroksylowych lub tiolowych, mogą one być funkcjonalizowane i formułowane w struktury polimerowe poliestrowe, poliwodorkowe lub poli(β-aminoestrowe). Na przykład, chemia poli(beta-aminoestrów) (PBAE) została zastosowana do koniugacji kwercetyny i kurkuminy w usieciowane folie polimerowe, mikrocząstki, nanocząstki lub układy nanożelowe.26 W skrócie, polimer został zsyntetyzowany przez reakcję chlorku akryloilu i trietyloaminy z kurkuminą lub kwercetyną, tworząc pośredni akryl. Utworzony akryl reagował z diakrylanem PEG (PEG400DA), pierwszorzędową diaminą, taką jak 4,7,10-trioksa-1,13-tridekanodiamina (TTD), 2,20 (etylenodioksy)-bis-etyloamina (EDBE) i heksamotylodiamina (HMD), tworząc usieciowaną sieć polimerową. Nanożele o wielkości od 50 do 800 nm zapewniały równomierne uwalnianie w ciągu 24-36 godzin poprzez masową degradację hydrolityczną. Zarówno kurkumina, jak i skoniugowana kwercetyna wykazały ochronę przed indukowanym stresem oksydacyjnym w komórkach śródbłonka. Nanożele kurkuminy PBAE były wyraźnie badane pod kątem ich działania na mitochondrialny stres oksydacyjny, będący znaczącym źródłem produkcji ROS i RONS, i okazały się bardziej skuteczne w przerywaniu produkcji ROS niż wolna kurkumina.
Ulepszone bioaktywne preparaty przeciwutleniające mają również kluczowe znaczenie w leczeniu chorób zapalnych, takich jak miażdżyca. Cechą charakterystyczną wczesnej miażdżycy jest wychwyt utlenionych lipoprotein o niskiej gęstości (oxLDL) przez makrofagi, co skutkuje powstawaniem komórek piankowatych i blaszek miażdżycowych w ścianie tętnic. Wykazano, że nowa klasa nanocząstek z przeciwutleniającymi rdzeniami polimerowymi i powłokami zawierającymi amfifilowe makrocząsteczki ukierunkowane na receptory zmiataczy, oparte na kwasie diglikolowym połączonym z kwasem ferulowym i poli(bezwodnym estrem), przeciwdziałają wychwytowi wysokich poziomów oxLDL i regulują ROS w ludzkich makrofagach pochodzących z monocytów (HMDM).27 Niedawne istotne badanie wykazało, że nowa klasa nanocząstek polimerowych o działaniu przeciwutleniającym łagodzi zaburzenia zapalne skóry wywołane promieniowaniem ultrafioletowym B u bezwłosych myszy Kud:Hr. Nanocząstki te były podawane doustnie, ponieważ technologia ta jest określana jako nanoterapeutyki doustne.28
Dodatkowo, przeciwutleniające nanocząstki polimerowe wykonane z metoksy-poli(glikolu etylenowego)-b-poli(chlorometylostyrenu) (MeO-PEG-b-PCMS) zapewniły skuteczną strategię przeciwstarzeniową w celu ochrony skóry przed ROS i zmniejszenia szkodliwych dla skóry skutków długotrwałej ekspozycji na promieniowanie UV. W skrócie, MeO-PEG-b-PCMS został zsyntetyzowany przez rodnikową polimeryzację chlorometylostyrenu (CMS) przy użyciu metoksy-poli(glikolu etylenowego)-hydroksylu ze szczepionym środkiem przenoszącym łańcuch. Następnie grupy chlorometylowe zostały przekształcone w rodnik nitroksylowy w reakcji aminowania z rodnikiem NH2-TEMPO (Rysunek 5A). Ten amfifilowy kopolimer blokowy został wykorzystany do syntezy nanocząstek podawanych doustnie poprzez hydrofobowe oddziaływania aktywnych segmentów NH2-TEMPO. Po dysocjacji przy niskim pH, polimer redoks został uwolniony i krążył we krwi, zapewniając ochronę przed ROS.
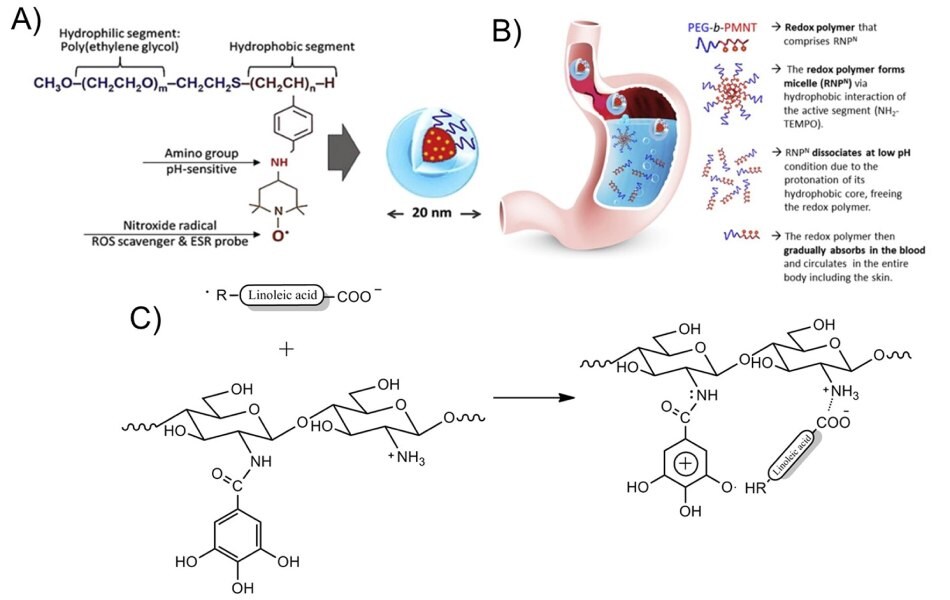
Rysunek 5.Projektowanie nanocząstek doustnych, ich dostarczanie i wchłanianie w organizmie, w tym przez skórę. A) Struktura chemiczna nanocząstek polimerowych wrażliwych na pH. B) Graficzna ilustracja doustnego dostarczania nanocząstek polimeru przeciwutleniającego oraz ich wchłaniania do organizmu i skóry. Unikalne właściwości nanocząstek pozwalają na stopniowe wchłanianie do krwiobiegu po podaniu doustnym, utrzymując ich biodostępność na wysokim poziomie dla ich skutecznego efektu zmiatania ROS. Przedruk za zgodą z referencji 28, prawa autorskie 2017 Elsevier. C) Proponowana interakcja między kwasem galusowym a chitozanem i wolnymi rodnikami kwasu linolowego. Przedrukowano za zgodą z odnośnika 29, prawa autorskie 2014 American Chemical Society.
Kolejnym obiecującym jadalnym polimerem przeciwutleniającym, który można przekształcić w nanocząstki, jest chitozan szczepiony kwasem galusowym, który wykazywał silniejszy potencjał przeciwutleniający i regulowane właściwości reologiczne niż czysty kwas galusowy.29 Podobnie, koniugacja chitozanu z kwasem chlorogenowym również tworzyła silne przeciwutleniające układy polimerowe przeciwko peroksydacji lipidów. Kopolimer wykazał lepszy potencjał przeciwutleniający, a jego zdolność do hamowania wybielania kwasu β-karotenowo-linolowego i peroksydacji lipidów była silniejsza niż samego kwasu chlorogenowego.
Galusan epigallokatechiny (EGCG) jest najbardziej aktywną katechiną spośród polifenoli herbaty i stanowi 50-80% całkowitej katechiny obecnej w zielonej herbacie. Potencjalne właściwości prozdrowotne EGCG obejmują silną aktywność przeciwutleniającą, chemoprewencję nowotworów, ochronę radiologiczną, poprawę zdrowia układu sercowo-naczyniowego i działanie przeciw otyłości. Stwierdzono, że EGCG jest około 10 razy bardziej skuteczny niż β-karoten i L-askorbinian w usuwaniu rodników alkilowo-peroksylowych.30 Jednak bioaktywność EGCG jest ograniczona przez jego niską biodostępność po podaniu doustnym i słabą stabilność. EGCG jest wysoce rozpuszczalny w wodzie, jednak może być łatwo utleniany w fazie wodnej. Aby obejść te ograniczenia i służyć jako solidny polimer teranostyczny, można go zaszczepić w odpowiednich szkieletach polimerowych. W tym celu koniugaty β-laktoglobuliny (BLG) i kwasu chlorogenowego (CA) z kontrolowanymi ilościami EGCG zostały wygenerowane metodą szczepienia indukowanego wolnymi rodnikami. Otrzymane nanocząstki miały średni rozmiar 100 nm i zawierały do 75% EGCG. Ich zastosowanie i funkcjonalność w terapiach przeciwnowotworowych nie zostały jeszcze zbadane. Oczekuje się jednak, że przyniosą one obiecujące wyniki, które mogą utorować drogę do syntezy innych funkcjonalnych nanocząstek polimerowych opartych na β-lakto globulinie.
Na koniec chcielibyśmy podkreślić znaczenie projektowania polimerów przeciwutleniających z metaloprotein (białek zawierających kofaktor jonów metali), takich jak zespoły polimer/hemoglobina.31 Podejście to nie polega na kapsułkowaniu hemoglobiny jak leku, ale na tworzeniu polimerowych nanostruktur hemoglobiny, które mogą być skutecznie stosowane w leczeniu problemów zdrowotnych związanych na przykład z niedotlenieniem. Obiecujące postępy zostały już poczynione. Na przykład, polimerowe nanocząstki otrzymane z hemoglobiny sprzężonej z enzymami przeciwutleniającymi za pomocą dikarboksymetylowanych łączników poli(glikolu etylenowego) (PEG) i polimeryzacji z otwarciem pierścienia (Rysunek 6) wykazały korzystny wpływ na ochronę komórek beta trzustki przed ciężkim niedotlenieniem w miejscach przeszczepu.32 Podobnie, polihemoglobina-katalizator dysmutazy ponadtlenkowej została zaprojektowana jako nośnik tlenu o właściwościach przeciwutleniających. Polimer został przygotowany poprzez sieciowanie hemoglobiny z dysmutazą ponadtlenkową i katalazą za pomocą aldehydu glutarowego. Ten polimer hemoglobiny zmniejszał powstawanie rodników tlenowych w porównaniu z samą hemoglobiną w modelu niedokrwienia i reperfuzji jelit u szczurów.33 Opisano również nowy, termoreaktywny koniugat hemoglobiny z polimerem. Polimer został zsyntetyzowany poprzez reakcję grup aminowych lizyny hemoglobiny i grup karboksylowych kopolimeru, poli(N-izopropyloakrylamidu) szczepionego karboksylowanym dekstranem, poprzez żywą polimeryzację rodnikową z przeniesieniem pojedynczego elektronu. Po podgrzaniu powyżej LCST, koniugat mógł tworzyć izolowane jednolite kuliste nanocząstki.34
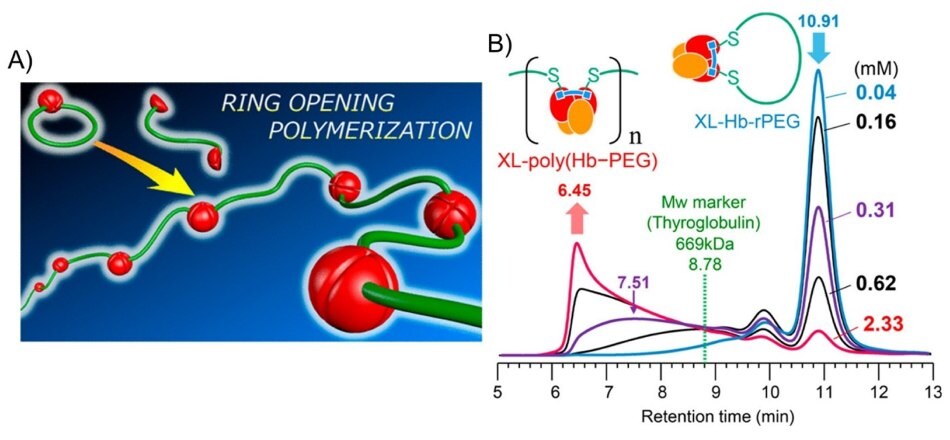
Rysunek 6.A) Nowa klasa polimerów hemoglobiny otrzymywanych metodą polimeryzacji z otwarciem pierścienia. Polimer, poli(Hb-PEG), jest syntetyzowany w reakcji natywnej hemoglobiny z dwufunkcyjnym maleimidem-PEG. Polimeryzacja z otwarciem pierścienia zachodzi poprzez wymianę podjednostek αβ międzycząsteczkowo w celu wytworzenia poli(Hb-PEG). B) Profile chromatografii wykluczania (SEC) uzyskane dla produktów reakcji monomeru Hb-PEG z fumaranem bis(3,5-dibromosalicylu) (DBBF) przy różnych stężeniach monomeru 0,04, 0,16, 0,31, 0,62 i 2,33 mM. Przedrukowano za zgodą z referencji 35, prawa autorskie 2019 American Chemical Society.
Perspektywy na przyszłość
Z uwagi na trwające wyjaśnianie dokładnej roli stresu oksydacyjnego w wielu patologiach, ostatnie badania naukowe w dziedzinie polimerów doprowadziły do znacznego wzrostu liczby badań związanych z terapiami obniżającymi stres oksydacyjny. Głównym celem tego artykułu było wykazanie, że polimerowe przeciwutleniacze mogą być "przeciwutleniaczami" nowej generacji w teranostyce, ze względu na ich silne właściwości przeciwutleniające i zwiększoną stabilność w układach wodnych w porównaniu z wieloma czystymi cząsteczkami fenolowymi. Aby przezwyciężyć wyzwania i ograniczenia związane z bezpośrednim, ogólnoustrojowym podawaniem przeciwutleniaczy, takie jak niestabilność, ograniczenia wchłaniania, niska rozpuszczalność, zmniejszona biodostępność i ograniczona przepuszczalność przez błony komórkowe wielu cząsteczek przeciwutleniaczy, obecnie aktywnie badane są terapie przeciwutleniające oparte na polimerach. Aby polimery te były rzeczywiście skuteczne w zastosowaniach biologicznych, muszą być syntetyzowane przy użyciu łagodnych metod. Głębsze zrozumienie czynników wpływających na aktywność przeciwutleniającą dałoby możliwość zaprojektowania wszechstronnych, wysokowydajnych polimerów o zwiększonej aktywności przeciwutleniającej. Ponieważ naturalnie występujące związki fenolowe mają doskonałe profile zmiatania ROS, cząsteczki te mogą służyć jako doskonałe materiały wyjściowe do syntezy polimerowych przeciwutleniaczy. Polimeryzacja katalizowana enzymatycznie powinna być bardziej badana, ponieważ umożliwia syntezę fenoli polimerowych w warunkach przyjaznych dla środowiska.
Wiele polimerów biomedycznych o znanych pro-utleniających produktach degradacji, takich jak polikaprolakton, kwas polimlekowy lub kwas poliglikolowy, powinno być zaprojektowanych tak, aby były neutralne lub nawet przeciwutleniające poprzez kopolimeryzację z przeciwutleniaczami. Umożliwi to stopniowe przejście od metod enkapsulacji do strukturalnego włączania przeciwutleniaczy do układu polimerowego. Jednak większość raportów dotyczących żywotności komórek niekoniecznie porównuje zmierzone górne granice przeżywalności komórek z lokalnymi stężeniami potrzebnymi do skutecznej modulacji stresu oksydacyjnego. To sprawia, że dość problematyczna jest ocena, czy technologie polimerów antyoksydacyjnych kwalifikują się do walki z konkretnymi patologiami. Jednocześnie poprawiło się nasze zrozumienie sposobu działania naturalnych przeciwutleniaczy. Na przykład, ostatnie badania nad strukturą i właściwościami przeciwutleniającymi potwierdzają, że właściwości przeciwutleniające flawonoidów zwiększają się dzięki obecności grupy hydroksylowej w pozycji C3 i cząsteczki katecholu. W przypadku kemferolu i kwercetyny grupa hydroksylowa 3-OH jest najbardziej zaangażowana w tworzenie struktury rodnikowej. Delokalizacja ładunku elektronowego w wyniku kompleksowania ligandów z metalami o wysokim potencjale jonowym (Fe (III), Ln (III) Y (III)) może prowadzić do zwiększenia właściwości przeciwutleniających, według naszych wstępnych badań, nawet 10-krotnie. Jednak pozytywna lub negatywna rola tych metali w zastosowaniach teranostycznych musi być oceniana bardzo ostrożnie.
Nowe doniesienia o syntezie polimerów są zachęcające i obiecujące, takie jak elektroaktywne i biokompatybilne terpolimery na bazie tetra(aniliny) o przestrajalnych wewnętrznych właściwościach przeciwutleniających in vivo. Polimery te są otrzymywane z niebiodegradowalnych lub niejadalnych związków, takich jak tetra(anilina), chlorek fumarylu i glikol polietylenowy. Jednak po polimeryzacji przekształcają się w biodegradowalne i nietoksyczne polimery przeciwutleniające. Kationowe pochodne skrobi sfunkcjonalizowane 1,2,3-triazolem są obiecującymi nowymi systemami, którym wciąż brakuje szeroko zakrojonych badań z zakresu teranostyki medycznej. W związku z tym przyszłe badania powinny uwzględniać (i) analizę wpływu długotrwałej ekspozycji na różne stężenia polimerowych (nano) przeciwutleniaczy; (ii) ocenę potencjalnych zagrożeń podczas produkcji, manipulacji i przechowywania; (iii) uproszczenie procesów produkcyjnych w celu wytworzenia wysoce skutecznych systemów; (iv) zwiększenie odtwarzalności, biokompatybilności, niezawodności, wytrzymałości i stabilności polimerowych (nano) przeciwutleniaczy w mikrośrodowiskach biologicznych; oraz (v) projektowanie mikroreaktorów, które mogą skutecznie kontrolować parametry syntezy reakcji.
Polimerowe przeciwutleniacze wykazały wysoką siłę działania w zakresie wyczerpywania stresu oksydacyjnego z wysokim komórkowym potencjałem przeciwutleniającym, specyficznością i ukierunkowanym dostarczaniem. Jednakże, aby osiągnąć znaczące korzyści kliniczne, dogłębne zrozumienie szczegółowych mechanizmów antyoksydacyjnych tych nowych polimerów wymaga szerokiej współpracy ekspertów z różnych dziedzin, w tym materiałoznawstwa, chemii oraz dziedzin fizycznych i biomedycznych. Dogłębne badania mechanistyczne stresu oksydacyjnego in vivo będą pomocne w zrewolucjonizowaniu polimerowej terapii antyoksydacyjnej.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?