Podłoże dla pierwotnych komórek nowotworowych
Nowotwory składają się z heterogenicznej mieszaniny wielu współdziałających typów komórek, w tym fenotypów nienowotworowych i złośliwych, takich jak komórki nowotworowe, fibroblasty związane z nowotworem (CAF), makrofagi związane z nowotworem (TAM) i komórki zrębu. Tylko niewielka subpopulacja to komórki nowotworowe zdolne do napędzania progresji i ostatecznie prowadzące do złośliwości. Te złośliwe komórki mają nieograniczony potencjał proliferacji, samoodnawiania i oporności na leki cytotoksyczne. Złożoność nowotworów sprawia, że oczyszczanie i charakteryzowanie złośliwej subpopulacji komórek nowotworowych jest trudne.
Modele nowotworowe in vivo w tym ksenografie pochodzące od pacjentów (modele PDX), zostały opracowane w celu ustanowienia hodowli nowotworów u żywych zwierząt, ponieważ bezpośrednia izolacja in vitro nie była skuteczna. Po kilku rundach seryjnych in vivo transplantacji tkanki nowotworowej u myszy o poważnie obniżonej odporności, komórki guza pierwotnego ostatecznie rozwijają się w stabilną populację komórek nowotworowych. Uważa się, że mysie modele PDX zachowują pierwotne cechy guza, w tym heterogeniczną histologię, kliniczne sygnatury biomolekularne, złośliwe fenotypy i genotypy, architekturę guza i układ naczyniowy. Techniki te są jednak często kosztowne, czasochłonne, skomplikowane, zmienne i wywołują poważne zmiany w pierwotnych komórkach nowotworowych spowodowane procesem selekcji seryjnej u zwierząt.
Tradycyjne pożywki do hodowli nowotworów in vitro nie są specyficzne dla komórek złośliwych. Pożywki te w przeważającej mierze wspierają proliferację łagodnych komórek zrębu i zróżnicowanych komórek (nienowotworowych), prowadząc w ten sposób do stopniowej utraty pierwotnej populacji komórek złośliwych. PromoCell Primary Cancer Culture System (C-28081), składający się z Primary Cancer Cell Medium D-ACF (C-28080, C-39880) i NCCD-Reagent (C-43080), został zaprojektowany jako pierwsze powszechnie stosowane i opłacalne rozwiązanie do in vitro izolacji długoterminowej pierwotnej hodowli guza z próbek guza pacjenta lub ksenograftów pochodzących od pacjenta (PDX). Proces selekcji wykorzystuje zastrzeżoną powłokę NCCD-Reagent i zoptymalizowaną pożywkę do hodowli komórek nowotworowych wolną od zwierząt. System umożliwia niezawodne usuwanie łagodnych komórek z hodowli, jednocześnie wspierając utrzymanie złośliwych komórek nowotworowych. System może być również wykorzystywany do innych zastosowań, takich jak wzbogacanie złośliwych subpopulacji w ustalonych liniach komórkowych lub usuwanie komórek zrębu i innych komórek nienowotworowych z ustalonych pierwotnych hodowli komórek nowotworowych.

Protokół hodowli komórek
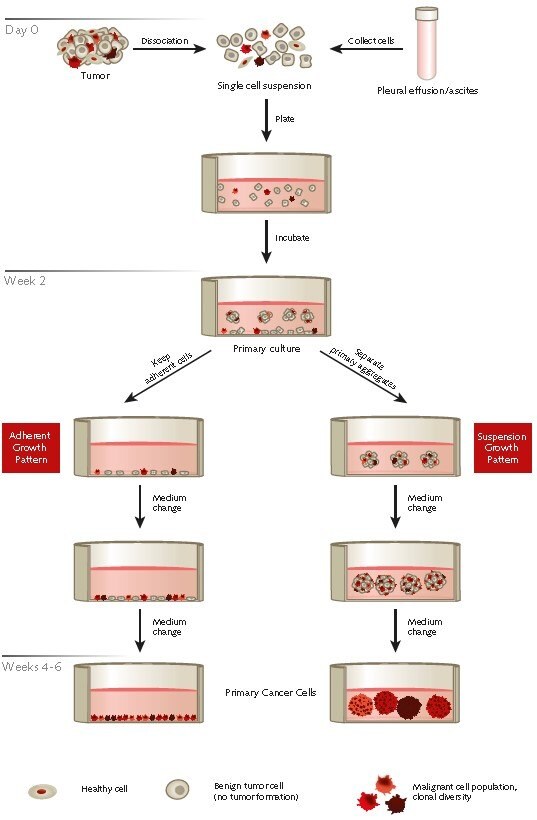
Rysunek 1. Przegląd protokołu selektywnej izolacji pierwotnych ludzkich komórek nowotworowych z próbek guza lub wysięków pochodzących od pacjenta przy użyciu systemu pierwotnej hodowli nowotworów PromoCell.
A) Protokół zakładania pierwotnych hodowli komórek nowotworowych
I. NCCD Treatment of the Plasticware (day 0)
Użycie NCCD-Reagent (C-43080) dostarczonego z systemem Primary Cancer Culture jest wymagane do pomyślnej izolacji i utrzymania komórek nowotworowych. Rozcieńczyć rozmrożony roztwór podstawowy NCCD-Reagent w stosunku 1:20 za pomocą PBS. Użyć 100 μL/cm2 do potraktowania naczynia do hodowli tkankowej rozcieńczonym odczynnikiem NCCD i pozostawić zamknięte naczynie na co najmniej 1 godzinę w temperaturze RT. Upewnić się, że NCDD pokrywa całą powierzchnię naczynia. Odessać roztwór NCCD tuż przed posianiem komórek.
II. Procedura izolacji komórek nowotworowych (dzień 0)
- Umyj i zważ tkankę nowotworową. Usuń widoczne pozostałości zdrowej tkanki z guza. Umieść próbkę guza w probówce i przemyj dwukrotnie dużą ilością PBS (D8537) i energicznie wstrząśnij. Zważyć tkankę guza na wstępnie przygotowanej sterylnej płytce Petriego.
- Homogenizacja tkanki guza. Umieść umytą próbkę guza na pokrywie płytki Petriego. Dodaj niewielką objętość (1-2 ml) pożywki Primary Cancer Cell Medium D-ACF (C-28081) do tkanki guza i podziel ją na małe kawałki za pomocą skalpela. Homogenizuj tkankę do postaci "zawiesiny" lub małych kawałków o wielkości około 1 mm3 dodatkowo rozdrabniając kawałki tkanki za pomocą skalpela.
- Umyć zhomogenizowaną tkankę guza. Przenieść zhomogenizowaną tkankę guza do probówki o pojemności 50 ml za pomocą kleszczyków. Dodaj 10-krotną objętość (w/v) PBS (D8537) i energicznie wymieszaj. Pozostaw kawałki tkanki na 2 minuty, a następnie odessaj supernatant.
- Przeprowadź enzymatyczne trawienie tkanki nowotworowej.A7089) w stężeniu 20 ml/gram tkanki guza. Inkubować w temperaturze RT z delikatnym, ale ciągłym mieszaniem. Trawić, aż roztwór stanie się wyraźnie mętny. W zależności od rodzaju tkanki, zwykle następuje to po około 30-60 minutach.
- Usuń pozostałości tkanki z próbki.Pozwól pozostałym fragmentom tkanki osiąść na 2 minuty. Aby uzyskać zawiesinę pojedynczych komórek, stopniowo przefiltruj mętny supernatant za pomocą sit komórkowych o malejącym rozmiarze porów do 40 μM. Uwaga: Odrzuć pozostałe kawałki tkanki.
- Rozcieńczyć próbkę za pomocą pożywki. Rozcieńczyć zawiesinę pojedynczych komórek w stosunku co najmniej 1:1 za pomocą pożywki Primary Cancer Cell Medium D-ACF (C-28081). Użyj wyższego stosunku rozcieńczenia, jeśli roztwór jest nadal lepki.
- Uzyskaj wyizolowane pojedyncze komórki. Peelinguj zawiesinę komórek przez 10 minut przy 240 x g w temperaturze RT i ostrożnie odessaj supernatant bez naruszania osadu komórek.
- Określić liczbę żywych komórek jądrzastych. Ponownie zawiesić osad komórkowy w 5 ml pożywki Primary Cancer Cell Medium D-ACF (C-28081). Określić liczbę żywych komórek jądrzastych przy użyciu odpowiedniej metody.
- Umyć komórki. Wirować zawiesinę komórek przez 10 minut z prędkością 240 x g w temperaturze RT i ostrożnie odessać supernatant bez naruszania osadu komórek. Na koniec ponownie zawiesić osad komórek w 1 ml pożywki D-ACF dla pierwotnych komórek nowotworowych (C-28081).
- Płytkowanie komórek.2 w przygotowanych naczyniach do hodowli tkankowej poddanych działaniu NCCD. Umieścić 2,5-5 milionów żywych komórek jądrzastych w kolbie T-25 przy użyciu 5 ml pożywki. Umieścić 7,5 - 15 milionów żywych komórek w kolbie T-75 przy użyciu 10 ml pożywki. Dodaj 50 μg/mL gentamycyny (G1397) do końcowej objętości i inkubuj w temperaturze 37°C z 5% CO2.
III. Pierwotna hodowla komórek nowotworowych
- Inicjacja pierwotnej hodowli komórek nowotworowych (dzień 0). Inkubuj hodowlę przez łącznie 10 - 14 dni, aby umożliwić rozpoczęcie pierwotnej hodowli komórek nowotworowych, ale przejdź do kroku drugiego w dniu 6 po umieszczeniu.
- Dodaj świeżą pożywkę (dzień 6). W dniach 5 - 7 dodaj do komórek dodatkową objętość początkowej objętości hodowli świeżej pierwotnej pożywki dla komórek nowotworowych D-ACF (C-28081) (bez antybiotyków). Nie zmieniaj pożywki; po prostu dodaj więcej świeżej pożywki. Kontynuuj inkubację, aż hodowla osiągnie etap opisany w kroku 3.
- Zainicjuj oddzielną wtórną hodowlę zawiesinową (dni 10 - 14). Hodowla pierwotna jest gotowa do kroku 3, gdy tylko rozwiną się wystarczająco duże pływające agregaty wielokomórkowe (tj. ≥70 μM średnicy) lub pojawią się małe agregaty składające się z mniej niż 10 komórek. W zależności od wzoru komórek zawiesiny hodowli pierwotnej, kontynuuj krok 3a lub 3b, w zależności od tego, co jest bardziej odpowiednie.
3a) Oddzielanie większych agregatów (≥70 μM lub ≥10 komórek). Aby oddzielić ustalone agregaty pierwotnych komórek nowotworowych, zbierz zużytą pożywkę (zawierającą agregaty) do oddzielnej stożkowej probówki o pojemności 15 ml. Przemyć pozostałe przylegające komórki dwukrotnie PBS (D8537), natychmiast dodać odpowiednią ilość świeżej pożywki Primary Cancer Cell Medium D-ACF (C-28081) i umieścić je z powrotem w inkubatorze. Pozostawić probówkę z agregatami zawiesiny w pozycji pionowej na 15 minut w temperaturze RT, aby umożliwić sedymentację grawitacyjną agregatów pierwotnych. Następnie delikatnie odessać supernatant, pozostawiając 0,5 - 1 ml. Osadzone agregaty pierwotne umieścić na płytce z odpowiednią ilością świeżej pożywki Primary Cancer Cell Medium D-ACF (C-28081) w oddzielnym nowym naczyniu hodowlanym poddanym działaniu odczynnika NCCD.
3b) Oddzielenie małych agregatów i pojedynczych komórek zawiesiny. Zbierz zużytą pożywkę zawierającą małe agregaty/pojedyncze komórki zawiesiny do oddzielnej stożkowej probówki o pojemności 15 ml. Przemyć pozostałe przylegające komórki dwukrotnie za pomocą PBS (D8537), natychmiast dodać odpowiednią ilość świeżej pożywki Primary Cancer Cell Medium D-ACF (C-28081) i umieścić je z powrotem w inkubatorze.Wirować próbkę zawiesiny komórek przez 10 minut z prędkością 240 x g w temperaturze RT. Pozostawić 200 μl supernatantu, delikatnie odsysając zużytą pożywkę, ponieważ osad może być dość luźny. Ponownie zawiesić i umieścić komórki w odpowiedniej ilości świeżej pożywki Primary Cancer Cell Medium D-ACF (C-28081) w oddzielnym nowym naczyniu hodowlanym potraktowanym odczynnikiem NCCD.
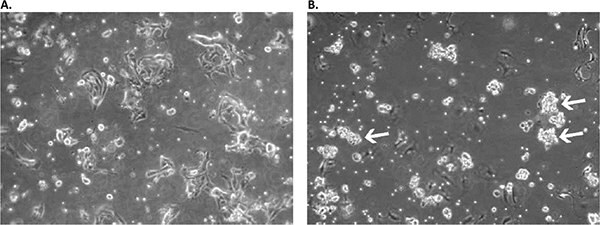
Rysunek 2. Wygląd pierwotnej hodowli komórek raka płaskonabłonkowego płuc w pożywce D-ACF we wczesnych stadiach.A) Hodowla w 2. dniu po początkowym posianiu: można zaobserwować mieszaninę resztkowych erytrocytów, przylegających komórek podobnych do fibroblastów i nabłonka, a także pływających pojedynczych komórek zawiesiny. B) W 11 dniu, tworzenie się pływających agregatów komórek wielokomórkowych jest już widoczne (białe strzałki). Hodowlę wykorzystano do pierwotnego oddzielenia agregatów w dniu 13 i dodatkowo hodowano w nowej kolbie równolegle do oryginalnej próbki zawierającej pozostałą frakcję komórek przylegających.
- Zmień pożywkę podczas selekcji komórek nowotworowych (co 10 - 14 dni). Po pomyślnym zakończeniu kroku 3, całkowicie wymień pożywkę wszystkich próbek co 10 - 14 dni, jak opisano poniżej. Odpowiednia technika zmiany pożywki będzie zależeć od wzorca wzrostu odpowiedniego izolatu pierwotnego.
4a) Zmień pożywkę dla kultur przylegających.Zużytą pożywkę z przylegającymi komórkami przepłukać dwukrotnie PBS (D8537) i dodać odpowiednią ilość świeżej pożywki.) i dodać odpowiednią ilość świeżej pożywki Primary Cancer Cell Medium D-ACF (C-28081) do komórek.
4b) Zmień pożywkę dla dużych agregatów komórek (≥ 70 μM). Zbierz zużytą pożywkę zawierającą agregaty zawiesiny w oddzielnej probówce stożkowej o pojemności 15 ml. Jeśli ma to zastosowanie, przemyj pozostałe przylegające komórki dwukrotnie PBS (D8537), natychmiast dodaj odpowiednią ilość świeżej pożywki Primary Cancer Cell Medium D-ACF (C-28081) i umieść je z powrotem w inkubatorze. Pozostawić probówkę z agregatami zawiesiny w pozycji pionowej na 12 minut w temperaturze RT w celu sedymentacji grawitacyjnej większych agregatów komórek. Następnie delikatnie odessać supernatant, pozostawiając 0,5-1 ml. Ostrożnie przenieś sedymentowane agregaty za pomocą pipety serologicznej do naczynia hodowlanego poddanego działaniu NCCD, zawierającego odpowiednią ilość świeżej pożywki Primary Cancer Cell Medium D-ACF (C-28081).
4c) Zmień pożywkę dla małych agregatów i pojedynczych komórek zawiesiny. Zbierz zużytą pożywkę zawierającą małe agregaty/pojedyncze komórki zawiesiny do oddzielnej stożkowej probówki o pojemności 15 ml. Jeśli ma to zastosowanie, przemyj pozostałe przylegające komórki dwukrotnie PBS (D8537), natychmiast dodaj odpowiednią ilość świeżej pożywki Primary Cancer Cell Medium D-ACF (C-28081) i umieść je z powrotem w inkubatorze. Wirować próbkę zawiesiny komórek przez 10 minut z prędkością 240 x g w temperaturze RT. Pozostaw 200 μl supernatantu podczas delikatnego odsysania zużytej pożywki, ponieważ osad może być dość luźny. Zawiesić osad w świeżej pożywce Primary Cancer Cell Medium D-ACF (C-28081) i użyć pipety serologicznej.) i za pomocą pipety serologicznej przenieś zawiesinę komórek do naczynia hodowlanego poddanego działaniu NCCD, zawierającego odpowiednią ilość świeżej pożywki Primary Cancer Cell Medium D-ACF (C-28081).
- Określ wzór wzrostu wyizolowanych komórek nowotworowych (tygodnie 2 - 4). Adherentnie rosnące komórki nowotworowe można zazwyczaj zidentyfikować w ciągu 2 - 4 tygodni po umieszczeniu na pożywce, ponieważ są one obecne jako wolno rosnące kolonie. Postępuj zgodnie z regularnym harmonogramem zmiany pożywki dla komórek przylegających bez pasażowania komórek, aż osiągną odpowiedni poziom konfluencji (patrz krok 7).
- Użyj oczyszczonych złośliwych komórek do swoich eksperymentów (tydzień 4+). Po upewnieniu się, że wszystkie niepożądane łagodne komórki zostały wyeliminowane, możesz skonfigurować eksperymenty z wyizolowanymi komórkami nowotworowymi. Alternatywnie, komórki mogą być pasażowane i dalej ekspandowane (patrz krok 7).
- Pasażowanie pierwotnej hodowli komórek nowotworowych. Pasażowanie komórek przed ich proliferacją do wysokiego poziomu konfluencji nie jest zalecane. Dopóki tego nie zrobią, kontynuuj zmianę pożywki zgodnie z opisem w kroku 4.
7a) Przeprowadź hodowle zawiesinowe. Zwiększ całkowitą objętość hodowli, dodając świeżą pożywkę i podziel ją na dwa (lub więcej) świeże naczynia poddane działaniu NCCD. Używaj sedymentacji grawitacyjnej do regularnej wymiany pożywki, aby zmniejszyć ilość zanieczyszczeń w hodowli. Uwaga: W przeciwieństwie do innych typów hodowli sferycznych, nie jest konieczna dezagregacja skupisk komórek, ponieważ agregaty komórek złośliwych rozmnażają się autonomicznie w tych warunkach hodowli.
7b) Przeprowadź adherentne komórki. Przygotuj nowe naczynia hodowlane poddane działaniu NCCD. W zależności od ogólnej konfluencji, wykonaj podział hodowli 1:1 lub 1:2 przy użyciu Accutase (A6964).
B) Protokół usuwania zanieczyszczających komórek nienowotworowych z pierwotnych hodowli komórek nowotworowych
- Obróbka NCCD naczyń plastikowych z powierzchnią TC.Rozcieńczyć rozmrożony roztwór podstawowy odczynnika NCCD w stosunku 1:20 z PBS bez Ca2+/Mg2+ (D8537). Użyć 100 μL/cm2 powierzchni hodowli, aby potraktować naczynie do hodowli tkankowej rozcieńczonym odczynnikiem NCCD i pozostawić naczynie zamknięte przez co najmniej 1 godzinę w temperaturze RT. Upewnić się, że roztwór NCCD pokrywa całą powierzchnię naczynia. Odessać roztwór NCCD tuż przed posianiem komórek.
- Określić wzorzec wzrostu komórek złośliwych. Przeprowadź ustaloną hodowlę zawierającą komórki złośliwe w zwykły sposób. Umieść próbkę komórek w naczyniu traktowanym NCCD, zawierającym odpowiednią ilość pierwotnej pożywki dla komórek nowotworowych D-ACF (C-28081). Hoduj komórki zgodnie z opisem w protokole III. 1-7. Monitoruj hodowlę pod kątem proliferacji komórek złośliwych, które Cię interesują i określ ich wzorzec wzrostu.
Uwaga: Komórki złośliwe mogą rosnąć przylegająco i/lub jako kule w zawiesinie. Podczas fazy indukcji mogą one namnażać się wolniej niż w ustalonych standardowych warunkach hodowli. Hodowla powróci jednak do normy, gdy tylko komórki niezłośliwe zostaną w znacznym stopniu usunięte (w przejściu 2 i 3), a hodowane komórki w pełni przystosują się do nowych warunków.
- Oczyść hodowlę.Po zidentyfikowaniu wzorca wzrostu komórek złośliwych, które Cię interesują w tych selektywnych warunkach hodowli, przeprowadź hodowlę do pierwotnej pożywki dla komórek nowotworowych D-ACF (C-28081). Rozszerzaj i pasażuj komórki zgodnie z wymaganiami (III.7) od 2 do 3 razy w celu pozbawienia hodowli komórek niezłośliwych.
Wyniki
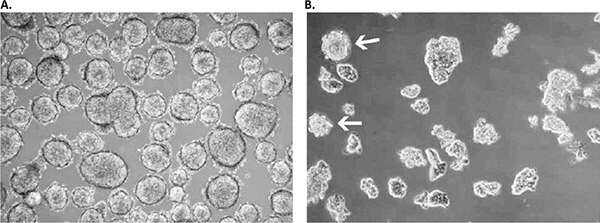
Rysunek 3. Hodowla pierwotna uzyskana z drobnokomórkowego raka płuca o niskim stopniu złośliwości przy użyciu systemu Primary Cancer Culture System.A) Pierwotny izolat uzyskano po 4 tygodniach jako pływającą kulturę kulistą, która utrzymywała się w stanie bliskim spoczynku nawet po 6 miesiącach. B) Dodanie dodatkowych czynników wzrostu spowodowało znaczną ekspansję w utajonej kulturze sferycznej z podwojeniem czasu 3-4 tygodni. Należy zauważyć, że niektóre sfery utrzymywały się w tych zmodyfikowanych warunkach hodowli (białe strzałki), podczas gdy większa część hodowli rozmnażała się jako pływające planarne wielokomórkowe arkusze 2D, co jest prototypowym wzorem wzrostu komórek SCLC in vitro.
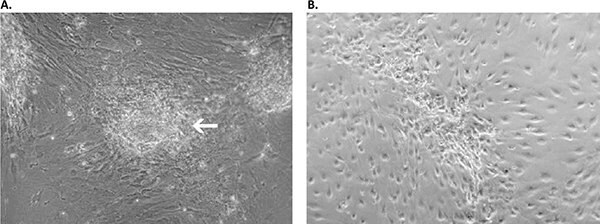
Rysunek 4. Hodowla pierwotna uzyskana z inwazyjnego gruczolakoraka przy użyciu systemu Primary Cancer Culture System. A) W ciągu pierwszych dwóch tygodni procesu izolacji komórki nowotworowe pojawiły się jako miejscowo ograniczone, lekko przylegające wypukłe skupiska komórek (biała strzałka) na wierzchu warstwy zrębu. B) Po 4 tygodniach wysoce ruchliwe komórki nowotworowe zaczęły migrować ze swoich pierwotnych lokalizacji, pokrywając całą powierzchnię hodowli. Komórki te namnażały się jako jednorodna populacja w pierwotnej pożywce dla komórek nowotworowych D-ACF.
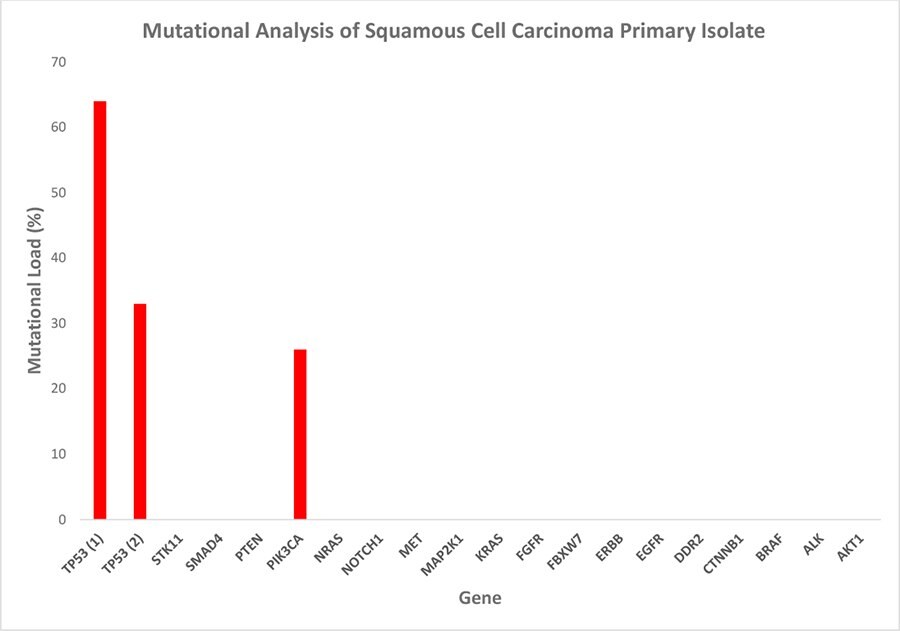
Rysunek 5. Analiza mutacyjna izolatu pierwotnego raka płaskonabłonkowego. Test panelu nowotworowego wykrył trzy mutacje typu hotspot: jedną w genie pik3ca i dwie w tp53. Wysoki ładunek mutacji wskazuje na selektywnie wzbogaconą hodowlę komórek złośliwych, podczas gdy różne wartości procentowe poszczególnych mutacji sugerują utrzymanie heterogeniczności subpopulacji komórek nowotworowych in vitro. Obciążenie mutacyjne = procent zmutowanych transkryptów / całkowita liczba transkryptów danego wariantu transkryptu.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?