Określanie wiązania białek - badanie porównawcze technik i urządzeń
M. James Ross, Senior R&D Scientist,
Olga Shimelis, R&D, R&D Manager Sample Preparation,
Candace Price, Product Manager Sample Prep – SPE and BioSPME
Merck

Ważnym aspektem odkrywania leków jest zrozumienie interakcji kandydata na lek z białkami i lipidami osocza. Wiązanie leków z białkami i lipidami jest określane jako wiązanie z białkami osocza (PPB lub Fb). Atrybuty molekularne leku mogą zapewnić użyteczny wgląd w liczbę jego interakcji z białkiem. Ogólnie rzecz biorąc, kwasy organiczne mają pojedyncze miejsce wiązania z albuminą, podczas gdy zasady organiczne mają wiele miejsc wiązania związanych z glikoproteinami.1 Oprócz albuminy, innymi białkami powszechnie związanymi z wiązaniem leków są alfa-1-kwasowa glikoproteina (AAG) i lipoproteiny, takie jak lipoproteina o bardzo dużej gęstości (VHDL) i lipoproteina o małej gęstości (LDL).2 Podczas pomiaru farmakologicznej siły działania leku, jest to wolna frakcja lub niezwiązana frakcja (FU) leku, która jest ogólnie uważana za odpowiedzialną za jego aktywność, jak opisano w hipotezie wolnego leku.3,4,5
Określenie właściwości wiązania białek przez lek jest ważne dla zrozumienia ilości wolnego leku dostępnego we krwi. Do tej pory tradycyjną techniką stosowaną do pomiaru wiązania białek leku była równowagowa dializa membranowa. Technika ta polega na równoważeniu próbki osocza bogatej w lek z buforem wolnym od leku przez membranę. Pozwala to na migrację wolnego leku przez błonę i zapobiega przemieszczaniu się leku związanego z białkami do buforu. Ustanowienie tej równowagi zajmuje ponad 24 godziny. Inne techniki, takie jak szybka dializa równowagowa, dodatkowo skracają czas pracy z 24 godzin do 6 godzin dzięki zastosowaniu specjalnie zaprojektowanych urządzeń.
W tym badaniu, Urządzenie Supel™ BioSPME 96-Pin jest używane do pomiaru wiązania białek leków. Urządzenia Supel™ BioSPME 96-Pin zostały opracowane przy użyciu technologii mikroekstrakcji do fazy stałej, SPME, w celu ekstrakcji wolnych niezwiązanych analitów z płynów biologicznych. Urządzenia te składają się z 96-pinowej płytki, której końcówki pokryte są cienką warstwą cząstek adsorbentu. Opatentowany środek wiążący w powłoce umożliwia wiązanie małych analitów, jednocześnie zapobiegając wiązaniu makrocząsteczek. Umożliwia to solidną, selektywną i niewyczerpującą ekstrakcję wolnych analitów, mającą zastosowanie zarówno jakościowe, jak i ilościowe. Konfiguracja 96-pinowa umożliwia bezpośrednie pobieranie próbek z 96-dołkowych płytek i jest kompatybilna ze zrobotyzowanymi systemami obsługi cieczy, zapewniając w pełni zautomatyzowaną metodologię o wysokiej przepustowości.
W tym badaniu porównano przepływ pracy urządzenia Supel™ BioSPME 96-Pin z techniką szybkiej dializy równowagowej do pomiaru wiązania białek leków. Seria związków o masach cząsteczkowych w zakresie 230-750 Da i hydrofobowości (LogP) w zakresie 1,5-5 została wykorzystana do porównania wartości wiązania białek i określona przy użyciu każdej z technik. Oprócz zmierzonych wartości i dokładności, w badaniu porównano ogólną czystość próbki i czas przepływu pracy dla każdej techniki.
Metoda eksperymentalna
Oznaczanie wiązania białek przy użyciu urządzenia Supel™ BioSPME 96-Pin Device
Osocze ludzkie i sól fizjologiczna buforowana fosforanami (PBS) zostały dodane w stężeniu terapeutycznie istotnym i inkubowane przez godzinę w temperaturze 37 °C przy wytrząsaniu z prędkością 300 obr. Po inkubacji 200 μl osocza i PBS załadowano do dołków w oddzielnych kolumnach płytki z dołkami ekstrakcyjnymi (n = 8). Proces oznaczania wiązania białek przy użyciu urządzenia Supel™ BioSPME 96-Pin przeprowadzono za pomocą zautomatyzowanego zrobotyzowanego systemu obsługi cieczy. Krótko opisane na Rysunku 1, urządzenie pinowe jest kondycjonowane statycznie (bez wstrząsania) przez dwadzieścia minut w izopropanolu, a następnie przenoszone do nowej płytki zawierającej wodę na 10 sekund (etap płukania). Po tym następuje etap ekstrakcji, w którym urządzenie szpilkowe jest przenoszone do wstępnie załadowanej płytki ze studzienką ekstrakcyjną, a ekstrakcja analitu odbywa się podczas wytrząsania przy 1200-1250 obr / min w temperaturze 37 ° C przez 15 minut. Urządzenie szpilkowe jest ponownie umieszczane w roztworze wodnym w celu 60-sekundowego płukania, a następnie przenoszone do płytki ze studzienką desorpcyjną na ostatni etap. Roztwór desorpcyjny jest mieszaniną 80:20 metanol:woda, a urządzenie szpilkowe poddawane jest desorpcji przez 20 minut w warunkach statycznych.
Rysunek 2 pokazuje, jak 96-pinowe urządzenie Supel™ BioSPME jest manewrowane przez chwytak zautomatyzowanego systemu podawania cieczy.

Rysunek 2. 96-pinowe urządzenie Supel™ BioSPME na zautomatyzowanym systemie podawania cieczy.
Rysunek 3 przedstawia ekstrakcję wolnego, niezwiązanego analitu do urządzenia Supel™ BioSPME 96-Pin. Wyekstrahowana ilość nie wpływa znacząco na stężenie wolnego analitu i jest określana jako niewyczerpująca. Ponieważ roztwór buforowy jest uważany za w 100% wolny, urządzenie Supel™ BioSPME 96-Pin ekstrahuje więcej z buforu niż z osocza.
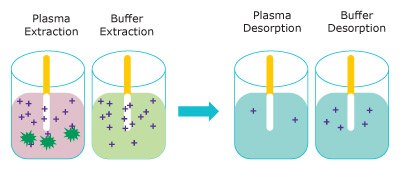
Rysunek 3. Przedstawienie etapu ekstrakcji (po lewej) usuwania wolnych analitów z osocza (różowy) i buforu (niebieski) oraz uwalniania analitów do roztworu desorpcyjnego (po prawej). (ciemnozielony = białka, fioletowy = analit)
Płytki do ekstrakcji stosowane w tym badaniu obejmowały zarówno plastikowe, jak i pokryte szkłem. Wybór płytki zależał od właściwości związku i tego, jak dobrze związek zachowywał się w roztworze buforowym. Stwierdzono, że bardziej hydrofobowe związki, takie jak ketokonazol i imipramina, wykazują niespecyficzne wiązanie z plastikiem, a zatem mają lepszą wydajność ekstrakcji z 96-dołkowych płytek pokrytych szkłem. Ekstrakcje erytromycyny i propranololu przeprowadzono również przy użyciu płytek pokrytych szkłem ze względu na ich wyższe wartości wydajności ekstrakcji w porównaniu do ekstrakcji z płytek plastikowych.
Oznaczanie wiązania białek metodą szybkiej dializy równowagowej
Szybką dializę równowagową przeprowadzono zgodnie z instrukcją produktu. Do odpowiednich komór urządzenia do szybkiej dializy równowagowej załadowano dwieście mikrolitrów ludzkiego osocza "z domieszką" w stężeniu terapeutycznie istotnym i 400 μl soli fizjologicznej buforowanej fosforanem (PBS), w co najmniej trzech zestawach. Dializę prowadzono przez co najmniej 4 godziny pod przykryciem i wytrząsaniem przy 300 obr/min i temperaturze 37°C w wytrząsarce Eppendorf®. Pod koniec dializy, 50 μL wzbogaconego osocza zmieszano z 50 μL czystego (nie wzbogaconego) PBS, a 50 μL dializatu (przedział buforowy) zmieszano z 50 μL czystego osocza. Zrobiono to, aby zapewnić spójność matrycy. Następnie rozpoczęto wytrącanie białka przez dodanie 300 μL lodowatego acetonitrylu do każdej próbki przed wirowaniem przy 5000 obr/min przez 10 minut w temperaturze 4ºC. Na koniec supernatant przeniesiono do szklanych fiolek do analizy LC-MS/MS.
Próbki przygotowane przy użyciu zarówno urządzenia Supel™ BioSPME 96-Pin, jak i urządzenia do szybkiej dializy równowagowej analizowano metodą LC-MS/MS. Analizy chromatograficzne i spektrometryczne przeprowadzono w systemie Agilent 1290 / AB Sciex 6500 LC-MS/MS zgodnie z warunkami opisanymi w Tabeli 1. Ilościowanie przeprowadzono przy użyciu zewnętrznej kalibracji w roztworze desorpcyjnym.
Results & Discussion
Metoda Supel™ BioSPME określa wolne stężenie analitu w osoczu poprzez porównanie go z ekstrakcją tego samego analitu z próbek buforowych, gdzie 100% analitu jest uważane za wolne od wiązania białek. Urządzenia Supel™ BioSPME 96-pin zostały bezpośrednio porównane z techniką szybkiej dializy równowagowej, ponieważ jest ona często uważana za standardowe podejście i przepływ pracy z wyboru do oznaczania wiązania białek w osoczu. 96-pinowe urządzenia Supel™ BioSPME wykazują liczne zalety w porównaniu z techniką szybkiej dializy równowagowej, pod względem oszczędności czasu, czystości próbki i uproszczonego przepływu pracy, przy jednoczesnym zachowaniu tych samych wysokich standardów dokładności i odtwarzalności, których potrzebują laboratoria bioanalityczne wykonujące tę analizę. Porównanie wartości wiązania białek uzyskanych przy użyciu metody szybkiej dializy równowagowej i metody Supel™ BioSPME przedstawiono poniżej na Rysunku 4.
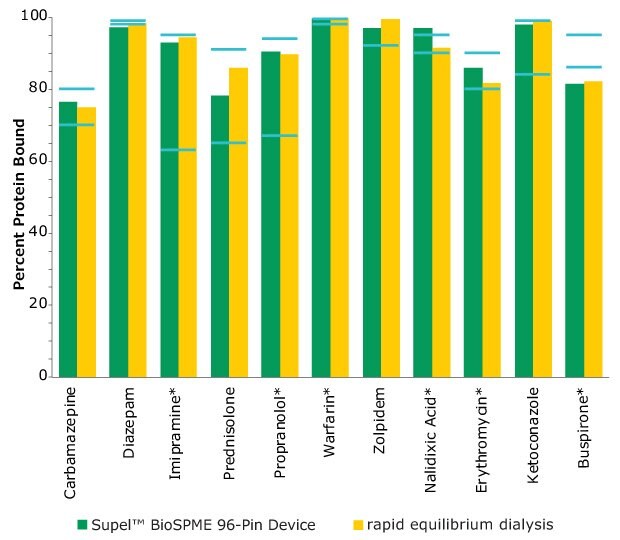
Rysunek 4. Porównanie wartości wiązania białek między urządzeniem Supel™ BioSPME 96-Pin Device a metodami szybkiej dializy równowagowej. Niebieskie linie wskazują opublikowane literaturowe przedziały wartości wiązania białek. Związki z gwiazdkami są naładowane przy fizjologicznym pH.
Dane z Rysunku 4 przedstawiono w formie tabelarycznej w Tabeli 2. Wartości z metody BioSPME są w dobrej zgodności z wartościami określonymi przy użyciu urządzeń do szybkiej dializy równowagowej i wartościami podanymi w literaturze.
Porównanie czasu przepływu pracy: urządzenie Supel™ BioSPME vs szybka dializa równowagowa
Ponieważ laboratoria o wysokiej przepustowości są zawsze zainteresowane optymalizacją wydajności w jak największym stopniu, czas wykonania każdego z przepływów pracy został oceniony w celach porównawczych. Przepływ pracy urządzenia Supel™ BioSPME 96-Pin (<2 godziny) zajmuje jedną trzecią czasu, jaki zajmuje przepływ pracy szybkiej dializy równowagowej (6 godzin), jak pokazano w Tabeli 3. Daje to możliwość trzykrotnego zwiększenia przepustowości, umożliwiając wykorzystanie urządzenia do obsługi cieczy do innych testów i dając naukowcowi czas na inne projekty.
Conclusion
Technika Urządzenie Supel™ BioSPME 96-Pin wykazało znaczną oszczędność czasu przy oznaczaniu wiązania białek w porównaniu z metodą szybkiej dializy równowagowej. Ponieważ przepływ pracy dla urządzenia Supel™ BioSPME 96-Pin jest krótszy niż dwie godziny w porównaniu do metody szybkiej dializy równowagowej, trzykrotnie zwiększa przepustowość. Ponadto, format urządzenia Supel™ BioSPME 96-Pin pozwala na w pełni zautomatyzowaną metodę zrobotyzowaną, bez potrzeby stosowania dodatkowego sprzętu, tj. wirówki, co jest wymagane podczas wykonywania metody szybkiej dializy równowagowej. Przekłada się to na zwiększoną produktywność i ograniczenie czynności wykonywanych ręcznie w laboratorium. Dokładność wartości wiązania białek uzyskanych przy użyciu urządzenia Supel™ BioSPME 96-Pin jest zgodna z wartościami uzyskanymi przy użyciu metody szybkiej dializy równowagowej; jak wykazano w przypadku 10 związków o różnych wartościach LogP. Opatentowane spoiwo i powłoka urządzenia Supel™ BioSPME 96-Pin pozwala na selektywną ekstrakcję docelowych analitów, przy jednoczesnym wykluczeniu większych makrocząsteczek, aby zapewnić szybki i dokładny pomiar wiązania białek leku.
Zobacz plik PDF z pełną notą aplikacyjną.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?