Kolumny i standardy analityczne dla Protein SEC
Judith Vajda (Tosoh Corp.), Eva Katharina Richter
Analytix 2014, Volume 1
Chromatografia wykluczania wielkości białek do oznaczania masy cząsteczkowej

Wodna chromatografia wykluczania (SEC) ma ugruntowaną pozycję w charakteryzowaniu białek. Technika ta była wykorzystywana do kontroli jakości leków biologicznych od wczesnych dni rozwoju rekombinowanych białek do celów farmaceutycznych, a udoskonalenia metod ewoluowały. Obecnie kolumny (U)HPLC opracowane do określonych zadań separacji i gotowe do użycia standardy ułatwiają opracowywanie metod i zwiększają niezawodność metod SEC.
Analityczna chromatografia wykluczania może być stosowana zawsze, gdy próbka zawiera cząsteczki, które muszą być rozdzielone i scharakteryzowane na podstawie wielkości. Technika ta wykorzystuje wysoce porowate cząsteczki, które są upakowane w kolumnie chromatograficznej. W zależności od wielkości cząsteczki w próbce, może ona mieć dostęp do wszystkich porów, ograniczony dostęp do niektórych porów lub brak dostępu do porów. W oparciu o tę zasadę podziału, najpierw eluowane są największe cząsteczki, a następnie składniki próbki o coraz mniejszych rozmiarach. Po pomyślnym rozdzieleniu próbki, rozmiary cząsteczek próbki można określić za pomocą dwóch podstawowych metod wykrywania. Statyczne rozpraszanie światła oferuje możliwość określenia masy cząsteczkowej. Masy cząsteczkowe są obliczane na podstawie sygnału rozpraszania światła i sygnału współczynnika załamania światła i są niezależne od grubości powłoki hydratacyjnej cząsteczek. Wadą tego podejścia jest koszt sprzętu i porównywalnie wysoka podatność detektora rozpraszania światła na zakłócenia tła. Chociaż rozpraszanie światła zostało z powodzeniem zastosowane w wielu aplikacjach, czasami bardziej klasyczne podejście do określania wielkości cząsteczek przewyższa statyczne rozpraszanie światła.
Krzywa kalibracyjna chromatografii wykluczania
Aby uzyskać krzywą kalibracyjną SEC białka, mieszanina kalibracyjna składająca się z różnych cząsteczek o znanej wielkości została wstrzyknięta na tę samą kolumnę, która została użyta do próbki. Czas retencji każdego składnika uzyskano z chromatogramu kalibracyjnego i wykreślono względem logarytmicznej masy cząsteczkowej. Sporządzono krzywe kalibracyjne dla trzech kolumn U(HPLC), które zostały opracowane do analizy immunoglobuliny G (Rysunek 1). TSKgel® SuperSW mAb HTP został opracowany w celu łatwego transferu metody z HPLC do szybkiej analizy UHPLC, TSKgel® SuperSW mAb HR zapewnia doskonałą rozdzielczość fragmentów, monomerów i agregatów w jednym przebiegu, a TSKgel® UltraSW Aggregate obejmuje wyższe masy cząsteczkowe i najlepiej oddziela dimery przeciwciał i wyższe agregaty. Aktualną listę produktów i informacje dotyczące zamawiania można znaleźć na stronie sigma-aldrich.com/tsk.
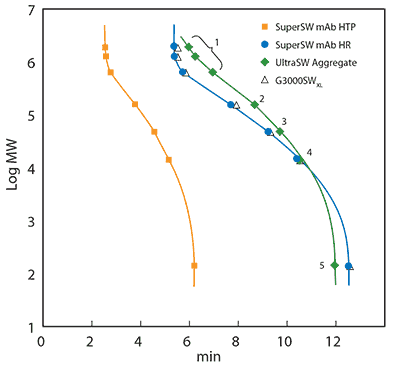
Rysunek 1. Krzywe kalibracji TSKgel® SuperSW mAb HTP 4,6 mm ID x 15 cm L, TSKgel® SuperSW mAb HR, TSKgel® UltraSW Aggregate i TSKgel® G3000SWxl, obie 7,8 mm ID x 30 cm L.
Faza ruchoma: 0,2 M bufor fosforanu sodu, pH 6,7 i 0,05% azydek sodu. Białka kalibracyjne: tyreoglobulina (640 kDa), γ-globulina (155 kDa), albumina (47 kDa), rybonukleaza A (13,7 kDa) i kwas ρ-aminobenzoesowy (0,14 kDa), wszystkie zawarte w Protein Standard Mix 15-600 kDa. Objętość iniekcji: 10 µL. Szybkość przepływu: 0,35 mL/min (4,6 mm ID) lub 1 mL/min (7,8 mm ID). Wykrywanie: UV @280 nm
Krzywe kalibracji wykazują liniową korelację między czasem retencji a pewnym zakresem mas cząsteczkowych. Ten zakres mas cząsteczkowych nazywany jest liniowym zakresem kalibracji kolumny i działa jako optymalny zakres roboczy dla separacji. Jeśli próbka nie eluuje w tym zakresie, zazwyczaj wymaga ona zastosowania kolumny SEC o mniejszych lub większych porach. Ponadto, właściwy dobór kolumny i eluentu zapewnia uniknięcie oddziaływań wtórnych, które mogą zmienić czas retencji.
Gotowy do użycia wzorzec kalibracyjny dla Protein SEC
Mieszanina kalibracyjna powinna zawierać cząsteczki, które są podobne do analizowanych cząsteczek próbki. Chromatografia wykluczania wielkości rozdziela cząsteczki zgodnie z ich wielkością hydrodynamiczną, która zależy od grubości powłoki hydratacyjnej. Stopień hydratacji molekularnej w danym rozpuszczalniku jest określany przez właściwości molekularne, takie jak polarność. Często jako wzorce stosowane są glikole polietylenowe ze względu na ich monodyspersyjność. Cząsteczki używane do kalibracji powinny przypominać tylko jedną masę cząsteczkową na pik. Ponadto, glikole polietylenowe są dość stabilne i mogą być przechowywane w temperaturze pokojowej przez lata. Niestety, w przypadku analizy białek, glikole polietylenowe mają ograniczoną przydatność ze względu na znacznie grubszą powłokę hydratacyjną. Do oznaczania masy cząsteczkowej białek w SEC, białka powinny służyć jako wzorzec kalibracyjny. W związku z tym obsługa wzorca kalibracyjnego staje się bardziej skomplikowana, ponieważ zwykle pojawiają się problemy związane z białkami, takie jak degradacja białek. Mieszaniny kalibracyjne oparte na białkach mają ograniczony okres trwałości, co oznacza, że albo trzeba przygotować niewielkie ilości wzorca, albo duże ilości mieszaniny kalibracyjnej zostaną zmarnowane. Ogólnie rzecz biorąc, przygotowanie może być czasochłonne. Aby uniknąć przygotowywania wzorców, należy użyć gotowych do użycia wzorców.
Mieszanka wzorcowa białek dla SEC oferuje pełne pokrycie zakresu masy cząsteczkowej od 15 kDa do 600 kDa. To kwalifikuje ją do oznaczania masy cząsteczkowej większości białek. Mieszanina białek jest dostarczana w probówkach o pojemności 2 ml, które zawierają liofilizowane białko w proszku i wszystkie niezbędne jony buforowe. Wystarczy dodać wodę i wstrzyknąć wzorzec kalibracyjny. Umożliwia to szybką i łatwą kalibrację kolumny ze świeżo przygotowanym wzorcem. Gdy SEC jest stosowany w analizie QC biofarmaceutyków, głównym celem jest kwantyfikacja składników próbki, a nie określanie mas cząsteczkowych. W przypadku tego typu analiz SEC, wstrzyknięcie roztworu wzorcowego białka jest często wykorzystywane do testów przydatności systemu. Wzorzec białkowy jest wygodnym narzędziem ułatwiającym przygotowanie próbek przydatności systemu.
Kalibracja kolumny
Podczas kalibracji kolumny ważne jest, aby zastosować te same warunki, które zostały użyte do analizy. Zmiana systemów buforowych znacznie zmienia czas retencji. Na przykład arginina jest często stosowanym dodatkiem do analizy agregatów przeciwciał monoklonalnych (mAb). Zapobiega ona wtórnym interakcjom hydrofobowych agregatów mAb z fazą stacjonarną [1, 2 i 3] i skraca czas retencji w SEC, co może być również spowodowane nieznacznie zmienioną powłoką hydratacyjną. Rysunek 2 ilustruje efekt dodania 200 mM argininy do fazy ciekłej w SEC zagregowanej próbki mAb.

Rysunek 2. Próbka przeciwciała monoklonalnego na agregacie TSKgel® UltraSW z 0,1 M buforem sodowo-fosforanowym zawierającym 0,2 M argininy w fazie ruchomej (czerwony). Po 10 iniekcjach faza ruchoma została przełączona na bufor sodowo-fosforanowy z 0,2 M siarczanem sodu (szary). Dla obu faz ruchomych pokazano wstrzyknięcie nr 10. Kolumna: TSKgel® UltraSW Aggregate. Przepływ: 1 ml/min. Objętość iniekcji: 20 µL. Wstrzyknięta masa: 100 µg. Wykrywanie: UV @ 280 nm.
Przesunięcia retencji, takie jak w przypadku dodatku argininy, doprowadziłyby do błędnego obliczenia mas cząsteczkowych, gdyby obliczenia odnosiły się do standardowej separacji kalibracyjnej, która nie wykorzystuje argininy w eluencie. Podobne efekty zaobserwowano w przypadku zmiany buforu fosforanowego na HEPES (dane nie pokazane). Oprócz zastosowanej fazy ciekłej, stężenie wzorca kalibracyjnego i objętość wtrysku mają kluczowe znaczenie dla prawidłowych czasów retencji i późniejszych obliczeń masy cząsteczkowej. Przeciążenie kolumn SEC powoduje utratę rozdzielczości i może prowadzić do przesunięcia czasów retencji. Przykładowe objętości iniekcji i stężenia wzorców zostały wstrzyknięte do TSKgel® SuperSW mAb HR. Protein Standard Mix firmy Sigma-Aldrich rozpuszczono w 200 µL, 500 µL i 1000 µL wody. Wyraźnie widać, że wysoce stężona próbka kalibracyjna nie jest prawidłowo rozdzielona. Efekt jest najbardziej znaczący dla największej objętości wstrzyknięcia 100 µL (Rysunek 3).

Rysunek 3.Protein Standard Mix 15-600 kDa na TSKgel® SuperSW mAb HR 7,8 mm ID x 30 cm L. Objętości iniekcji wahają się od 5 do 100 µL. Standard został przygotowany w różnych stężeniach: 1X, 2X i 5X. Eluent: 200 mM bufor fosforanu sodu, pH 6,7 i 200 mM siarczan sodu. Przepływ: 1 mL/min. Wykrywanie: UV @280 nm.
Wyniki te pokazują znaczenie odpowiedniej objętości i stężenia wtrysku. Tylko wtedy można obliczyć wiarygodne masy cząsteczkowe. Ponadto trwałe przeciążenie kolumny może prowadzić do jej wczesnego uszkodzenia. Dotyczy to również próbek. Wymagana ilość próbki do uzyskania wystarczającego znaczącego sygnału musi być zrównoważona ze skróconym czasem życia kolumny z powodu przeciążenia. Ogólnie rzecz biorąc, kolumny 7,8 mm ID x 30 cm L osiągają najlepsze wyniki i dłuższe czasy życia przy wstrzykiwaniu 20 µL próbek od 1 do 5 mg/mL.
Oznaczanie masy cząsteczkowej za pomocą SEC może być analizą o dobrej dokładności i powtarzalności. Należy jednak wziąć pod uwagę kilka podstawowych parametrów metodycznych. Gotowe do użycia wzorce kalibracyjne pozwalają na usunięcie potencjalnych źródeł błędów, takich jak ważenie małych ilości białka. Łatwa obsługa i odpowiednio skoncentrowane wzorce zapewniają wstrzyknięcie odpowiedniej ilości do kalibracji kolumny lub testowania przydatności systemu.
Referencje
TSKgel jest zastrzeżonym znakiem towarowym Tosoh Corporation
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?